肺癌是世界发病率和死亡率最高的肿瘤,非 小细胞肺癌(NSCLC)约占所有肺癌的80%,且多数 在确诊时已为晚期,其5年生存率不足15%[1]。以 小分子酪氨酸酶抑制剂(TKIs)吉非替尼、厄洛 替尼等为代表的分子靶向治疗因良好的临床疗效给晚期肺腺癌患者带来希望。但是随后耐药的产 生严重限制了其临床应用,而针对TKIs耐药,目 前临床尚缺乏有效的预防手段。
肺岩宁方是上海中医药大学附属龙华医院徐振 晔教授多年临床治疗肺癌的经验方,主要功效为补 肾益气养精、解毒散结抗癌。相关实验研究表明肺 岩宁方可能通过影响核小体构象调控因子的表达 干预异常细胞周期来抑制肺癌细胞生长增殖[2];可 能通过抑制血管生成[3, 4]、抑制上皮间质细胞转化 (EMT)[5]等来防治非小细胞肺癌的复发和转移。 临床研究[6]亦显示,该方对于肺气不足,肾精亏损 的非小细胞肺癌患者具有良好的临床疗效。我们 在前期的临床观察中发现[7],肺岩宁方联合TKIs可 显著延缓靶向药物耐药产生的时间,但是机制尚不 明确,本研究通过观察肺岩宁方联合吉非替尼对 H1975移植瘤生长及耐药相关因子的影响,旨在探 讨肺岩宁方防治靶向药物耐药的可能机制。 1 材料和方法 1.1 实验材料 1.1.1 实验动物与细胞株
Balb/c裸小鼠50只, 购于上海斯莱克实验动物有限公司(许可证号: SCXK(沪)2007-0005),雄性,4~6周龄,体 质量(20±2)g,于龙华医院实验动物中心,无特殊病 原菌(SPF)环境中饲养。人肺腺癌细胞株H1975 (EGFR exon20 T790M-L858R)购于美国物种保存 中心(American Type Culture Collection,ATCC), 细胞在37℃,5%CO2条件下培养于含10%胎牛血 清、100 u/ml青链霉素的RPMI1640培养液中。 1.1.2 主要实验试剂
肺岩宁方由生黄芪、黄精、 灵芝、七叶一枝花、山慈菇、干蟾皮等组成,由龙 华医院中药房提供,常规水煎,水浴浓缩至生药含 量为2.0 g/ml,4℃保存。吉非替尼购于阿斯利康公 司。TUNEL试剂盒购于Roche公司。Western blot用 抗体:EGFR、p-EGFR(Tyr1068)购于Epitomics 公司;Akt、p-Akt(Ser473)、mTOR、p-mTOR (Ser2448)购于Cell signaling公司。 1.2 实验方法 1.2.1 裸小鼠皮下移植瘤模型的建立及分组
取对 数生长期的H1975细胞用0.25%胰酶消化后,调至浓 度为1×107个/毫升的细胞悬液,接种于裸鼠左侧腋部 皮下,每只0.2 ml,待瘤块直径约3 mm左右,从中选 取肿瘤体积较均匀的40只裸小鼠随机分为4组:模型 组10只,0.9%氯化钠溶液(0.4 毫升/只)灌胃;吉非替 尼组10只,吉非替尼(40 mg/kg)灌胃;肺岩宁方组10 只,肺岩宁方(40 g/kg)灌胃;联合用药组10只,吉非替 尼(40 mg/kg)和肺岩宁(40 g/kg)灌胃。共给药4周。 1.2.2 肿瘤体积及肿瘤抑制率
给药期间一周 两次用游标卡尺测定肿瘤最长径(a)和最短径 (b),计算移植瘤体积V。计算公式:V(mm3) =ab2×1/2,根据肿瘤体积大小绘制肿瘤的生长 曲线图。于第28天称体重并处死裸鼠,取瘤块称 重,按照公式: 抑瘤率=(1-用药组平均瘤重/模 型组平均瘤重)×100%,计算抑制率。应用金正 均法[8],计算q值来评估两药合用效果,q=EA+B/ [EA+(1-EA)×EB],EA+B为两药合用时的抑瘤率,EA 和EB为各药单独应用时的抑瘤率。q<0.85表示两 药有拮抗作用,0.85≤q≤1.15表示两药有相加作 用,q>1.15表示两药有协同作用。 1.2.3 TUNEL法检测移植瘤凋亡指数
按照 TUNEL凋亡试剂盒说明书具体操作步骤进行,以 细胞核染成棕黄色的细胞为凋亡细胞,随机选取 5个高倍镜(×400)视野计算凋亡率,凋亡率= (凋亡细胞数/肿瘤细胞总数)×100%。 1.2.4 Western
blot法检测EGFR、p-EGFR (Tyr1068)、Akt、p-Akt(Ser473)、mTOR、 p-mTOR(Ser2448)等蛋白表达 取出冷冻肿瘤组织 在液氮中迅速研磨成粉末,加入细胞裂解液(含蛋 白酶和磷酸酶抑制剂),冰上裂解后于4℃ 12 000 g 离心15 min,取上清液,应用BCA分析试剂测定蛋 白浓度,50 μg蛋白质在SDS-PAGE电泳分离,半干 法转移至PVDF膜上,5%脱脂奶粉室温封闭2 h,一 抗4℃过夜,TBST洗膜3次,加入二抗室温孵育2 h, TBST洗膜3次,加入ECL发光液暗室中X线片显影, 图像扫描,以β-actin蛋白的表达为内参照,应用凝 胶图像分析软件分析目标条带灰度值。 1.3 统计学方法
应用SPSS18.0软件包进行统计学分析,计量资 料以均数±标准差 (x±s)表示,多样本间比较应用单 因素方差分析,以 P<0.05表示差异有统计学意义。 2 结果 2.1 肺岩宁、吉非替尼及联合用药对裸鼠移植瘤 生长的影响
根据肿瘤体积绘制肿瘤生长曲线,实验结束 时,各组肿瘤体积分别为:模型组(1 890.08±267.9) mm3;吉非替尼组(1 686.67.08±399.8)mm3;肺岩 宁组(1 520.42±187.9)mm3;联合用药组(987.83± 366.7)mm3。肺岩宁组、吉非替尼组与模型组相比 肿瘤生长差异无统计学意义,联合用药组与模型 组、吉非替尼组及肺岩宁方组相比,差异有统计学 意义(P <0.01),见图1。
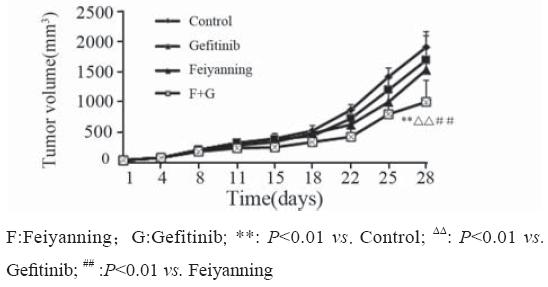 |
图1 肺岩宁联合吉非替尼对裸鼠移植瘤体积的影响 Figure 1 Effects of Feiyanning combined with gefitinib on tumor volume of H1975 xenografts |
实验结束后处死裸鼠,称瘤重及体重,计算 肿瘤抑制率,各组的抑瘤率为:模型组0;吉非 替尼组21.91%;肺岩宁方组25.11%;联合用药组 53.28%。吉非替尼组和肺岩宁方组瘤重与模型组 相比差异无统计学意义(P >0.05),联合组与单 用吉非替尼和肺岩宁组相比差异有统计学意义(P <0.01),两药合用q值为1.284,提示肺岩宁方与 吉非替尼联合后具有协同增效作用。 2.3 肺岩宁方、吉非替尼及联合用药对肿瘤凋亡的影响
应用TUNEL法检测肿瘤细胞凋亡情况,凋亡 细胞形态为:染色质浓缩、边缘化,核膜裂解, 染色质分割成块状。各组移植瘤组织中肿瘤细 胞的凋亡率分别为:模型组(15.11±1.6)%;吉 非替尼组(26.64±0.69)%;肺岩宁方组(28.88 ±1.61)%;联合用药组(55.06±2.39)%。联合 用药组能明显促使肿瘤凋亡,与模型组及单用吉 非替尼和肺岩宁方组相比差异有统计学意义(P <0.01),见图2、3。。
 |
图2 各组裸鼠H1975移植瘤肿瘤细胞TUNEL染色(TUNEL ×200) Figure2 TUNEL staining of H1975 xenografts in each group(TUNEL ×200) |
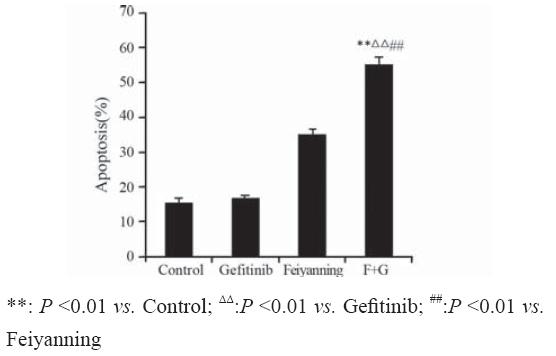 |
图3 各组裸鼠H1975移植瘤肿瘤细胞凋亡率情况 Figure3 Apoptosis rates of H1975 xenografts |
应用Western blot方法检测H1975移植瘤组 织中EGFR、p-EGFR、AKT、p-AKT、mTOR、p-mTOR的表达,结果显示肺岩宁方及联合用药 组可在不影响EGFR、AKT、mTOR等总蛋白表达 的情况下,下调其磷酸化水平,从而抑制EGFRPI3K/ AKT信号通路的活化,见图4。
 |
图4 肿瘤组织中EGFR-PI3K/AKT 信号通路相关蛋白的表达 Figure4 Expressions of EGFR-PI3K/AKT pathway related proteins in tumor tissues |
吉非替尼是目前用于NSCLC靶向治疗的第一 代小分子酪氨酸酶抑制剂(TKIs)药物,其作用 于酪氨酸激酶结构域的三磷酸腺苷(ATP)结合位 点,干扰ATP结合,能通过AKT和MAPK途径阻断 EGFR信号转导通路,阻止表达EGFR的人癌细胞生 长[9]。多数晚期肺腺癌患者可从TKIs治疗中获益。 然而无论近期疗效如何,经TKIs治疗后的NSCLC 患者最终都会不可避免的出现TKIs耐药。研究发 现在获得性耐药中约50%的是由于EGFR-T790M 突变,约5%~20%是因MET基因扩增,约30%原因 不明[10]。针对这些机制,虽已研发出第二代不可 逆TKIs,如BIBW2992(Afatinib)、PF-00299804 (Dacomitinib)等和第三代突变抑制剂CO-1686,以 及MET基因抑制剂等,但这些药物皆处于临床试验 阶段,具体疗效还有待于进一步评估。此外,TKIs 联合PI3K抑制剂或者mTOR抑制剂也有望克服TKIs 耐药,但这种治疗方案同样也处于临床前研究。因 此,目前临床上缺乏有效的手段防止TKIs耐药。
基于临床应用发现肺岩宁方联合TKIs可显著延 缓靶向药物耐药产生的时间,以及其对非小细胞肺 癌具有良好的临床疗效,本实验以含有EGFR-T790M 突变的肺腺癌细胞移植瘤细胞H1975为模型,观察 肺岩宁方、吉非替尼及联合用药的抑瘤效果。由于 EGFR-T790M突变后,酪氨酸激酶活化域的790位 苏氨酸残基被蛋氨酸取代,削弱了抑制剂与其靶点的 相互作用[11],不能阻断EGFR信号转导通路,故而对 吉非替尼耐药。但有趣的是,本研究结果显示肺岩宁 方联合吉非替尼却能明显抑制移植瘤的生长,促进 肿瘤凋亡,与单用肺岩宁方及吉非替尼相比差异有 统计学意义,两药合用q值为1.284,提示肺岩宁方与吉 非替尼联用具有协同增效作用。那么这种协同作用 是否与抑制EGFR信号通路有关呢?课题组检测了 EGFR信号通路相关蛋白EGFR、p-EGFR、AKT、 p-AKT、mTOR、p-mTOR等表达水平,结果显示肺 岩宁方联合吉非替尼在不影响EGFR、AKT、mTOR 总蛋白表达的情况下,可显著下调p-EGFR、p-AKT、 p-mTOR水平,从而抑制EGFR-PI3K/AKT信号通路的 活化,与单用肺岩宁方及吉非替尼相比差异有统计 学意义,提示肺岩宁方与吉非替尼联用后,可能通过 阻断EGFR-PI3K/AKT信号通路来抑制H1975肺腺癌 移植植瘤生长,促进其凋亡。
综上所述,肺岩宁方联合吉非替尼可能通过 阻断EGFR信号通路,抑制EGFR、AKT、mTOR 等蛋白的活化,从而抑制肿瘤增殖,促进凋亡。 那么,肺岩宁方是如何协同吉非替尼来阻断EGFR 信号通路的,是改变了吉非替尼与EGFR-T790M 突变位点的结合,还是影响了吉非替尼在体内的代谢过程?这些还有待于进一步研究证实。
| [1] | Alberg AJ,Samet JM.Epidemiology of lung cancer[J]. hest,2003,123(1 Suppl):21S-49S. |
| [2] | Zheng Z, Wang JY, Wang Q, et al. Effects of Chinese herbal edicine Feiyanning decoction on expressions of nucleosome onformation-regulating factors H3-K56, Rttl09, Asf1 and E2F1 n Lewis-bearing mice[J].Zhong Xi Yi Jie He Xue Bao, 2012,10 4): 448-53.[郑展,王菊勇,王青,等. 肺岩宁对Lewis肺癌荷瘤 鼠瘤组织中核小体构象调控因子H3-K56、Rtt109、Asf1及 2F1表达的影响[J].中西医结合学报,2012,10(4): 448-53.] |
| [3] | Wang ZQ, Deng HB, Wu J, et al. The relationships between ngiogenesis and matrix metalloproteinase-2,-9 in mice tumor ntervened by Feiyanning recipe’s components[J]. Zhongguo hong Xi Yi Jie He Za Zhi,2011, 31(9):1229-33. [王中奇, 邓海 , 吴继, 等.肺岩宁方组分对小鼠肿瘤血管生成与MMP-2、 MP-9关系的研究[J].中国中西医结合杂志, 2011, 31(9): 229-33.] |
| [4] | Wang ZQ, Deng HB, Zhang LM, et al. The effects of Feiyanning ecipe’s components on tumor growth, pulmonary metastasis nd microvessel density in Lewis lung cancer mice. China ournal of Traditional Chinese Medicine and Pharmacy[J]. 012,27(2):477-80. [王中奇, 邓海滨, 张丽曼, 等.中药肺岩宁方 其拆方对小鼠Lewis肿瘤生长、肺转移和微血管密度的影响 |
| [5] | Zhao XZ, Wu ZH, Xu ZY, et al. Effects of Feiyanning on the xpression of epithelial-mesenchymal factors in highly metastatic ung cancer cells 95-D[J]. Zhongguo Fei Ai Za Zhi, 2011,14(6): 67-71. [赵晓珍, 吴中华, 徐振晔, 等. 肺岩宁方对人高转移 5-D肺癌细胞上皮-间质细胞标志因子表达的影响[J].中国肺杂志, 2011, 14(6): 467-71.] |
| [6] | Xu ZY, Jin CJ, Shen DY, et al. Clinical study on treantment of dvanced non-small-cell lung cancer with chinese herbal medicine n different stages combined with chemotherapy[J]. Zhongguo hong Xi Yi Jie He Za Zhi, 2007, 27(10):874-8.[徐振晔, 金长 , 沈得义, 等.中药分阶段结合化疗治疗晚期非小细胞肺癌的 床研究[J].中国中西医结合杂志,2007,27(10):874-8.] |
| [7] | Kang XH,Wang LF,Wang ZQ,et al.Clinical observation of eiyanning recipe delay EGFR-TKIs resistance in advanced lung denocarcinoma [J].Xin Zhong Yi,2012,44(9):52-4.[康小红, 王立 , 王中奇, 等.肺岩宁方延缓TKIs靶向治疗晚期肺腺癌耐药的 床观察[J].].新中医,2012,44(9):52-4.] |
| [8] | Jin ZJ. The additive effect in drug combination[J]. Zhongguo Yao i Xue Bao, 1980, 1(2):70-6. [金正均. 合并用药中的相加[J]. 中国药理学报, 1980, 1(2):70-6.] |
| [9] | Bruton A. What went wrong with Iressa [J]. Lancet Oncol, 2002, (12):708. |
| [10] | Engelman JA, Zejnullahu K, Mitsudomi T, et al. MET mplification leads to gefitinib resistance in lung cancer by ctivating ERBB3 signaling[J]. Science, 2007, 316(5827): 039-43. |
| [11] | Balk MN, Gong Y, Riely GJ,et al. Novel D761Y anc common econdary T790M mutations in epidermal growth factor receptormutant ung adenocarcinomas with acquired resistance to kinase nhibitors[J]. Clin Cancer Res,2006,12(21):6494-501. |
 2014, Vol.41
2014, Vol.41


