文章信息
- 张用,毕建平,皮国良,曾凡玉,韩光,胡德胜.
- ZHANG Yong, BI Jianping, PI Guoliang, ZENG Fanyu, HAN Guang, HU Desheng.
- 国际肺癌研究协会第八版国际肺癌TNM分期修订稿解读
- An Interpretation of Revised Version of International Association for Study of Lung Cancer for Forthcoming 8th Edition of TNM Classification for Lung Cancer
- 肿瘤防治研究, 2016, 43(04): 313-318
- Cancer Research on Prevention and Treatment, 2016, 43(04): 313-318
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.04.016
-
文章历史
- 收稿日期: 2015-12-31
- 修回日期: 2016-02-18
准确分期是选择治疗方案和判断预后的最重要影响因素。肺癌TNM分期方法自从1974年被美国癌症联合会(American Joint Committee on Cancer,AJCC)和国际抗癌联盟(Union for International Cancer Control,UICC)采用后已经被广泛的应用于临床实践。目前临床上使用的是UICC于2009年颁布的第七版TNM分期。
近10年来,随着肺癌综合治疗的发展,更好的支持治疗的出现以及临床实践模式的改变,肺癌的疗效及其预后也有了明显的改变,旧的分期标准可能难以满足目前的临床需求,因此有必要重新审视原有的分期标准并对其进行部分的修改,以进一步细化分期系统。正是在这样的时代背景下,国际肺癌研究协会(international association for the study of lung cancer,IASLC)开展了最新一轮的肺癌TNM分期标准修订研究计划,完成了对目前全球最大样本量及最全面的肺癌患者研究数据的回顾性分析、统计及验证。根据其研究的相关数据结果而撰写的第八版肺癌TNM分期标准的修订稿已发表在2015年第10卷的《胸部肿瘤杂志(Journal of thoracic oncology,JTO)》杂志上[1, 2, 3]。目前IASLC已经正式向UICC及AJCC提出第八版肺癌TNM分期修改建议,一旦建议获得采纳,最新版的肺癌TNM分期将于2017年正式发布,而目前世界各地临床上所使用的肺癌分期仍然是UICC于2009年颁布的第七版分期。本文现就IASLC近期发布的第八版肺癌TNM分期的修订稿进行初步解读。
1 TNM分期第八版与第七版的研究背景比较第七版TNM分期的研究对象主要来自于1990—2000年这10年间被诊断为肺癌患者的病例为100 869人次[4],该研究数据采至全球20个国家的46个研究中心,经筛选剔除不合格患者后,共有81 495例肺癌患者纳入研究[其中非小细胞肺癌(nonsmall-cell lung cancer,NSCLC)患者68 463名,小细胞肺癌(small-cell lung cancer,SCLC)患者13 032名],病例分布:欧洲占58%,澳洲占9.3%,北美洲占21%,亚洲占11.5%。而第八版分期参考依据的研究对象来源于1999—2010年这11年间16个国家的35个研究中心94 708例新诊断的肺癌患者[其中有4 667例患者的数据是由电子数据采集系统(electronic data capture,EDC)提交的],其病例分布,包括了五大洲:欧洲占49%,亚洲占44%,北美洲占5.0%,澳洲占1.7%,南美洲占0.3%。经过筛选后最终有77 154例肺癌患者被纳入研究(70 967例为NSCLC,6189例为SCLC),见表 1。与第七版分期相比,第八版分期病例采集更为均匀合理,该研究首次纳入了南美洲肺癌数据,同时明显增加了亚洲肺癌患者数据,这与亚洲肺癌高发病率和总人数多的特点相符。由于近10年来NSCLC的发病率有明显逐年上升趋势,因此第八版分期中NSCLC患者病例占据了绝大多数的比例,这更符合当今肺癌的流行病学特征。相较于第七版分期,在第八版分期中约有85%的患者接受了手术切除(包括与放化疗的联合治疗),这也反映了近10年来由于肺癌预防筛查工作的较好开展,更多的早期肺癌患者(特别是在亚洲,如日本)能被及时的发现和治疗。进入21世纪以来对肺癌的诊断和治疗都发生了很大的变化,比如正电子发射计算机断层显像(positron emission tomography/computer tomography,PET-CT)的运用;一些新的全身系统性治疗的药物,如培美曲塞、酪氨酸激酶抑制剂(Tyrosine kinase inhibitor,TKI)、贝伐单抗(Bevacizumab,Avastin)等的运用;以及一些新的放疗技术,如调强放疗(intensity-modulated radiation therapy,IMRT)、立体定向放疗(stereotactic body radiation therapy,SBRT)等运用。最新分期研究观察5年生存率的结果将会更为准确地反映1999—2010年间全球肺癌的诊断和治疗情况。故新的TNM分期将具有更高的权威性和认同度,能更好的指导目前的临床工作。
 |
本版分期中以T分期变化最为明显,(1)T1 增加了T1c,原来T1a分为T1a和T1b,原来T1b变更为新版T1c:即T1a(肿瘤最大直径≤1 cm),T1b(最大直径>1~2 cm),T1c(最大直径>2~3 cm);(2)T2 原来T2a分为T2a和T2b:即T2a (最大直径>3~4 cm),T2b(最大直径>4~5 cm);(3)原来T2b变为T3(最大直径>5~7 cm);(4)>7 cm由原来T3变为T4。此外,侵犯主支气管未及隆突,无论距离隆突多远(原来侵犯主支气管但距离隆突≥2为第7版分期的T2;侵犯主支气管但距离隆突<2为第7版分期的T3)都归为T2,伴部分或全肺不张或伴阻塞性肺炎归为T2,侵犯膈肌(原来的T3)归为T4,在T分期中删除纵隔胸膜浸润这条术语,见表 2。
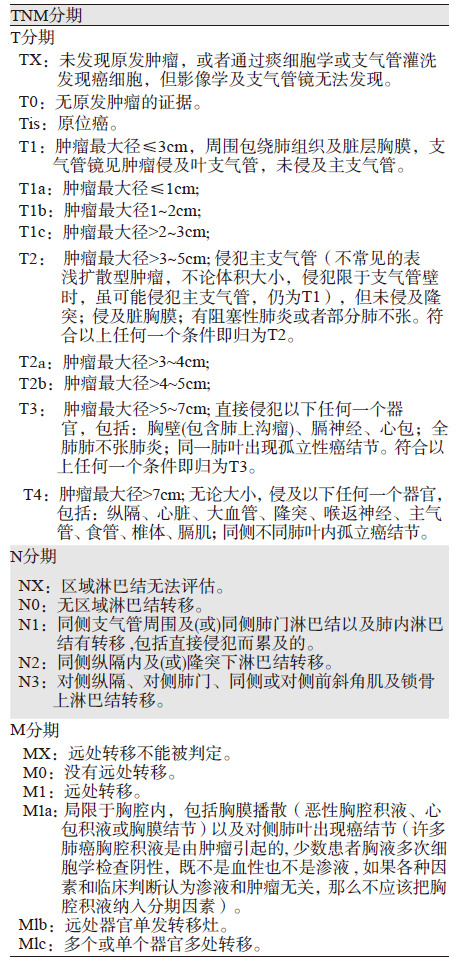 |
继续沿用第七版N分期方法,但对淋巴结病理分期提出要按淋巴结转移的站数(单站与多站),以及存在和不存在跳跃式淋巴结转移来区分。将原来N1分为N1a(单站)和 N1b(多站);N2分为N2a1(无N1转移,直接跳跃到单站的N2淋巴结),N2a2(有N1淋巴结受累,同时发生单站N2淋巴结转移)和N2b(多站N2淋巴结受累);N3未作修改,见表 2。
2.3 M分期M分期增加了M1c。将胸膜或心包积液,对侧或双侧单发或多发肺结节,对侧或双侧胸膜单发或多发结节,心包单发或多发结节均归为M1a(病变局限在胸腔内);胸腔外单个器官发生单发转移灶为M1b;胸腔外多个远处器官或者单个器官出现多发转移灶均归为M1c,见表 2。
3 新版TNM分期修改依据 3.1 关于T分期T分期修改意见都是源于5年生存率和中位生存期来决定。图 1是来自Rami-Porta学者关于T分期的研究结果[1],也是本次新版TNM分期中T分期的主要修改依据。根据NSCLC患者术后或者诊断后的原发灶T大小不同,将其分为≤1 cm、1~2 cm、>2~3、>3~4、>4~5、>5~6、>6~7这7个组别来观察其预后差别,见图 1A、1B。可以发现对于≤5 cm的前5组,每增加1 cm,各组的5年生存率存在明显差异(P<<0.001);而>5~6、>6~7组(即最后两组)生存差异不大,故将其合并分期为T3(肿瘤最大直径>5 cm,而≤7 cm)。而≤3 cm和>3 cm的生存差异很大(P<<0.001),故将T1和T2的分界点设在3 cm。由于T1、T2组每增加1 cm,各组的5年生存率差异显著,故依次将T1分为T1a、T1b、T1c,而T2分为T2a、T2b,每个分期间隔1 cm。同时研究发现肿瘤>7 cm生存率跟原版分期的T4患者生存率类似,故将>7 cm归为T4[5, 6, 7, 8]。
对于肺不张及阻塞性肺炎的研究[9, 10, 11],第七版把支气管内肿瘤导致的局限性肺不张或阻塞性肺炎均归为T2,若导致全肺不张则归为T3,而新版研究发现全肺不张患者的预后要好于与其他T3患者,其生存率与T2患者类似,故在第八版TNM分期中将支气管病变伴部分或全肺不张或伴阻塞性肺炎归为T2。关于脏层胸膜浸润在T分期中的意义[12, 13, 14],各国学者对于脏层胸膜浸润对生存率的影响研究结果不一,故认为目前将脏层胸膜浸润纳入临床分期尚不可靠。而对于纵隔胸膜浸润,研究者们认为需要经过活检及胸腔镜或外科切除才能确认,而这些确认的手段并不是每个患者治疗所必需的。鉴于上述原因,在新版分期中删除了“纵隔胸膜”这一术语。关于膈肌侵犯在T分期中的作用[15, 16, 17, 18],尽管只有低于30%外科手术切除的患者会取膈肌进行病检,但研究发现膈肌浸润患者生存要比其他T3患者差,而类似于T4患者,故在新版分期修订稿中建议将浸润膈肌划归为T4。
3.2 关于N分期关于N分期的研究数据主要来源于日本研究结果[2],由于既往N1、N2及N3分期间生存率相差很大,已经能够很好反映肺癌患者分期与预后之间的关系,所以本次新的分期建议继续沿用原来第七版的N分期,同时推荐使用IASLC的胸部淋巴结分布图来定义纵隔淋巴结分期情况。本次分期研究中发现对于N分期,无论是采用临床分期(cN)或者是病理分期(pN),不同期别的5年生存率统计学差异均非常明显(P<<0.0001),5年生存率依次为N1(cN1: 60%,pN1: 75%),N2(cN2: 23%,pN2: 36%)和N3(cN3: 9%,pN3: 20%)。同时研究发现,对于同一级别的N分期中临床分期与病理分期生存率相差较大,而病理分期往往能够反映最为真实的分期情况,因此本次分期研究首次将术后淋巴结转移个数和转移方式纳入,最终发现淋巴结转移的寡众以及是否发生跳跃转移都是导致患者预后差异的重要因素[19, 20, 21],故最终推荐将原来N1分为N1a(单站)和 N1b(多站);N2分为N2a1(无N1转移,直接跳跃到单站的N2淋巴结),N2a2(有N1淋巴结受累,同时发生单站N2淋巴结转移)和N2b(多站N2淋巴结受累)。同时本次研究也发现对于低级别pN分期患者(如pN0),患者5年生存率存在明显的地域性差异,亚洲患者预后最好5年生存率达79%,而欧洲患者预后最差5年生存率为54%,但这种地域差异性随着pN分期的增加而最终消失。这些地域差异性未在本次N分期中提出。
3.3 关于M分期关于M分期主要针对第七版M1b进行了较大的改动和细化,其研究结果主要来自西德癌症医学中心Eberhardt等的研究[3]。他们研究发现针对324例局限在胸腔多发与单发转移的患者进行分析,最后发现其生存率差异无统计学意义,因此将胸膜或心包积液,对侧或双侧单发或多发肺结节,对侧或双侧胸膜单发或多发结节,心包单发或多发结节均归为M1a(病变局限在胸腔内)。而对225名单一远处器官出现单一转移病灶、229名单一远处器官出现多发转移病灶和247名远处多个器官出现多发转移病灶,这三组患者预后进行比较,发现单个器官单发灶远处转移患者(M1b)中位生存时间是11.4月,而单个远处转移器官多发转移灶或多发远处转移器官多发病灶患者(M1c)中位生存时间是6.3月。他们的研究结果与过去的一些回顾性研究的结果相似[22, 23, 24, 25, 26, 27],显示出转移灶的个数和转移器官数目都与患者预后密切相关。因此新版分期将转移器官数目及转移病灶数目纳入预后因素,将M分期分为M1a、M1b、M1c。
综上所述,修改后的TNM分期标准能更好的显示患者的预后,这将更好地指导肺癌患者对于诊断、治疗方式的选择及其预后的判断。
4 新版TNM分期存在的问题第八版分期肺癌病例的选择尽管较第七版更为均匀合理,但仍然存在一些问题。新版分期研究纳入的肺癌患者数量与上一版相似,虽然在患者分布中增加了亚洲患者的比例,同时也首次将南美洲患者纳入研究,但是非洲、俄罗斯、印度患者仍然缺乏,而且中国肺癌患者的数据主要来自于上海和广东这两个地区,其代表性有限。中国是肺癌大国,患病人数多,发病地域性广,应该加入中西部及东北部等更多地区患者的数据。此外,肺癌分期研究中很多患者数据都是采用的回顾性研究,这些研究设计之初并没有希望将其用于TNM分期研究,其结果的标准及评估要求都不统一,而且还可能存在一些重要数据的缺失,因此对于患者生存率统计及诊断的真实性都会不可避免的存在一定偏差。此外,第八版分期收集的数据与第七版收集的数据在1999年有所重复,因此,也会对研究结果的随机性和客观性产生一定影响。新版研究T分期中已经明确说明,新版TNM分期主要目的是对肺癌患者更加精细的分类,而不希望新版TNM分期的颁布大幅度改变肺癌目前的治疗模式。例如:对于原来>7cm或侵犯膈肌的患者,不希望因为新版分期中将其从第七版的T3归入T4,从而导致能够接受手术治疗的患者最终放弃手术。新版分期收集的患者数据来自1999—2010年,此研究期间,PET-CT已经在肺癌诊断中广泛应用,但是未见PET-CT相关参考值在肺癌分期中的作用,同时免疫治疗相关标志如效应CD8+T细胞,及CD8+T/Foxp3比例在肺癌预后中的研究已经得到较为肯定的结果,但是仍然未纳入新版肺癌分期,同时,肺癌驱动基因(EGFR、ALK和ROS1等)状态,PD-1表达水平等分子生物水平标志均未能在第八版分期中有所体现,这些相关预后因素将可能在未来的TNM分期中有所提示。
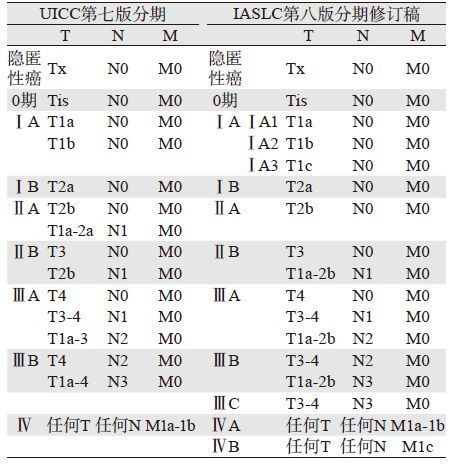
尽管IASLC发布的新版TNM分期修订稿中所采用的相关数据仍存在一定的问题和局限性,但是相对于UICC的第七版肺癌分期还是有了明显改善和提高。虽然,可能会与UICC最终颁布的第八版肺癌TNM分期有所差异,但其必将成为第八版UICC国际肺癌TNM分期标准制订的主要依据,见表 3[28]。
 |
| [1] | Rami-Porta R, Bolejack V, Crowley J, et al. The IASLC Lung Cancer Staging Project: Proposals for the Revisions of the T Descriptors in the Forthcoming Eighth Edition of the TNM Classification for Lung Cancer[J]. J Thorac Oncol, 2015, 10(7): 900-1003. |
| [2] | Asamura H, Chansky K, Crowley J, et al. The International Association for the Study of Lung Cancer Lung Cancer Staging Project: Proposals for the Revision of the N Descriptors in the Forthcoming 8th Edition of the TNM Classification for Lung Cancer[J]. J Thorac Oncol, 2015, 10(12): 1675-84. |
| [3] | Eberhardt WE, MitcheⅡ A, Crowley J, et al. The IASLC Lung Cancer Staging Project: Proposals for the Revision of the M Descriptors in the Forthcoming Eighth Edition of the TNM Classification of Lung Cancer[J]. J Thorac Oncol, 2015, 10(11): 1515-22. |
| [4] | Rami-Porta R, Bolejack V, Giroux DJ, et al. The IASLC lung cancer staging project: the new database to inform the eighth edition of the TNM classification of lung cancer[J]. J Thorac Oncol, 2014, 9(11): 1618-24. |
| [5] | Wittekind C, Compton C, Brierley J, et al. TNM Supplement A Commentary on Uniform Use 4th Ed[M]. Oxford: Wiley- Blackwell, 2012: 6. |
| [6] | Yoshizawa A, Motoi N, Riely GJ, et al. Impact of proposed IASLC/ATS/ERS classification of lung adenocarcinoma: prognostic subgroups andimplications for further revision of staging based on analysis of 514 stage I cases[J]. Mod Pathol, 2011, 24(5): 653-64. |
| [7] | Tsutani Y, Miyata Y, Nakayama H, et al. Prognostic significance of using solid versus whole tumor size on high-resolution computed tomography for predicting pathologic malignant grade of tumors in clinical stage IA lung adenocarcinoma: a multicenter study[J]. J Thorac Cardiovasc Surg, 2012, 143(3): 607-12. |
| [8] | Maeyashiki T, Suzuki K, Hattori A, et al. The size of consolidation on thin-section computed tomographyis a better predictor of survival than the maximum tumourdimension in resectable lung cancer[J]. Eur J Cardiothorac Surg, 2013, 43(5): 915-8. |
| [9] | Edge SB, Byrd DR, Compton CC, et al. Cancer Staging Manual 7th Ed[M]. New York: Springer, 2010: 253-70. |
| [10] | Goldstraw P. Staging manual in thoracic oncology[M]. Orange Park, FL: Editorial Rx Press, 2009: 32-3. |
| [11] | Sobin LH, Gospodarowocz MK, Wittekind C. TNM Classification of Malignant Tumours, 7th Edition[M]. Oxford: Wiley-Blackwell, 2009: 7-9. |
| [12] | Kudo Y, Saji H, Shimada Y, et al. Impact of visceral pleural invasion onthe survival of patients with non-small cell lung cancer[J]. Lung Cancer, 2012, 78(2): 153-60. |
| [13] | Fibla JJ, Cassivi SD, Brunelli A, et al. Re-evaluation of the prognosticvalue of visceral pleura invasion in Stage IB non-small cell lung cancerusing the prospective multicenter ACOSOG Z0030 trial data set[J]. Lung Cancer, 2012, 78(3): 259-62. |
| [14] | Kawase A, Yoshida J, Miyaoka E, et al. Visceral pleural invasion classification in non-small-cell lung cancer in the 7th edition of the tumor, node, metastasis classification for lung cancer: validation analysis based on a large-scale nationwide database[J]. J Thorac Oncol, 2013, 8(5): 606-11. |
| [15] | Padilla J, Calvo V, MorcilloA, et al. Resection of bronchogenic carcinoma invading the diaphragm[J]. Arch Bronconeumol, 1999, 35(6): 297-8. |
| [16] | Rocco G, Rendina EA, Meroni A, et al. Prognostic factors aftersurgical treatment of lung cancer invading the diaphragm[J]. Ann Thorac Surg, 1999, 68(6): 2065-8. |
| [17] | Yokoi K, Tsuchiya R, Mori T, et al. Results of surgical treatmentof lung cancer involving the diaphragm[J]. J Thorac Cardiovasc Surg, 2000, 120(4): 799-805. |
| [18] | Galetta D, Borri A, Casiraghi M, et al. Outcome and prognostic factorsof resected non-small-cell lung cancer invading the diaphragm[J]. Interact Cardiovasc Thorac Surg, 2014, 19(4): 632-6. |
| [19] | Wei S, Asamura H, KawachiR, et al.Which is the better prognostic factor for resected non-small cell lung cancer: the numberof metastatic lymph nodes or the currently used nodal stage classification? [J] J Thorac Oncol, 2011, 6(2): 310-8. |
| [20] | Saji H, Tsuboi M, Shimada Y, et al. A proposal for combination of totalnumber and anatomical location of involved lymph nodes for nodal classificationin non-small cell lung cancer[J]. Chest, 2013, 143(6): 1618-25. |
| [21] | Ramirez RA, Wang CG, Miller LE, et al. Incomplete intrapulmonarylymph node retrieval after routine pathologic examination of resectedlung cancer[J]. J Clin Oncol, 2012, 30(23): 2823-8. |
| [22] | Gray PJ, Mak RH, Yeap BY, et al. Aggressive therapy for patients withnon-small cell lung carcinoma and synchronous brain-only oligometastatic disease is associated with long-term survival[J]. Lung Cancer, 2014, 85(2): 239-44. |
| [23] | T?nnies M, Pfannschmidt J, Bauer TT, et al. Metastasectomy for synchronoussolitary non-small cell lung cancer metastases[J]. Ann Thorac Surg, 2014, 98(1): 249-56. |
| [24] | Congedo MT, Cesario A, Lococo F, et al. Surgery for oligometastaticnonsmallcell lung cancer: long-term results from a single center experience[J]. J Thorac Cardiovasc Surg, 2012, 144(2): 444-52. |
| [25] | Bonnette P, Puyo P, Gabriel C, et al. Groupe Thorax. Surgical managementof non-small cell lung cancer with synchronous brain metastases[J]. Chest, 2001, 119(5): 1469-75. |
| [26] | Tanvetyanon T, Robinson LA, Schell MJ, et al. Outcomes of adrenalectomyfor isolated synchronous versus metachronous adrenal metastasesin non-small-cell lung cancer: a systematic review and pooled analysis[J]. J Clin Oncol, 2008, 26(7): 1142-7. |
| [27] | De Ruysscher D, Wanders R, Van Baardwijk A, et al. Radical treatment of non-small-cell lung cancer patients with synchronous oligometastases: long-term results of a prospective phaseⅡtrial (Nct01282450)[J]. J Thorac Oncol, 2012, 7(10): 1547-55. |
| [28] | Saiama N. The 8th Edition of the TNM Classification for Lung Cancer: A Step in the Right Direction[J]. Oncology Times, 2015, 37(20): 6-8. |
 2016, Vol. 43
2016, Vol. 43



