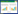文章信息
- 孙建华,姬忠贺,于洋,武海涛,李雁.
- SUN Jianhua, JI Zhonghe, YU Yang, WU Haitao, LI Yan
- 细胞减灭术加腹腔热灌注化疗治疗卵巢癌腹膜转移癌的临床研究
- Clinical Investigation on Cytoreductive Surgery plus Hyperthermic Intraperitoneal Chemotherapy on Patients with Peritoneal Carcinomatosis from Epithelial Ovarian Cancer
- 肿瘤防治研究, 2016, 43(04): 282-286
- Cancer Research on Prevention and Treatment, 2016, 43(04): 282-286
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.201604008
-
文章历史
- 收稿日期: 2015-06-23
- 修回日期: 2015-11-27
2. Department of Gastrointestinal Surgery, The Central Hospital of Enshi Tujia and Miao Autonomous Prefecture, Enshi 445000, China
上皮性卵巢癌(epithelial ovarian cancer,EOC)是最常见的卵巢恶性肿瘤,不易早期诊断,75%的患者就诊时已处于晚期(FIGO Ⅲ~Ⅳ期),肿瘤累及腹膜或发生远处转移,五年生存率不足20%[1]。自上世纪八十年代以来,最大程度的细胞减灭术(cytoreductive surgery,CRS)辅以铂类加紫杉烷类为主的全身化疗就一直是EOC的标准治疗模式[2, 3]。其中,减瘤程度是最重要的预后影响因素,减瘤程度和生存期成正比[4]。然而,尽管如此,仍有60%~70%的患者出现以腹膜转移癌(peritoneal carcinomatosis,PC)为主要形式的复发[5]。PC一旦发生,预后极差。
近三十年来,国际上发展起来了一套PC综合治疗策略,其核心就是积极的CRS加术中腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)[6],通过CRS尽可能切除肉眼可见的病灶,HIPEC清除腹盆腔内微转移癌灶和游离癌细胞。该治疗体系已经成为一些国家治疗结直肠癌腹膜转移癌[7]、腹膜恶性间皮瘤[8]和腹膜假性黏液瘤[9]的标准治疗,但对卵巢癌腹膜癌的治疗还处于临床研究阶段,没有形成共识。本单位自2003年起重点开展PC综合防治新技术研究,证实该策略能明显延长胃癌和结直肠癌PC患者的生存期[10, 11]。与此同时,部分经选择的晚期或复发性EOC患者亦接受了CRS+HIPEC治疗,本文报告46例EOC腹膜转移癌患者的研究结果。
1 资料与方法 1.1 临床资料收集2004年4月—2014年9月于武汉大学中南医院肿瘤科接受CRS+HIPEC治疗的46例EOC PC患者的临床病例资料,其中16例为晚期EOC PC,30例为复发性EOC PC。纳入标准[12]:(1)KPS评分>50分;(2)年龄20~75岁;(3)血常规、肝、肾功能基本正常;(4)心、肺功能正常。排除标准:(1)年龄<20岁或>75岁;(2)术前检查发现肝、肺等远处转移或广泛的腹膜后淋巴结转移;(3)血常规、肝、肾功能明显异常。(4)术前评估不能耐受该手术者。研究方案得到医院伦理委员会批准,患者均签署知情同意书。
1.2 治疗设备HIPEC采用武汉一海数字工程有限公司研制的ES-6001型腹腔热灌注化疗仪,由加热系统、测量系统、灌注系统、报警系统、消毒系统组成,其特点为:(1)加温快,加热30 min即可进行灌注化疗;(2)灌注容量大,为6 000 ml;(3)温控精确,灌注温度可精确控制在(43±0.1)℃;(4)操作简便,可行封闭式和(或)开放式腹腔热灌注化疗;(5)安全性好,整个过程为无菌操作。操作过程:将6 000 ml 0.9%氯化钠溶液注入无菌化疗瓶中,调配好化疗液,置入化疗仪中加热,达预定温度后通过输出泵注入腹腔,实现热灌注化疗。
1.3 治疗方法46例患者均在专门的腹膜癌治疗团队配合下手术(麻醉医师、肿瘤外科医师、手术室护理人员)。患者全麻后摆截石位或“大”字位,取剑突至耻骨联合的长正中切口,开腹后从膈面腹膜到盆腔腹膜探查肿瘤侵袭程度及PC范围,记录腹水量、原发瘤和(或)转移瘤的大小、部位,进行腹膜癌指数(peritoneal cancer index,PCI)评分。凡能完全缩瘤者行根治性切除,不能完全缩瘤者行最大程度CRS,手术结束后行细胞减灭程度评分(completeness of cytoreduction,CC)。CRS完成后即行开放式HIPEC,药物为顺铂(cisplatin,DDP)120 mg,丝裂霉素C(mitomycin,MMC)30 mg,灌注液(0.9%氯化钠溶液)12 000 ml,灌注温度(43±0.5)℃,持续灌注时间60~90 min。HIPEC结束后,必要时行消化道重建或结肠造口,减张缝合切口,送ICU监护24~48 h,病情稳定后转普通病房。
1.4 观察及监测指标主要终点指标为总生存期(overall survival,OS),次要终点指标为围手术期安全性及并发症。OS定义为初次确诊至随访截止或患者死亡的时间,术后并发症是指手术当日至术后30天内与本次治疗有关的并发症。
1.5 评价标准及相关定义 1.5.1PCI按Sugarbaker等[13]的标准评估PCI,进行PC分期。该法用两条纵线(锁骨中线)和两条横线(两侧肋弓下缘的连线和髂前上棘的连线)将腹部分为13个区域:中央区、右上腹、上腹部、左上腹、左腰部、左髂窝、盆底部、右髂窝、右腰部、回肠上段、回肠下段、空肠上段和空肠下段。每个区域的评分标准为:0分:无可见肿瘤;1分:肿瘤直径≤0.5 cm;2分:肿瘤直径0.5~5.0 cm;3分:肿瘤直径>5 cm或融合。上述区域的评分总和即患者的PCI,最高39分(13×3)。
1.5.2 细胞减灭程度(completeness of cytoreduction,CC)按照Sugarbaker等[14]介绍的CC评分法,评分标准为:0分:CRS后无腹膜残余瘤;1分:残余瘤直径<2.5 mm;2分:残余瘤直径2.5 mm~2.5 cm;3分:残余瘤>2.5 cm,或存在无法切除的瘤灶。
1.5.3 铂类敏感型/耐药型EOC对于复发性EOC而言,若患者在完成铂类为主的一线辅助化疗后的6月之内复发,称为铂类耐药型EOC;复发间隔时间≥6月则称为铂类敏感型EOC[15]。
1.6 随访所有患者均行门诊或电话随访,最近一次统一随访时间为2015年2月28日,随访率100%。
1.7 统计学方法所有计数资料以频数表示,分析组距和中位数;计量资料以实测数据表示,分析平均值和标准差(−x±s)。Kaplan-Meier法比较患者的总生存,Log rank检验比较生存曲线,用Cox比例风险模型分析影响生存结果的独立预后因素。用SPSS13.0统计软件进行统计分析,P<0.05为差异有统计学意义。
2 结果 2.1 主要临床病理特征接受CRS+HIPEC治疗的46例EOC PC患者。其主要临床病理指标见表 1。
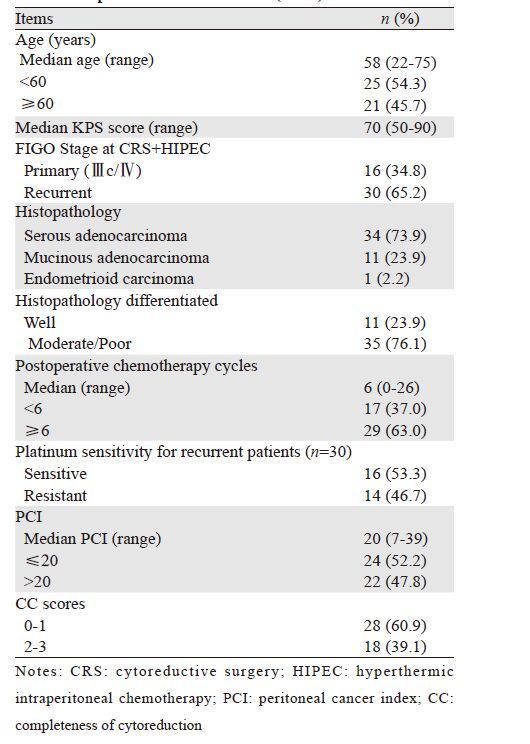
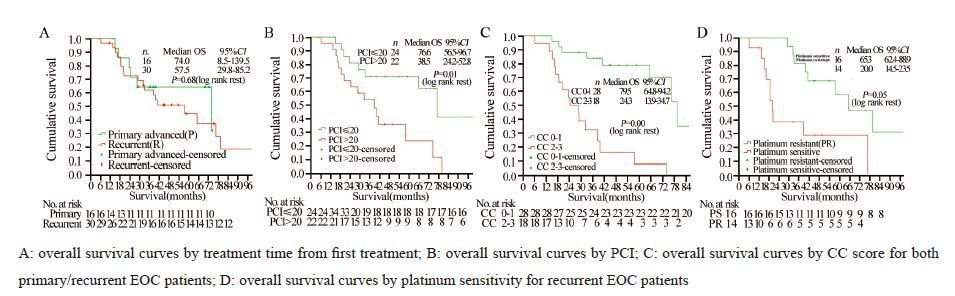
2.2 生存分析患者中位随访时间为45.8月(5.0~213.3),24例患者(52.2%)死亡,22例患者(47.8%)仍然存活,1、2、3、5年生存率分别为97.8%、76.1%、65.2%、56.5%,46例患者的中位OS为57.5月(95%CI: 23.2~91.7),见图 1。亚组分析发现,晚期EOC患者(Ⅲc/Ⅳ期)的中位OS为74.0月(95%CI: 8.5~139.5),而复发性EOC患者的中位OS为57.5月(95%CI: 29.8~85.2)(P=0.68),见图 2A。低PCI(PCI≤20,n=24)患者中位OS为76.6月(95%CI: 56.5~96.7),而高PCI(PCI>20,n=22)患者中位OS为38.5月(95%CI: 24.2~52.8),差异有统计学意义(P=0.01),见图 2B。CC 0-1分患者的中位生存期为79.5月(95%CI: 64.8~94.2),而CC 2-3分患者中位生存期为24.3月(95%CI: 13.9~34.7),差异有统计学意义(P=0.00),见图 2C。对于复发性EOC患者,铂类敏感型患者中位OS为65.3月(95% CI: 42.6~88.9)明显长于铂类耐药型患者的20.0月(95%CI: 14.5~23.5)(P=0.05),见图 2D。

|
| 图 1 46例EOC PC患者总生存曲线 Fig. 1 Kaplan-Meier overall survival curve of 46 EOC PC patients |
|
| 图 2 晚期上皮性卵巢癌患者生存曲线亚组分析 Fig. 2 Subgroup analysis of Kaplan-Meier overall survival curves of advanced epithelial ovarian cancer patients |
八项指标被纳入单因素分析,显示四项指标有利于生存:CC 0~1分(P=0.000),PCI≤20(P=0.014),术后辅助化疗周期≥6周期(P=0.028)和术中腹水量≤1 000 ml(P=0.050),见表 2。将这些影响因素纳入多因素Cox回归分析显示,CC评分和术后化疗周期数是改善生存的独立预后因素。与CC 2~3分和术后化疗<6周期相比,CC 0~1分和术后化疗≥6周期延长生存期的可能性分别提高了7倍,见表 2。
2.4 术后并发症46例EOC PC患者接受CRS+HIPEC治疗后未出现围手术期死亡病例,5例患者发生术后并发症,包括1例小肠瘘,2例低蛋白血症,1例伪膜性肠炎和1例Ⅱ度骨髓抑制,这5例患者均经保守治疗后好转。回归分析发现,术后并发症的发生与主要临床病理参数无明显相关性,如年龄、FIGO分期、组织学类型、分化程度、PCI评分和CC评分等。

近三十年来,CRS+HIPEC治疗EOC PC在欧美国家进行了广泛的研究,国际上开展的多项Ⅱ期临床研究[16, 17, 18]及前瞻性Ⅲ期随机对照临床研究[19]都显示出良好的疗效。一项包含895例晚期或复发性EOC患者的系统综述[20]显示,接受CRS+HIPEC治疗的EOC患者中位OS为22~64月,CC 0-1分切除者的中位OS为29~66月,3年生存率为35%~63%,5年生存率为12%~66%,围手术期死亡率为0~10%,术后并发症的发生率为0~15%。CRS+HIPEC在提高疗效的同时,安全性可以接受[21]。
本研究对我单位采用CRS+HIPEC治疗的EOC PC患者进行了系统分析,表明对经选择的患者,CRS+HIPEC治疗确实能够带来生存获益。患者的1、2、3、5年生存率分别为97.8%、76.1%、65.2%、56.5%,中位OS为57.5月,A、B两组患者的中位OS分别为74.0和57.5月(P=0.68),提示该治疗对晚期或复发性EOC患者都有效。
国际大样本多中心回顾性研究[22, 23]和前瞻性Ⅲ期临床研究[19]均提示,在接受CRS+HIPEC治疗后,对铂类敏感和对铂类耐药的EOC患者总生存差异无统计学意义,CRS+HIPEC治疗能使铂类耐药的卵巢癌获益。但本研究显示,对复发性EOC PC患者,铂类敏感型和耐药型的患者的中位OS分别为65.3和20.0月(P=0.05),差异有统计学意义,提示CRS+HIPEC治疗能改善铂类敏感型的EOC PC患者的总生存。出现这种差异的原因可能为所有的46例患者HIPEC化疗药物都采用统一的顺铂和丝裂霉素,导致HIPEC治疗对铂类耐药的患者的疗效降低。
多因素分析表明,CC 0-1分(风险比=7.246,95%CI: 1.9~27.0,P<0.01)和术后化疗≥6周期(风险比=2.481,95%CI: 1.0~6.2,P=0.05)是改善患者生存的独立预后因素。这与EOC目前标准的治疗方案(彻底的减瘤及术后辅助化疗)是一致的。这就要求在保证手术安全、不增加术后并发症的前提下,尽可能彻底减瘤。同时术后还要继续强化腹腔或静脉化疗以保证疗效。
本研究未出现围手术期死亡病例,5例(10.9%)患者出现了术后并发症,明显低于国际同期研究的不良事件发生率。对这5例并发症进行分析发现:(1)4例患者的PCI指数>22,1例患者PCI为19,均为高PCI患者;(2)这5例患者均为复发性EOC再次手术,可能与术中粘连广泛、肿瘤负荷重、手术难度大有关。因此,术前必须认真选择接受CRS+HIPEC治疗的患者,严格制定纳入标准,同时强化围手术期治疗,最大限度减少术后并发症的发生。
综上所述,CRS+HIPEC治疗EOC PC可延长生存期,其安全性可以接受。今后还需要进行大样本多中心随机对照研究,以获得高级别的循证医学证据。
| [1] | Hennessy BT, Coleman RL, Markman M. Ovarian cancer[J].Lancet, 2009, 374(9698): 1371-82. |
| [2] | McGuire WP, Hoskins WJ, Brady MF, et al. Cyclophosphamide and cisplatin compared with paclitaxel and cisplatin in patients with stage Ⅲ and stage Ⅳ ovarian cancer[J]. N Engl J Med, 1996, 334(1): 1-6. |
| [3] | Ozols RF, Bundy BN, Greer BE, et al. Phase Ⅲ trial of carboplatin and paclitaxel compared with cisplatin and paclitaxel in patients with optimally resected stage Ⅲ ovarian cancer: a Gynecologic Oncology Group study[J]. J Clin Oncol, 2003, 21(17): 3194-200. |
| [4] | Bristow RE, Tomacruz RS, Armstrong DK, et al. Survival effect of maximal cytoreductive surgery for advanced ovarian carcinoma during the platinum era: a meta-analysis[J]. J Clin Oncol, 2002, 20(5): 1248-59. |
| [5] | van Driel WJ, Lok CA, Verwaal V, et al. The role of hyperthermic intraperitoneal intraoperative chemotherapy in ovarian cancer[J]. Curr Treat Options Oncol, 2015, 16(4): 14. |
| [6] | Yonemura Y, Canbay E, Endou Y, et al. Peritoneal cancer treatment[J]. Expert Opin Pharmacother, 2014, 15(5): 623-36. |
| [7] | Maggiori L, Elias D. Curative treatment of colorectal peritoneal carcinomatosis: current status and future trends[J]. Eur J Surg Oncol, 2010, 36(7): 599-603. |
| [8] | Sugarbaker PH. Five reasons why cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy must be regarded as the new standard of care for diffuse malignant peritoneal mesotheliomia[J]. Ann Surg Oncol, 2010, 17(6): 1710-2. |
| [9] | Chua TC, Moran BJ, Sugarbaker PH, et al. Early- and long-term outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy[J]. J Clin Oncol, 2012, 30(20): 2449-56. |
| [10] | Huang CQ, Yang XJ, Yu Y, et al. Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy improves survival for patients with peritoneal carcinomatosis from colorectal cancer: A phase Ⅱ study from a Chinese center[J]. PLoS One, 2014, 9(9): e108509. |
| [11] | Yang XJ, Huang CQ, Suo T, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy improves survival of patients with peritoneal carcinomatosis from gastric cancer: final results of a phase Ⅲ randomized clinical trial[J]. Ann Surg Oncol, 2011, 18(6): 1575-81. |
| [12] | Li Y, Zhou YF, Liang H, et al. Expert consensus on the cytoreductive surgery and hyperthermic intraperitoneal chemotherapy to treat peritoneal carcinomatosis[J]. Zhongguo Zhong Liu Lin Chuang, 2015, 42(4): 198-206. [李雁, 周云峰, 梁寒, 等. 细胞减灭术加腹腔热灌注化疗治疗腹膜表面肿瘤的专家共识[J]. 中国肿瘤临床, 2015, 42(4): 198-206.] |
| [13] | Sugarbaker PH. Successful management of microscopic residual disease in large bowel cancer[J]. Cancer Chemother Pharmacol, 1999, 43 Suppl: S15-25. |
| [14] | Sugarbaker PH. Cytoreductive surgery and peri-operative intraperitoneal chemotherapy as a curative approach to pseudomyxoma peritonei syndrome[J]. Eur J Surg Oncol, 2001, 27(3): 239-43. |
| [15] | Bukowski RM, Ozols RF, Markman M. The management of recurrent ovarian cancer[J]. Semin Oncol, 2007, 34(2 Suppl 2): S1-15. |
| [16] | Roviello F, Pinto E, Corso G, et al. Safety and potential benefit of hyperthermic intraperitoneal chemotherapy (HIPEC) in peritoneal carcinomatosis from primary or recurrent ovarian cancer[J]. J Surg Oncol, 2010, 102(6): 663-70. |
| [17] | Ansaloni L, Agnoletti V, Amadori A, et al. Evaluation of extensive cytoreductive surgery and hyperthermic intraperitoneal chemotherapy (HIPEC) in patients with advanced epithelial ovarian cancer[J]. Int J Gynecol Cancer, 2012, 22(5): 778-85. |
| [18] | Ceelen WP, Van Nieuwenhove Y, Van Belle S, et al. Cytoreduction and hyperthermic intraperitoneal chemoperfusion in women with heavily pretreated recurrent ovarian cancer[J]. Ann Surg Oncol, 2012, 19(7): 2352-9. |
| [19] | Spiliotis J, Halkia E, Lianos E, et al. Cytoreductive surgery and HIPEC in recurrent epithelial ovarian cancer: A prospective randomized phase III study[J]. Ann Surg Oncol, 2015, 22(5): 1570-5. |
| [20] | Chua TC, Robertson G, Liauw W, et al. Intraoperative hyperthermic intraperitoneal chemotherapy after cytoreductive surgery in ovarian cancer peritoneal carcinomatosis: systematic review of current results[J]. J Cancer Res Clin Oncol, 2009, 135(12): 1637-45. |
| [21] | Cascales Campos P, Gil J, Parrilla P. Morbidity and mortality outcomes of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy in patients with primary and recurrent advanced ovarian cancer[J]. Eur J Surg Oncol, 2014, 40(8): 970-5. |
| [22] | Bakrin N, Bereder JM, Decullier E, et al. Peritoneal carcinomatosis treated with cytoreductive surgery and Hyperthermic Intraperitoneal Chemotherapy (HIPEC) for advanced ovarian carcinoma: a French multicentre retrospective cohort study of 566 patients[J]. Eur J Surg Oncol, 2013, 39(12): 1435-43. |
| [23] | Bakrin N, Cotte E, Golfier F, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy (HIPEC) for persistent and recurrent advanced ovarian carcinoma: a multicenter, prospective study of 246 patients[J]. Ann Surg Oncol, 2012, 19(13): 4052-8. |
 2016, Vol. 43
2016, Vol. 43