文章信息
- 徐琦,刘碧霞,顾琳慧,张爽爽,周卫民,吴筱丹,应杰儿,冯建国.
- XU Qi, LIU Bixia, GU Linhui, ZHANG Shuangshuang, ZHOU Weimin, WU Xiaodan, YING Jieer, FENG Jianguo.
- 不同剂量贝伐单抗在荷结肠癌细胞裸鼠中对伊立替康分布的影响
- Effects of Different Doses of Bevacizumab on Irinotecan Distribution in Nude Mice Bearing Human Colon Cancer Cell Xenografts
- 肿瘤防治研究, 2016, 43(04): 263-266
- Cancer Research on Prevention and Treatment, 2016, 43(04): 263-266
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.04.005
-
文章历史
- 收稿日期: 2015-04-07
- 修回日期: 2015-12-02
2. 310022 杭州,浙江省肿瘤医院肿瘤研究所;
3. 310022 杭州,浙江省肿瘤医院杂志社;
4. 310053 杭州,浙江省中医药大学动物实验中心;
5. 310027 杭州,浙江大学药物测试中心
新生血管形成是肿瘤发生、发展和转移的重要基础,抗血管生成治疗是晚期结肠癌患者的重要治疗策略[1]。贝伐单抗是全球首个被批准用于抗肿瘤血管生成的药物,国内外多个Ⅰ~Ⅲ期临床试验显示贝伐单抗安全有效、无剂量限制性毒性,与化疗联合疗效增加而毒性无协同[2, 3, 4]。Hurwitz等的Ⅲ期临床试验显示每两周5 mg/kg贝伐单抗明显增加结直肠癌一线化疗方案IFL的疗效,E3200研究则提示每两周10 mg/kg贝伐单抗明显增加结直肠癌二线化疗方案FOLFOX4的疗效[2, 3]。在这两项研究中我们看到两个剂量水平的贝伐单抗均能明显增加结直肠癌患者化疗的疗效。贝伐单抗的疗效和剂量之间是线性关系还是增加到一定剂量后进入平台期目前并不清楚。
有研究发现由单核细胞分化而来的浸润到肿瘤组织内的肿瘤相关巨噬细胞(TAMs)与肿瘤细胞间有相互调节作用[5]。肿瘤细胞释放的趋化因子,包括VEGF能够趋化单核细胞进入肿瘤组织分化成TAMs,并能调节其活性;而TAMs分泌的趋化因子(MIP)和细胞因子(IL-6、IL-1等)介导肿瘤局部炎性反应,导致肿瘤组织肿胀,组织间隙液体压力增加,使化疗药物不易进入肿瘤组织内发挥其抗肿瘤作用[6, 7]。以往研究显示贝伐单抗能使肿瘤血管正常化,减少组织间隙液体压力,增加进入肿瘤内的化疗药物[8, 9, 10, 11, 12]。本实验利用人结肠癌DLD-1细胞建立皮下移植瘤裸鼠模型,观察不同剂量贝伐单抗对肿瘤生长的抑制作用及对伊立替康分布的影响。
1 材料和方法 1.1 主要试剂和细胞贝伐单抗注射液(瑞士Roche公司),盐酸伊立替康注射液(美国辉瑞公司)。2795型高效液相色谱系统、Quattro Premier串联质谱(MS)检测器(美国Waters公司);Heraus 1.0高速低温离心机、生物安全柜等、D-37520 Biofuge高速离心机(德国Kendro公司);LDZ5-2型离心机(北京医用离心机厂);AT201十万分之一分析天平(瑞士METTLER-TOLEDO公司);RPMI 1640培养液(美国Gibco公司),10%胎牛血清(美国Hyclone公司);人结肠癌DLD-1细胞购于中国医学科学院肿瘤医院肿瘤研究所,用含10%胎牛血清的RPMI 1640培养液,在37℃、5%CO2饱和湿度条件下培养传代。伊立替康对照品(批号:160711012,纯度:>98%)由江苏恒瑞制药公司提供;内标苯磺贝他斯汀对照品(天津田边制药有限公司提供,批号:06-02,纯度:>99.0%)。
1.2 方法 1.2.1 裸鼠荷瘤及实验分组BALB/c-nu/nu裸鼠(浙江中医药大学实验动物中心)24只,3~4周龄,雌12只,雄12只,平均体重16~20 g,饲养于SPF级环境中。取对数生长期的DLD-1细胞,调整细胞悬液浓度为5×107个/毫升,取0.2 ml接种于裸鼠腋下。待肿瘤细胞生长半月左右,瘤体长径至5 mm3大小时进行分组实验。随机分为4组,每组各6只。对照组:0.9%氯化钠溶液分别于第1、5、9天静脉注射,伊立替康66.7 mg/kg于第10天注射;实验1组:2.5 mg/kg贝伐单抗联合伊立替康化疗;实验2组:5 mg/kg贝伐单抗联合伊立替康化疗;实验3组:10 mg/kg贝伐单抗联合伊立替康化疗。实验组贝伐单抗均分别于第1、5、9天注射,伊立替康66.7 mg/kg于第10天注射。最后4组分别于第10天伊立替康给药后半小时处死裸鼠,留取外周血并取皮下肿瘤。
1.2.2 移植瘤大小观察裸鼠处死后测量肿瘤长径和短径,肿瘤体积=长径×短径2/2。
1.2.3 外周血及肿瘤组织内伊立替康浓度测定
摘除眼眶留取裸鼠外周血,置于肝素化抗凝试管中,3 000 r/min,离心5 min,分离血浆,于-70℃冰箱中保存待用。留取皮下肿瘤,用于肿瘤组织内伊立替康浓度检测,于-70℃冰箱中保存待用。LC-MS/MS法测定裸鼠血浆及肿瘤组织中伊立替康浓度。
1.3 统计学方法采用SPSS 13.0软件包进行统计分析,所得成组资料数据用($\overset{-}{\mathop x}\,$±s)表示,两组间比较采用独立样本t检验,检验水准取α=0.05,P<0.05为差异有统计学意义。
2 结果2.1 裸鼠移植瘤大小的比较
治疗结束后,测量瘤体长径和短径,计算肿瘤体积。对照组、实验1组、实验2组和实验3组肿瘤体积分别为:(1.54±0.21)、(1.33±0.46)、(1.21±0.64)和(1.02±0.34)cm3。实验1组、实验2组、实验3组与对照组比较,差异无统计学意义(P=0.953)。实验1组、实验2组、实验3组三组间比较,差异也无统计学意义(P=0.804),见图 1。

|
| 图 1 不同浓度贝伐单抗对移植瘤体积大小的影响 Fig. 1 Effects of different concentrations of bevacizumab on tumor volume of xenografts |
伊立替康给药30 min后在对照组、实验1组、实验2组、实验3组的外周血伊立替康浓度分别为(299.69±83.63)、(432.33±104.76)、(409.69±267.15)、(719.21±253.00)ng/ml。实验1组、实验2组、实验3组的浓度均明显高于对照组,其中实验3组与对照组的差异有统计学意义(P=0.010)。实验1组、实验2组、实验3组三组间的比较,实验3组明显高于实验1组和实验2组,其中实验3组与实验2组间的差异有统计学意义(P=0.045),见图 2。
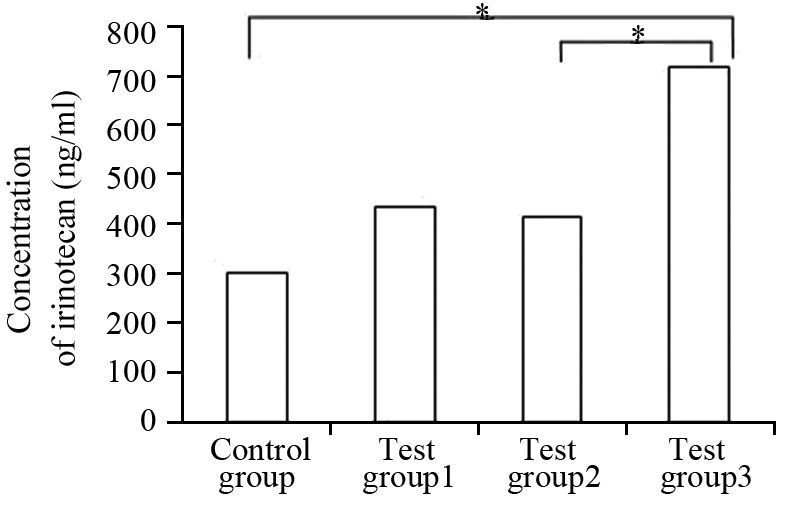
|
| 图 2 不同浓度贝伐单抗对移植瘤外周血伊立替康浓度的 影响 Fig. 2 Ef f e c t s of di f f e rent conc ent rat ions of bevacizumab on irinotecan concentration in peripheral blood of xenografts |
肿瘤组织内伊立替康的浓度在对照组、实验1组、实验2组、实验3组分别为(8.47±2.60)、(5.62±3.12)、(5.73±1.79)和(5.11±3.26)μg/g。实验1组、实验2组、实验3组的浓度均明显低于对照组,其中实验3组与对照组的差异有统计学意义(P=0.047)。实验1组、实验2组、实验3组三组间的比较,差异无统计学意义(P=0.941),见图 3。

|
| 图 3 不同浓度贝伐单抗对移植瘤组织伊立替康浓度的影响 Fig. 3 Effects of different concentrations of bevacizumab on irinotecan concentration in tumor tissues of xenografts |
研究显示贝伐单抗能使肿瘤血管正常化,改变组织间隙液体压力,改善药物转运。Dani等[13]用10 mg/kg的贝伐单抗治疗直肠癌细胞移植瘤,与0.9%氯化钠溶液组相比,贝伐单抗治疗后第5天组织间隙液体压力明显降低,肿瘤细胞对化疗药物的摄取增加。Dickson等[10]研究显示贝伐单抗能增加成神经细胞瘤移植瘤模型中托泊替康和依托泊苷肿瘤内水平。Yanagisawa等[14]报道贝伐单抗能增加乳腺癌裸鼠移植瘤中紫杉醇的浓度,而对外周血及肝脏紫杉醇的浓度无影响。本研究显示肿瘤组织内伊立替康的药物浓度在3个剂量水平的贝伐单抗实验组中均明显低于0.9%氯化钠溶液组,外周血伊立替康药物浓度在3个剂量水平的贝伐单抗实验组均明显高于0.9%氯化钠溶液组。本研究数据与既往文献报道不一致,分析其原因可能与贝伐单抗和伊立替康的给药时间间隔有关。本研究中在贝伐单抗给药3次后(首次给药后10天)给予伊立替康,可能此时肿瘤局部血管已趋于正常,同时新生血管减少,从而导致肿瘤局部药物浓度下降,外周血药物浓度增加。Dickson等[10]研究中超声造影成像显示肿瘤内灌注在贝伐单抗给药初期增加,在1周时反而减少,亦支持本研究的数据。本研究3个剂量水平间的比较显示10 mg/kg组对伊立替康分布的影响最大,尤其是外周血伊立替康浓度,10 mg/kg组与5 mg/kg的差异亦达到统计学意义。该结果显示不同剂量的贝伐单抗对伊立替康的分布影响不同,是否能转换成临床疗效的差异有待于进一步研究。随着贝伐单抗的给药及剂量增加,结肠癌DLD-1细胞移植瘤体积逐渐减小,但差异均无统计学意义,提示单药抗肿瘤作用活性不强,与临床观察到的单药疗效相符[3, 4]。
本研究结果显示贝伐单抗的治疗能改变伊立替康在裸鼠内的分布,不同剂量的贝伐单抗产生的作用不同。随着贝伐单抗药物疗效的出现,肿瘤局部炎性因子、血管状态、肿瘤灌注等改变,药物的分布会发生变化,其确切机制仍需进一步研究探讨。
| [1] | Mihalache A, Rogoveanu I. Angiogenesis factors involved in the pathogenesis of colorectal cancer[J]. Curr Health Sci J, 2014, 40(1): 5-11. |
| [2] | Hurwitz H, Fehrenbacher L, Novotny W, et al. Bevacizumab plus irinotecan, fluorouracil,and leucovorin for metastatic colorectal cancer[J]. N Engl J Med, 2004, 350 (23): 2335-42. |
| [3] | Giantonio BJ, Catalano PJ, Meropol NJ, et al. Bevacizumab in combination with oxaliplatin, fluorouracil, and leucovorin (FOLFOX4) for previously treated metastatic colorectal cancer: results from the Eastern Cooperative Oncology Group Study E3200[J]. J Clin Oncol, 2007, 25(12): 1539-44. |
| [4] | Dotan E, Meropol NJ, Burtness B, et al. A phaseⅡstudy of capecitabine, oxaliplatin, and cetuximab with or without bevacizumab as frontline therapy for metastatic colorectal cancer. A Fox Chase extramural research study[J]. J Gastrointest Cancer, 2012, 43(4): 562-9. |
| [5] | Sica A, Allavena P, Mantovani A. Cancer related inflammation: the macrophage connection[J]. Cancer Lett, 2008, 267(2): 204-15. |
| [6] | Voronov E, Carmi Y, Apte RN. The role of IL-1 in tumor-mediated angiogenesis[J]. Front Physiol, 2014, 5: 114. |
| [7] | Carmi Y, Dotan S, Rider P. The role of IL-1β in the early tumor cell-induced angiogenic response[J]. J Immunol, 2013, 190(7): 3500-9. |
| [8] | Etienne-Grimaldi MC, Formento P, Degeorges A. Prospective analysis of the impact of VEGF-A gene polymorphisms on the pharmacodynamics ofbevacizumab-based therapy in metastatic breast cancer patients[J]. Br J Clin Pharmacol, 2011, 71(6): 921-8. |
| [9] | Navid F, Baker SD, McCarville MB, et al. Phase I and clinical pharmacology study of bevacizumab, sorafenib, and low-dose cyclophosphamide in children and young adults with refractory/recurrent solid tumors[J]. Clin Cancer Res, 2013, 19(1): 236-46. |
| [10] | Dickson PV, Hamner JB, Sims TL, et al. Bevacizumab-induced transient remodeling of the vasculature in neuroblastoma xenografts results in improved delivery and efficacy of systemically administered chemotherapy[J]. Clin Cancer Res, 2007, 13(13): 3942-50. |
| [11] | Leguerney I, Lassau N, Koscielny S, et al. Combining functional imaging and interstitial pressure measurements to evaluate two anti-angiogenic treatments[J]. Invest New Drugs, 2012, 30(1): 144-56. |
| [12] | Turley RS, Fontanella AN, Padussis JC, et al. Bacizumab-induced alterations in vascular permeability and drug delivery: a novel approach to augment regional chemotherapy for in-transit melanoma[J]. Clin Cancer Res, 2012, 18(12): 3328-39. |
| [13] | Dani M, Vojnovic B, Newman R, et al. Bevacizumab, a vascular endothelial growth factor (VEGF) specific antibody reduces interstitial fluid pressure (IFP) in human rectal cancer xenograft (HT29) by day 5: is this evidence for rescheduling its timing relative to chemotherapy[J]. J Clin Oncol, 2007, 25(18 Suppl): 4043. |
| [14] | Yanagisawa M, Yorozu K, Kurasawa M, et al. Bevacizumab improves the delivery and efficacy of paclitaxel[J]. Anticancer Drugs, 2010, 21(7): 687-94. |
 2016, Vol. 43
2016, Vol. 43


