文章信息
- 周林,张伟,李乃义,刘永强,吕春雷.
- ZHOU Lin, ZHANG Wei, LI Naiyi, LIU Yongqiang, LV Chunlei.
- UHRF1在胃癌侵袭和转移中的作用及其机制
- Effect of Ubiquitin-like with PHD and Ring Finger Domain 1 on Invasion and Metastasis of Gastric Cancer and Related Mechanism
- 肿瘤防治研究, 2016, 43(4): 258-262
- Cancer Research on Prevention and Treatment, 2016, 43(4): 258-262
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.04.004
-
文章历史
- 收稿日期: 2015-06-24
- 修回日期: 2015-07-12
2. 271000 泰安,解放军八十八医院医务处
2. Medical Department, The 88th Hospital of PLA, Taian 271000, China
胃癌是我国最常见的恶性肿瘤之一,每年约有40万新发病例,死亡人数高达30多万[1, 2]。转移成为胃癌患者死亡的主要原因,因此研究胃癌转移机制、寻找新的潜在治疗靶点显得尤为重要。UHRF1(ubiquitin-like with PHD and ring finger domain 1)作为一个重要的表观遗传学调节因子,通过趋化DNA甲基转移酶DNMT1到DNA复制的分叉处发挥效应,维持DNA的甲基化[3, 4]。UHRF1在包括乳腺癌[5]、膀胱癌[6, 7]、肝癌[8]在内的诸多肿瘤中表达明显升高,它通过增加肿瘤抑癌基因(如p16INK4A、hMLH1、p21和RB等)甲基化以抑制其表达,最终促进肿瘤的发生发展[9]。然而,尚无研究报道UHRF1在胃癌、尤其是胃癌转移中的功能。本研究首先检测UHRF1在胃癌高低转移细胞系中的表达,然后观察上调或下调UHRF1基因表达对胃癌细胞侵袭和转移的影响,进一步探讨可能的分子机制,最终阐明UHRF1在胃癌转移中的作用及其机制。
1 材料与方法 1.1 主要材料RPMI1640培养液购自美国Gibco公司,胎牛血清购自美国Hyclone公司,脂质体Lipofectamine 2000和RNA裂解液TRIzol购自美国Invitrogen公司;Transwell小室购自美国Chemicon公司;Matrigel胶购自美国BD公司;总蛋白提取试剂盒购自北京普利莱,p16INK4A和RB1抗体购自北京博奥森公司,UHRF1和β-actin抗体购自北京中杉金桥公司;UHRF1质粒、siRNA及病毒由上海吉凯基因公司合成;荧光定量PCR分析仪7500购自美国ABI公司。
1.2 细胞培养转移潜能不同的人胃癌细胞系GC9811与GC9811-P[10]来源于第四军医大学肿瘤生物学国家重点实验室,所有细胞均以含10%胎牛血清的RPMI1640培养液于37℃、5%CO2的培养箱中常规培养。
1.3 实时定量RT-PCR应用TRIzol试剂处理胃癌细胞,提取总mRNA,取5 μg RNA,采用随机引物法按试剂盒说明书合成cDNA,以GAPDH基因作为内参。UHRF1引物序列:5’-GTCGAATCATCTTCGTGGAC-3’(F),5’-AGTACCACCTCGCTGGCAT-3’(R);GAPDH 引物序列:5’-GGTGAAGGTCGGA-GTCAAC-3’(F),5’-AGAGTTAAAAGC-AGCCCTGGTG-3’(R)。PCR扩增条件:95℃预变性10 min;95℃变性20 s,60℃退火25 s,72℃延伸25 s,共35个循环;72℃延伸10 min;反应体系为50 μl。相对定量结果以2-ΔΔCT表示,每次实验设置3个复孔,重复3次。
1.4 蛋白质印迹法检测裂解细胞后提取总蛋白,配制12%分离胶及5%积层胶,上样,在恒定电流20 mA下进行SDS-PAGE电泳50 min,半干法转膜17 min(电压恒定20 V),5%脱脂奶粉于室温封闭20 min,2%脱脂奶粉稀释一抗(鼠抗人UHRF1单克隆抗体:体积比1:400;鼠抗人β-actin单克隆抗体:体积比1:2 000;兔抗人p16INK4A多克隆抗体:体积比1:150;鼠抗人RB1单克隆抗体:体积比1:800),4℃冰箱内孵育过夜。TBST洗涤,2%脱脂奶粉稀释HRP标记的二抗(羊抗鼠或羊抗兔,1:2 000),于室温孵育1~1.5 h,TBST洗涤,ECL显色,凝胶成像仪拍照(Bio-Rad),QuantityOne软件进行定量分析。
1.5 质粒构建和转染利用PCR扩增获得目的基因UHRF1,将其导入带有HA-tag标签的表达载体pcDNA3.1,测序验证后获得UHRF1过表达质粒。应用脂质体2000 将过表达质粒转入胃癌细胞株GC9811中,通过Western blot进行验证。
1.6 病毒感染及细胞筛选利用GV209载体构建UHRF1干扰的慢病毒载体,滴度测定为1×109 TU/ml,将GC9811-P细胞铺于96孔板,待细胞生长至50%时按病毒滴度10、50、100、200分别进行病毒感染,12 h后更换培养液,3天后荧光显微镜下通过绿色荧光观察病毒感染情况。收集病毒滴度100、200组的细胞进行扩大培养,流式细胞仪分选带有绿色荧光的细胞,进行后续在体实验。
1.7 体外细胞迁移和侵袭实验收集胃癌细胞,将其用无血清RMPI 1640培养液稀释成1×105个每毫升细胞悬液,Transwell上室内加入200 μl细胞悬液,并将600 μl含胎牛血清的RMPI1640培养液加入Transwell下室,然后在培养箱内培养4 h后用0.1%的结晶紫染色孵育30 min,PBS清洗后显微镜下计数。各组低倍镜下随机选取5个视野计数,比较细胞数目的差异。侵袭检测时Transwell上室中铺被Matrigel胶,而迁移检测时Transwell上室中不铺被Matrigel胶。
1.8 裸鼠体内转移实验20只BALB/C裸小鼠购于北京维通利华实验动物技术有限公司,4~6周龄,均为雌性。寄养在动物中心,选择恒温25℃~28℃、恒湿45%~50%的半屏障系统环境下饲养。裸鼠摄入的饲料和水均需灭菌处理。取对数生长期细胞,消化计数并调整细胞浓度至1.5×107个每毫升,用注射器抽取肿瘤细胞悬液注射裸鼠尾静脉下,每只注射0.2 ml(含活细胞数3×l06个),每个细胞亚系接种10只,自接种日起定期观察裸鼠精神、饮食及体重变化情况。6周后处死裸鼠,观察体内淋巴结及内脏有无肿瘤转移(转移灶为白色小结节)。肺组织经10%福尔马林固定、脱水、常规石蜡包埋,制备4 μm连续切片,HE染色,光学显微镜下观察转移灶。
1.9 甲基化特异性PCR(methylation specific PCR, MSP)采用酚-氯仿抽提法提取胃癌细胞系中的DNA;取20 μl DNA水溶液,加入5.5 μl NaOH(浓度为3 mol/L),对DNA进行甲基化修饰,37℃孵育,依次加入氢醌及NaHSO3,覆盖石蜡油,56℃避光孵育过夜;经向导脱氧核糖核酸纯化系统(Wizard DNA Purification System)试剂盒(美国PROMEGA公司)纯化后,溶入20 μl三蒸水中;在PTC200-PCR仪(美国Bio-Rad公司)上进行扩增,p16INK4A基因的甲基化引物(F:5'-TTATTA GAGGGTGGGGCGGATCGC-3';R:5'-GACCCCGAACCGCGACCGTAA-3')和非甲基化引物(F:5'-TTATTAGAGGGTGGGGTGGAGTGT-3';R:5'-CAACCCCAAACCACAACACTAA-3')、RB1基因的甲基化引物(F:5'-GGGAGTTTCGCGGACGTGAC-3’;R:5’- ACGTCGAAACACGCCCCG-3’) 和非甲基化引物(F:5'-GGGAGTTTTGTGGATGTGAT-3';R:5'-ACATCAAAACACACCCCA-3’) 由上海生工生物工程技术服务有限公司合成。反应体系均为50 μl,扩增条件: 95 ℃预变性15 min,95 ℃变性55 s,63℃(甲基化引物)/62℃(非甲基化引物)退火45 s,72℃延伸1 min,40个循环,72℃延伸10 min;对扩增产物行2%琼脂糖凝胶电泳,然后在VILBER CV-A50C凝胶成像仪下观察,分别获得甲基化和未甲基化条带。
1.10 统计学方法采用SPSS19.0统计学软件进行数据分析,数据以平均数±标准差(x±s)的形式表示,两样本均数比较采用双侧t检验,多样本均数比较采用方差分析,α=0.05,P<0.05为差异有统计学意义。
2 结果 2.1 UHRF1在胃癌细胞系中的表达RT-PCR检测结果表明,UHRF1 mRNA在高转移的GC9811-P细胞系中的表达高于低转移细胞系GC9811,差异有统计学意义(P=0.0037),见图1A。Western blot进一步检测证实UHRF1在蛋白水平上的表达情况与RT-PCR的结果一致,见图1B。

|
| A: the expression level of UHRF1 mRNA in gastric cancer cell lines was measured using RT-PCR. GAPDH was used as an internal control; **: P<0.01; B: the expression of UHRF1 in two pairs of gastric cancer cell lines was examined through Western blot. β-actin was used as an internal control 图 1 UHRF1在胃癌细胞系中的表达情况 Figure 1 Expression of UHRF1 in gastric cancer cell lines |
为探讨UHRF1在胃癌转移中的作用,一方面将包有UHRF1 siRNA的慢病毒载体(UHRF1-siRNA)和相应的对照载体(NC)感染GC9811-P细胞;另一方面将UHRF1的正义载体(UHRF1)和相应的阴性对照(vector)转入GC9811细胞。Western blot检测结果发现:与感染NC的GC9811-P细胞相比,UHRF1-siRNA感染可显著降低UHRF1在 GC9811-P细胞的表达;UHRF1正义载体显著增加了GC9811细胞中UHRF1的表达,见图2。
|
| A: Western blot analysis of UHRF1 expression in GC9811-P cells infected with UHRF1 siRNA or negative control (NC); B: Western blot analysis of UHRF1 in GC9811 cells transfected with UHRF1 plasmid or vector control 图 2 Western blot检测UHRF1 siRNA和UHRF1正义载体转染的效果 Figure 2 Transfection effect of UHRF1 siRNA and plasmid detected by Western blot |
Transwell实验检测UHRF1基因的表达改变对其迁移和侵袭能力的影响,结果表明在GC9811-P细胞中用UHRF1-siRNA下调UHRF1的表达,其体外迁移和侵袭能力明显降低,见图3A,而在GC9811细胞中用UHRF1正义载体上调UHRF1的表达,其迁移和侵袭能力明显增加,见图3B,表明UHRF1可以促进胃癌的体外侵袭和转移。

|
|
A: Transwell migration and invasion assays of the metastasis ability of GC9811-P cells after UHRF1 expression was down-regulated; **: P<0.01; B: Transwell migration and invasion assays of the metastasis ability of GC9811 cells after UHRF1 expression was up-regulated 图 3 上调UHRF1的表达促进胃癌细胞的体外侵袭和转移 Figure 3 Overexpression of UHRF1 promoted invasion and migration of gastric cancer cells in vitro |
将稳定转染的NC-GC9811-P和UHRF1-siRNA-GC9811-P细胞分别从尾静脉注射进入裸鼠体内,4周后观察其肺转移情况发现:注入UHRF1下调的GC9811-P细胞发生肺转移的裸鼠数量明显减少,差异有统计学意义(P=0.007),见图4;提示UHRF1在胃癌体内转移中发挥重要作用。

|
| Representative HE staining of lung tissues isolated from the mice injected with GC9811-P-NC or GC9811-P-UHRF1 siRNA cells. The incidence of metastasis in the mice was 2 of 10 after UHRF1 downregulation, while it was 8 of 10 in the control group. The difference was statistically significant (P=0.007) 图 4 UHRF1对胃癌细胞体内转移的促进作用 Figure 4 Enhancing effect of UHRF1 on metastasis of gastric cancer cells in vivo |
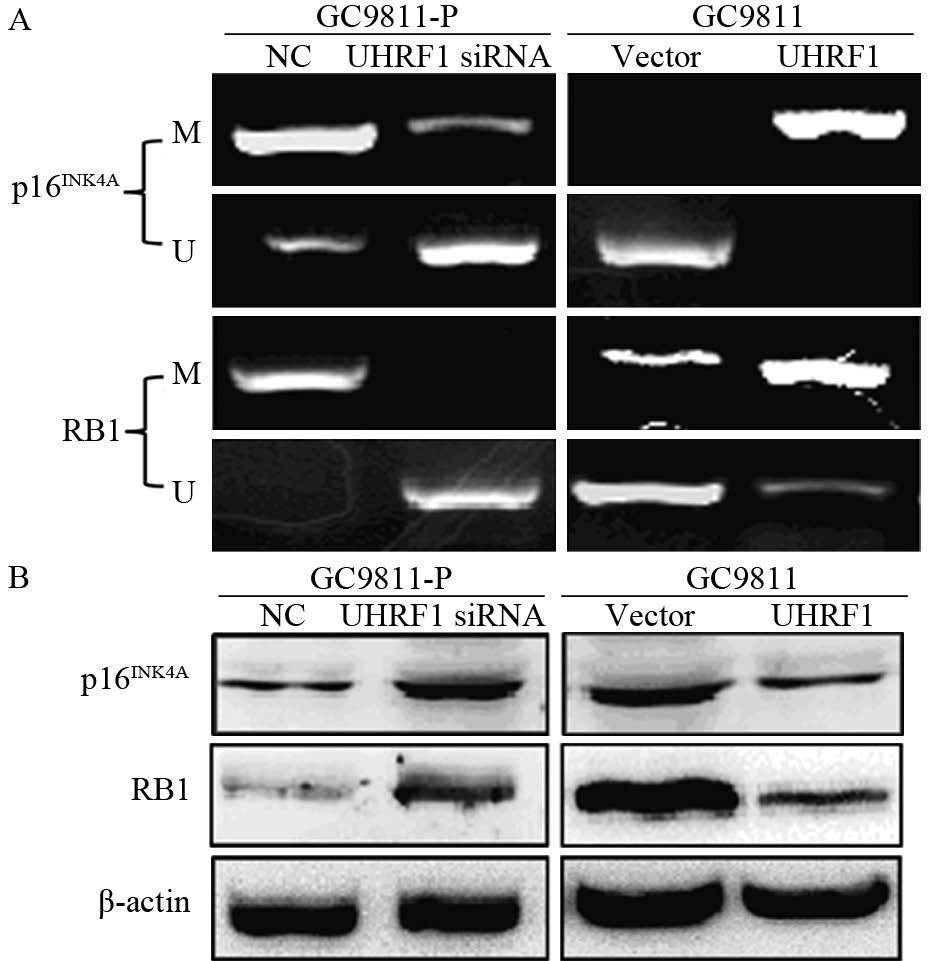
众多研究表明UHRF1通过增加肿瘤抑癌基因的甲基化以抑制其表达,最终促进肿瘤的发生发展,而p16INK4A和RB1作为UHRF1调控的靶基因参与多种肿瘤的增殖和转移。因此,本研究提出p16INK4A和RB1基因可能参与UHRF1调控胃癌侵袭和转移的过程。为了验证这一机制,我们利用MSP和Western blot检测p16INK4A和RB1的甲基化状态和蛋白表达的变化。结果提示,GC9811-P细胞中UHRF1下调后,p16INK4A和RB1的甲基化减弱,其蛋白表达相应上调;而GC9811细胞中UHRF1上调后,p16INK4A和RB1的甲基化增强,其蛋白表达相应下调,见图5,表明UHRF1可能通过增加p16INK4A和RB1甲基化来促进胃癌的侵袭和转移。

|
| A: Promoter methylation status of p16INK4A and RB1 genes analysed using methylation-specific PCR after UHRF1 expression was downregulated or upregulated. M: PCR products with methylation-specific primers; U: PCR products with unmethylation-specific primers; B: Western blot analysis of p16INK4A and RB1 expression after UHRF1 expression was downregulated or upregulated in gastric cancer 图 5 UHRF1对p16INK4A和RB1的甲基化的促进及对蛋白表达的抑制作用 Figure 5 UHRF1 promoted methylation and inhibited protein expression of p16INK4A and RB1 genes |
肿瘤转移是一个复杂的生物学过程[11]。黏附分子、蛋白溶酶、细胞因子和生长因子以及相关信号通路均参与了肿瘤转移的各个环节,其机制极其复杂[12]。目前人们对肿瘤转移的认识仍非常有限,现已经发现的转移相关分子还不足以解释转移的各个层面,肿瘤转移的分子机制仍不清楚。表观遗传学为胃癌转移的研究提供了一条全新的思路,也为阻止和治疗胃癌转移提供了另一套方案。
UHRF1作为一个重要的表观遗传学调节因子,受到了越来越多的关注。研究表明,UHRF1在结肠癌、乳腺癌、肝癌等肿瘤中表达上调,它通过增强多种肿瘤抑癌基因的甲基化而降低其表达,最终促进肿瘤的发生发展。Sabatino等[13]报道UHRF1通过调控PPARG的表观沉默来介导结肠癌的进展。Babbio等[14]也发现UHRF1与Suv39H1、DNA甲基化转移酶相互作用,从而沉默相关抑癌基因,最终促进前列腺癌的发生发展。本研究发现UHRF1在高转移潜能的胃癌细胞系中表达高于低转移潜能的细胞;在GC9811-P细胞中下调UHRF1的表达,其体外迁移和侵袭能力明显降低,而在GC9811细胞中上调UHRF1的表达,其迁移和侵袭能力明显增强;体内实验也发现下调UHRF1的表达会减少转移的发生。这些结果均表明UHRF1在胃癌的侵袭转移中扮演促癌基因的角色,促进胃癌的侵袭和转移。
p16INK4A和RB1是研究最多的UHRF1下游基因[14, 15, 16, 17]。Unoki等[18]报道,UHRF1蛋白可通过SRA位点,结合于不同肿瘤抑制基因的甲基化启动子区域,包括p16INK4A,与DNMT1一起参与维持肿瘤抑制基因的甲基化。2012年的一项研究[16]发现,UHRF1与p16INK4A的表达在结肠癌组织和细胞系中呈负相关,并且UHRF1下调p16INK4A的表达来促进结肠癌的增殖和转移。Achour等[19]发现,UHRF1与DNMT1共同存在于分子复合物中,UHRF1与DNMT1通过下调p16INK4A和RB1基因的表达来调控血管表皮生长因子(vascular endothelial growth factor, VEGF)基因,在肿瘤血管生成和肿瘤抑制基因沉默中起重要作用。另外,pRB由RB1编码,其基因启动子区域含有多个UHRF1蛋白可以结合的位点,UHRF1蛋白的初级序列含有2个RB蛋白的结合位点。Jeanblanc等[20]将RB蛋白和UHRF1蛋白免疫共沉淀于增殖期人肺纤维母细胞和增殖(或融合)的Jurkat细胞的萃取物中,发现UHRF1与甲基化的RB1结合,UHRF1高表达导致肺纤维母细胞RB的mRNA和蛋白表达水平下调。本研究通过MSP和Western blot实验证实,UHRF1增强p16INK4A和RB1基因甲基化而抑制其表达,最终促进胃癌细胞的侵袭和转移。
综上所述,表观遗传学调节因子UHRF1促进胃癌的侵袭和转移,这一作用的发挥可能部分通过下调p16INK4A的表达来实现。进一步研究UHRF1在肿瘤转移过程中发挥的具体作用和信号转导机制将有助于深入了解肿瘤转移的分子机制,也为肿瘤治疗提供新的理论依据和选择方向。
| [1] | Chen W, Zheng R, Zhang S, et al. The incidences and mortalities of major cancers in China, 2009[J]. Chin J Cancer, 2013, 32(3): 106-12. |
| [2] | Hohenberger P, Gretschel S. Gastric cancer[J]. Lancet, 2003, 362(9380): 305-15. |
| [3] | Nishiyama A, Yamaguchi L, Sharif J, et al. Uhrf1-dependent H3K23 ubiquitylation couples maintenance DNA methylation and replication[J]. Nature, 2013, 502(7470): 249-53. |
| [4] | Sharif J, Muto M, Takebayashi S, et al. The SRA protein Np95 mediates epigenetic inheritance by recruiting Dnmt1 to methylated DNA[J]. Nature, 2007, 450(7171): 908-12. |
| [5] | Geng Y, Gao Y, Ju H, et al. Diagnostic and prognostic value of plasma and tissue ubiquitin-like, containing PHD and RING finger domains 1 in breast cancer patients[J]. Cancer Science, 2013, 104(2): 194-9. |
| [6] | Ying L, Lin J, Qiu F, et al. Epigenetic repression of RGS2 by UHRF1 promotes bladder cancer progression[J]. FEBS J, 2014, 282(1): 174-82. |
| [7] | Zhang Y, Huang Z, Zhu Z, et al. Upregulated UHRF1 promotes bladder cancer cell invasion by epigenetic silencing of KiSS1[J]. PLoS One, 2014, 9(10): e104252. |
| [8] | Mudbhary R, Hoshida Y, Chernyavskaya Y, et al. UHRF1 overexpression drives DNA hypomethylation and hepatocellular carcinoma[J]. Cancer Cell, 2014, 25(2): 196-209. |
| [9] | Bronner C, Krifa M, Mousli M. Increasing role of UHRF1 in the reading and inheritance of the epigenetic code as well as in tumorogenesis[J]. Biochem Pharmacol, 2013, 86(12): 1643-9. |
| [10] | Bai F, Guo X, Yang L, et al. Establishment and characterization of a high metastatic potential in the peritoneum for human gastric cancer by orthotopic tumor cell implantation[J]. Dig Dis Sci, 2007, 52(6): 1571-8. |
| [11] | Nguyen DX, Bos PD, Massague J. Metastasis: from dissemination to organ-specific colonization[J]. Nat Rev Cancer, 2009, 9(4): 274-84. |
| [12] | Nguyen DX, Massague J. Genetic determinants of cancer metastasis[J]. Nat Rev Genet, 2007, 8(5): 341-52. |
| [13] | Sabatino L, Fucci A, Pancione M, et al. UHRF1 coordinates peroxisome proliferator activated receptor gamma (PPARG) epigenetic silencing and mediates colorectal cancer progression[J]. Oncogene, 2012, 31(49): 5061-72. |
| [14] | Babbio F, Pistore C, Curti L, et al. The SRA protein UHRF1 promotes epigenetic crosstalks and is involved in prostate cancer progression[J]. Oncogene, 2012, 31(46): 4878-87. |
| [15] | Krifa M, Alhosin M, Muller CD, et al. Limoniastrum guyonianum aqueous gall extract induces apoptosis in human cervical cancer cells involving p16 INK4A re-expression related to UHRF1 and DNMT1 down-regulation[J]. J Exp Clin Cancer Res, 2013, 32:30. |
| [16] | Wang F, Yang YZ, Shi CZ, et al. UHRF1 promotes cell growth and metastasis through repression of p16(ink(4)a) in colorectal cancer[J]. Ann Surg Oncol, 2012, 19(8): 2753-62. |
| [17] | Krifa M, Leloup L, Ghedira K, et al. Luteolin Induces Apoptosis in BE Colorectal Cancer Cells by Downregulating Calpain, UHRF1, and DNMT1 Expressions[J]. Nutr Cancer, 2014, 66(7): 1220-7. |
| [18] | Unoki M, Daigo Y, Koinuma J, et al. UHRF1 is a novel diagnostic marker of lung cancer[J]. Br J Cancer, 2010, 103(2): 217-22. |
| [19] | Achour M, Jacq X, Ronde P, et al. The interaction of the SRA domain of ICBP90 with a novel domain of DNMT1 is involved in the regulation of VEGF gene expression[J]. Oncogene, 2008, 27(15): 2187-97. |
| [20] | Jeanblanc M, Mousli M, Hopfner R, et al. The retinoblastoma gene and its product are targeted by ICBP90: a key mechanism in the G1/S transition during the cell cycle[J]. Oncogene, 2005, 24(49): 7337-45. |
 2016, Vol. 43
2016, Vol. 43