文章信息
- 任妮丽,陈萍.
- REN Nili, CHEN Ping.
- 白介素6在雌激素促进小鼠肺腺癌进展中的作用及其机制
- Role of IL-6 in Progress of Estrogen Promoting Lung Adenocarcinoma in Mice and Its Mechanism
- 肿瘤防治研究, 2016, 43(4): 253-257
- Cancer Research on Prevention and Treatment, 2016, 43(4): 253-257
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.04.003
-
文章历史
- 收稿日期: 2015-04-23
- 修回日期: 2015-07-20
2. 442000 十堰,湖北医药学院附属人民医院肿瘤中心
2. Department of Cancer Center, Affiliated People’s Hospital, Hubei University of Medicine, Shiyan 442000, China
肺癌是全世界范围内发病率和死亡率最高的肿瘤之一,尽管肺癌的诊疗在不断进步,但是总的5年存活率仍然只有16%[1]。吸烟是肺癌的主要风险因素,但是越来越多的证据表明雌激素(estrogen, E2)在肺癌的发病和预后中具有重要作用[2, 3]。转基因小鼠表达E2驱动的荧光素酶报告基因显示E2活性在肺部增加,这表明肺也是E2作用的器官[4]。目前大部分学者认为[2]肺癌组织中主要表达E2受体ERβ,而不是ERα;在E2信号通路中,E2受体β导致环磷酸腺苷活化,激活Akt和MAPK等共同信号通路,最终促进肿瘤的进展。肺癌的肿瘤免疫仍然是目前学者研究的重点方向,有证据表明白介素6(interleukin 6, IL-6)在血清中的水平可能是肺癌的良好标志物及肺癌治疗效果的参考指标[5]。更加值得关注的是,近年来的研究表明,IL-6、ERβ、肿瘤坏死因子受体等均在肺癌患者血清中高表达,且可能作为肺癌潜在的诊断性生物分子标志物[6]。进一步的研究显示E2可以通过减少IL-6的表达而抑制肝癌的转移,在乳腺癌等其他肿瘤中也发现E2与IL-6具有密切的相互作用[7],但是在肺癌中IL-6与E2之间是否具有相互作用目前尚无报道。本文主要探讨IL-6在E2促进小鼠肺腺癌进展中的作用及其可能的机制,为肺癌的多靶点联合治疗提供理论依据。
1 材料与方法 1.1 材料 1.1.1 实验动物4周龄体质量18~21 g的雌性SPF级昆明小鼠购自湖北省实验动物研究中心,饲养于屏障环境系统,适应环境一周后用于实验。
1.1.2 主要试剂雌激素(E2)(购于美国Sigma公司,纯度≥98%)、雌激素抑制剂(Estrogen inhibitor, E2I)(购于美国Sigma公司),IL-6购自于Keygen(USA,货号:KG22468),乌拉坦小鼠肺腺癌诱导剂购自上海展云化工有限公司,用于检测小鼠血清中E2的ELISA试剂盒购自上海古朵生物科技有限公司(货号:GD-XS3297),检测小鼠血清中IL-6的ELISA试剂盒购自ExCell(货号:EM004),抗体AKt(Cell Signaling Technology, 9272S)、MAPK(ProSci, 50-207)、p-AKt(Bioworld, AP0056)、p-MAPK(Beyotime,AM065)、p-ERβ(CC1019, Cell Applications)、ERβ(武汉三鹰生物技术有限公司,货号:14007-1-AP)。
1.2 方法 1.2.1 小鼠饲养及肺腺癌模型的建立小鼠适应环境一周后做卵巢切除手术以屏蔽内源性E2的影响,青霉素腹腔注射0.16万单位/克。将乌拉坦溶于0.9%氯化钠溶液,乌拉坦浓度50 mg/ml,每次每只0.8 ml,腹腔注射,1次/2天,共3次,用于小鼠肺腺癌模型的建立[7]。小鼠生理特征稳定后开始进入实验分组处理。
1.2.2 小鼠分组处理随机分为6组(每组9只,分别标记为1~9):空白对照组、E2组、E2+E2I组、E2I组、IL-6组、E2+IL-6组。E2与E2I均溶于橄榄油(意大利),浓度分别为0.036 mg/ml、0.800 mg/ml,IL-6溶于0.9%氯化钠溶液。在6组中,需要用到的E2、E2I和IL-6按照如上浓度溶解后在小鼠皮下注射,使用剂量分别为每次每只0.05 ml、0.06 ml、0.11 ml[8],所有试剂2次/周,每周测量体重一次,ELISA检测空白对照组E2和IL-6水平。14周后颈部脱臼处死小鼠,切除小鼠肺组织,称肺湿重,分离肺结节,双盲法诊断肺结节病理切片,挑选出肺腺癌,分析肿瘤指数[9]、脏器指数统计[9]等。
1.2.3 Western检测各组ERβ、AKt、MAPK、p-ERβ、p-AKt、p-MAPK的表达取适量上述实验步骤中小鼠肺腺癌RIPA裂解液匀浆组织,测蛋白浓度后,各组样品取50 μg总蛋白上样电泳,转膜,免疫印迹检测,相应的一抗有:ERβ(武汉三鹰生物技术有限公司,14007-1-AP),1:400;Akt(Cell Signaling Technology, 9272S),1:800;MAPK(ProSci, 50-207),1:800;p-ERβ(CC1019, Cell Applications),1:600;p-Akt(Bioworld, AP0056),1:1000;p-MAPK(Beyotime, AM065),1:800。
1.2.4 ELISA法检测小鼠血清中E2/IL-6的表达ELISA试剂盒购自ExCell公司(货号:EM004),于室温(20℃~25℃)放置15~30 min。空白微孔中加入50 μl的样品,空白对照加入50 μl的蒸馏水;在样品孔中加入10 μl的生物素;在样品孔中加入酶标记溶液;将酶标板用封口胶密封后,37℃孵育反应1 h;充分清洗酶标板3~5次,拍干,加入显色剂A、B液各50 μl, 20℃~25℃下避光反应15 min,各孔加入50 μl终止液,终止反应。
1.2.5 RT-PCR法检测ERβ mRNA的表达采用实时荧光定量PCR检测ERβ mRNA的表达,引物合成由金斯瑞合成如下。剪绿豆大小上述实验步骤中肺腺癌组织,加入1 ml TRIzol(Invitrogen, 15596-018),匀浆器匀浆。加入200 μl氯仿,混匀,室温放置5 min,12 000 r/min 15 min 4℃。转上层水相(约400 μl)于新1.5 ml EP管中,加入400 μl异丙醇,混匀,室温静置10 min,12 000 r/min 10 min 4℃。弃上清液,沉淀用预冷的70%无水乙醇洗3次,空气干燥5~10 min,溶于20 μl DEPC水中。分光光度计(上海舜宇恒科学仪器有限公司,752)测定RNA浓度。将所得到的cDNA做10倍稀释,取4 μl进行反转录,Green/Fluorescein qPCR Master Mix(2X) 10 μl, H2O 5.2 μl;DL2000(TAKARA, D501A):2 000、1 000、750、500、250、100 bp;循环条件:95℃ 30 s, 60℃ 30 s,共40个循环。小鼠肺腺癌组织中ERβ引物序列为:上游:5’-CTGCAATTCCTGAACCGAAA-3’,下游:5’-GTGGTAATTTGGGGGCTCTT-3’,216 bp。 β-actin引物序列为:上游:5’-CACGATGGAGGGGCCGGACTCATC-3’,下游:5’-TAAAGACCTCTATGCCAACACAGT-3’,164 bp。
1.3 统计学方法采用SPSS19.0统计软件进行数据分析。使用卡方检验分析IL-6在小鼠肺腺癌中表达的差异。小鼠肺腺癌组织中E2与IL-6表达之间进行相关性分析。P<0.05为差异有统计学意义。
2 结果 2.1 小鼠肺部肿瘤结节总数、肿瘤分级、肺脏器指数对比小鼠去卵巢经乌拉坦诱导小鼠肺腺癌,16周后,肺部肿瘤明显突出肺叶表面,见图1A,成瘤率(肺部出现结节的昆明小鼠占小鼠总数的比例)为87.04%(47/54);组织切片做HE染色经病理诊断为肺腺癌(Jackson分级,≥2为肺癌[9])见图1B,成癌率(小鼠肺部结节做病理切片后证实为肺腺癌的小鼠数目占小鼠总数的比例)为70.37%(38/54)。小鼠肺部肿瘤结节总数变化显示,E2组肺部肿瘤结节总数大于E2+E2I组、E2+IL-6组、IL-6组、E2I组和对照组(P=0.001、0.000、0.003、0.002、0.000),见图1C。各组小鼠肺肿瘤指数、肺脏器指数有显著差异,且肺肿瘤指数、肺脏器指数变化趋势与肺部结节总数相一致,见图1D~1E(P<0.05)。

|
| 1: Control; 2: E2: estrogen; 3: E2I: estrogen inhibitor; 4: E2+E2I; 5: IL-6: Interleukin-6; 6: E2+IL-6; A: pulmonary nodules of mouse lung adenocarcinoma specimens was advisable to do biopsy to diagnose the diseased tissue type; B: tissues taken from pulmonary nodules of part A (HE ×400), and the result showed as displayed lung adenocarcinoma. We took lung tissues of mice in each group to repeat the process of A and B, and then did the following statistical analysis; C: the number of mice pulmonary nodules in E2 group was significantly higher than those in other groups (*: P<0.05); D: the lung index in E2 group was significantly higher than those in other groups (*: P<0.05); E: lung tumor index in E2 group was significantly higher than those in other groups (*: P<0.05) 图 1 小鼠肺部肿瘤结节和HE染色结果以及结节总数、肿瘤指数、肺脏器指数的比校 Figure 1 Mice lung tumor nodules and HE staining result, and contrast of total number of nodules, lung tumor index and lung indices |
采用ELISA检测对照组小鼠血清中E2/IL-6的含量,发现小鼠血清中E2水平显著高于文献报道[10]的正常水平(文献报道低于22 pg/ml, P<0.05),而IL-6水平低于低于文献报道[11]的正常水平(文献报道高于160 pg/ml, P<0.05),见表1。
运用Western blot检测小鼠肺腺癌组织中E2/IL-6信号通路的关键信号分子AKt、MAPK、ERβ及其磷酸化p-AKt、p-MAPK、p-ERβ表达,发现上述检测指标在E2组显著高于E2+E2I组、E2+IL-6组、IL-6组、E2I组和对照组(P=0.001、0.023、0.041、0.032、0.000),见图2。

|
| the expression of key signaling molecules, AKt, MAPK, ERβ, p-AKt, p-MAPK, and p-Erβ, in E2/IL-6 signaling pathway in mouse lung adenocarcinoma tissues detected by immunohistochemical analysis; B: the gray value as shown in the results of each group. Each index value in E2 group was significantly higher than those in E2+E2I, E2+IL-6, IL-6, E2I and Control group (P=0.001, 0.023, 0.041, 0.032, 0.000) 图 2 E2/IL-6信号通路关键信号分子在各组小鼠肺癌组织中的表达 Figure 2 Expression of key molecules in E2/IL-6 signaling pathway in each group of mouse lung adenocarcinoma tissues |
对小鼠肺腺癌组织做ERβ的mRNA水平分析,发现ERβ在E2组显著高于E2+E2I组、E2+IL-6组、IL-6组、E2I组和对照组(P=0.011、0.027、0.014、0.022、0.000),见图3。
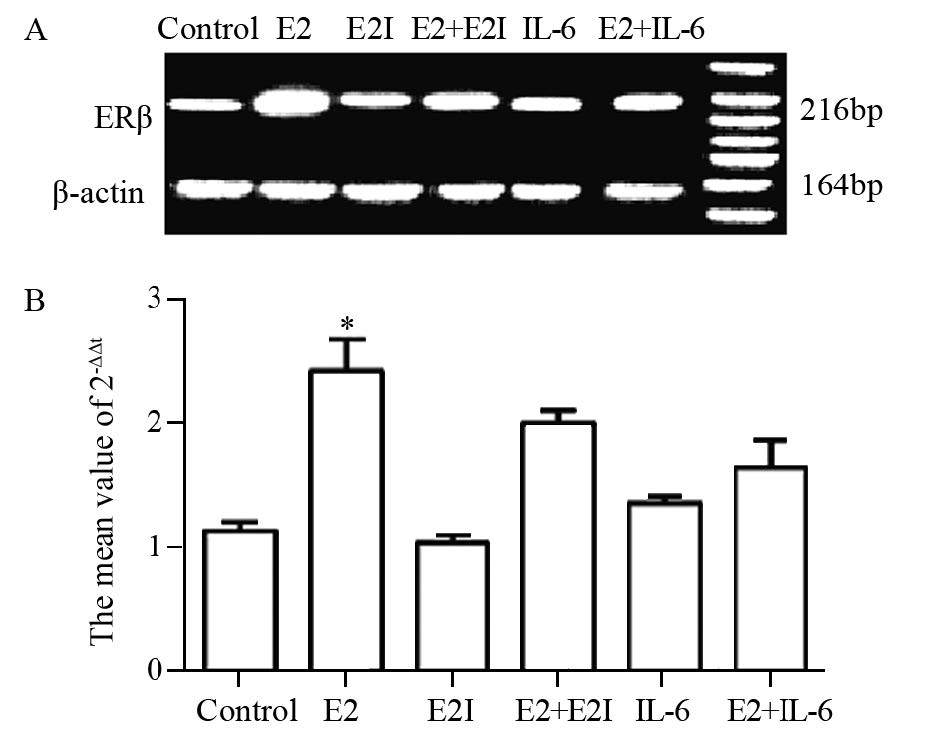
|
| A: the expression of ERβ mRNA in E2 signaling paythway in lung adenocarcinoma tissues detected by real-time quantitative PCR(RT-PCR); B: the gray value as shown in the results of each group. Each index value in E2 group was significantly higher than those in E2 +E2I, E2+IL-6, IL-6, E2I and Control group (P=0.011, 0.027, 0.014, 0.022, 0.000); Δt=Content(experimental group)-Content(β-actin); ΔΔt: average, for example: ΔΔt(IL-8)=Δt(IL-8)-Δt(control); 2-ΔΔt: the average value of 2-ΔΔt. 图 3 ERβ mRNA水平在各组小鼠肺腺癌组织中的表达 Figure 3 ERβ mRNA expression in each group of mouse lung adenocarcinoma tissues |
肺癌具有较高的发病率和死亡率,社会经济因素、饮食、遗传学等因素均具有重要作用,但肺癌的具体病因仍然不是很清楚。近年来肺癌的肿瘤免疫受到越来越多的关注,雌激素促进肺腺癌进展得到众多学者的共识[2, 3, 4],雌激素与IL-6在较多肿瘤中具有相互作者用[6, 7],但是目前肺癌中尚无相关报道。本文重点探讨的是肺癌中炎性因子IL-6与E2之间的相关性。
IL-6是肿瘤组织中重要的炎性反应因子,并在肺癌的发生发展中起到重要作用。IL-6是由巨噬细胞、T细胞、B细胞、内皮细胞和肿瘤细胞产生,并且能够上调抗凋亡和血管生成蛋白而促进肿瘤生长,并与患者的较差预后具有相关性。IL-6通过受体结合导致JAK家族酪氨酸激酶的活化,进而激活PI3K/STAT及其他信号转导蛋白的多个通路[12]。在肺腺癌的研究中,Lai等[13]证实IL-6在肿瘤进展中具有重要作用,并确定了EGFR/IL-6/ STAT3信号转导级联反应;STAT家族的转录因子是肺癌及其他肿瘤潜在的不良预后因子,STAT蛋白受上游细胞因子和酪氨酸激酶信号激活和调节,最终导致肿瘤的抗凋亡和促进增殖效应。本研究中,IL-6水平低于文献报道[10]的正常水平,说明IL-6与小鼠肺腺癌具有重要的相关性。这为研究肺癌的肿瘤免疫提供了一定的理论依据。
E2直接刺激E2反应性基因在肺癌细胞核中的转录,并且激活生长因子信号转导途径,特别是表皮生长因子途径[13]。在本实验中也得出类似结论,本实验成功建立小鼠肺腺癌模型,同时肺结节总数、肿瘤指数、肺脏器指数等肿瘤统计指标在E2组显著高于E2+E2I组、E2I组;在对照组,发现小鼠血清中E2水平显著高于文献报道[10]的正常水平;同时,下游信号分子Akt与MAPK蛋白及其磷酸化(p-Akt、p-MAPK)水平具有与上述表达相一致的趋势这说明E2具有促进小鼠肺腺癌进展的作用。E2促进肺癌进展得到愈来愈多学者的共识,并且在肺癌组织中主要表达的是E2受体β[14, 15]。
然而,近年来有关E2与IL-6在肿瘤中的相互作用受到广泛关注。研究表明,雌二醇可以抑制IL-6以及巨噬细胞抑制因子等细胞因子的产生;在基质及成骨细胞中的也发现,E2抑制IL-6的产生;在基因多态性的研究中,发现IL-6高表达患者的血清中E2水平表达降低[16]。本研究采用ELISA检测对照组小鼠血清中E2/IL-6的含量,发现小鼠血清中E2水平显著高于文献报道[10]的正常水平,而IL-6水平低于低于文献报道[11]的正常水平。基于E2促进小鼠肺腺癌进展,因此表明小鼠肺腺癌中E2可能抑制IL-6的表达。更为重要的是,在本实验中进一步的数据表明,ERβ的蛋白、mRNA及其磷酸化水平(ERβ、mRNA ERβ、p-ERβ)表达在E2组显著高于E2+IL-6组、IL-6组及空白对照组,说明IL-6具有抑制ERβ表达的作用,这与前期文献[16]报道的其他肿瘤中有关E2与IL-6相互作用的结果相一致;同时共同信号分子Akt与MAPK蛋白及其磷酸化(p-Akt、p-MAPK)水平具有与上述表达相一致的趋势,说明炎性因子IL-6在肺腺癌进展的共同通路中具有抑制作用。
综上所述,本文探讨了IL-6在E2促进小鼠肺腺癌进展的作用,发现IL-6下调小鼠肺腺癌进展中的E2信号通路,这为肺腺癌的多靶点联合治疗提供了一种可能的选择方向。鉴于实验条件的限制,本实验没有进一步探讨深入研究IL-6下调肺腺癌中E2信号通路的详细分子机制,也没有探讨E2对IL-6在肺癌进展中参与的作用,这将是我们未来的重点研究方向。
| [1] | Lim VW, Li J, Gong Y, et al. Serum estrogen receptor bioactivity and breast cancer risk among postmenopausal women[J]. Endocr Relat Cancer, 2014, 21(2): 263-73. |
| [2] | Bogush TA, Dudko EA, Beme AA, et al. Estrogen receptors, antiestrogens, and non-small cell lung cancer[J]. Biochemistry (Mosc), 2010, 75(12): 1421-7. |
| [3] | Zeng M, Liao YD, You LK, et al. Expression of estrogen receptor β in human non-small cell lung cancer and its correlation with expression of Ki-67 and Bax[J]. Zhong Liu Fang Zhi Yan Jiu, 2010, 37(8): 905-8. [曾敏, 廖永德, 游良琨, 等. 非小细胞肺癌组织中雌激素受体β和Ki-67、Bax表达的相关性[J]. 肿瘤防治研究, 2010, 37(8): 905-8. |
| [4] | Burns TF, Stabile LP. Targeting the estrogen pathway for the treatment and prevention of lung cancer[J]. Lung Cancer Manag, 2014, 3(1): 43-52. |
| [5] | Wang YS, Miao LY, Liu L, et al. Serum cytokine levels in patients with advanced non-small cell lung cancer: correlation with clinical outcome of erlotinib treatment[J]. Chin Med J (Engl), 2013, 126(20): 3931-5. |
| [6] | Botelho F, Pina F, Lunet N. VEGF and prostatic cancer: a systematic review[J]. Eur J Cancer Prev, 2010, 19(5): 385-92. |
| [7] | Wang YC, Xu GL, Jia WD, et al. Estrogen suppresses metastasis in rat hepatocellular carcinoma through decreasing interleukin-6 and hepatocyte growth factor expression[J]. Inflammation, 2012, 35(1): 143-9. |
| [8] | Carvalho O, Goncalves C. Expression of oestrogen receptors in foetal lung tissue of mice[J]. Anat Histol Embryol, 2012, 41(1): 1-6. |
| [9] | Jackson EL, Olive KP, Tuveson DA, et al. The differential effects of mutant p53 alleles on advanced murine lung cancer[J]. Cancer Res, 2005, 65(22): 10280-8. |
| [10] | Palm R, Chang J, Blair J, et al. Down-regulation of serum gonadotropins but not estrogen replacement improves cognition in aged-ovariectomized 3xTg AD female mice[J]. J Neurochem, 2014, 130(1): 115-25. |
| [11] | Hu J, Chen Z, Gorczynski CP, et al. Sleep-deprived mice show altered cytokine production manifest by perturbations in serum IL-1ra, TNFa, and IL-6 levels[J]. Brain Behav Immun, 2003, 17(6): 498-504. |
| [12] | Prescott E, Bjerg AM, Andersen PK, et al. Gender difference in smoking effects on lung function and risk of hospitalization for COPD: Results from a Danish longitudinal population study[J]. European Respiratory Journal, 1997, 10(4): 822-7. |
| [13] | Lai SY, Johnson FM. Defining the role of the JAK-STAT pathway in head and neck and thoracic malignancies: implications for future therapeutic approaches[J]. Drug Resist Updat, 2010, 13(3): 67-78. |
| [14] | Tang H, Liao Y, Xu L, et al. Estrogen and insulin-like growth factor 1 synergistically promote the development of lung adenocarcinoma in mice[J]. Int J Cancer, 2013, 133(10): 2473-2. |
| [15] | Hammoud Z, Tan B, Badve S, et al. Estrogen promotes tumor progression in a genetically defined mouse model of lung adenocarcinoma[J]. Endocr Relat Cancer, 2008, 15(2): 475-83. |
| [16] | DeMichele A, Gray R, Horn M, et al. Host genetic variants in the interleukin-6 promoter predict poor outcome in patients with estrogen receptor-positive, node-positive breast cancer[J]. Cancer Res, 2009, 69(10): 4184-91. |
 2016, Vol. 43
2016, Vol. 43 

