文章信息
- 寇哲文,林水苗,张兴梅,陈文君,彭勇华,石玉生.
- KOU Zhewen, LIN Shuimiao, ZHANG Xingmei, CHEN Wenjun, PENG Yonghua, SHI Yusheng.
- 靶向notch1的siRNA对U87-EGFRvⅢ胶质瘤细胞株凋亡和放射敏感度的影响
- Effect of siRNA-mediated notch1 Gene Silencing on Apoptosis and Radiosensitivity of Glioma Cell Line U87-EGFRvⅢa
- 肿瘤防治研究, 2016, 43(4): 245-248
- Cancer Research on Prevention and Treatment, 2016, 43(4): 245-248
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.04.001
-
文章历史
- 收稿日期: 2015-04-24
- 修回日期: 2015-10-16
2. 510515 广州,南方医科大学南方医院放疗科
2. Department of Radiation Oncology, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
恶性胶质瘤是最常见的脑肿瘤,呈浸润性生长,对放化疗不敏感。现常规治疗方法是手术配合术后放疗,但预后差,复发率高[1]。含有表皮生长因子受体Ⅲ型突变体(EGFRvⅢ)的胶质瘤侵袭性更高,具有更强的放化疗抗性[2]。
Notch信号转导通路在决定细胞命运中占有重要地位,如细胞的增殖、分化和凋亡等功能。近年来发现Notch信号转导通路在白血病、前列腺癌和胶质瘤等肿瘤中有重要作用[3, 4]。有文献报道,Notch信号通路是促进胶质瘤细胞放疗抗性的一条重要信号通路[5]。RNA干扰(RNA interference,RNAi)技术可以在转录后沉默特定基因的表达,在肿瘤基础研究中应用日益广泛。本研究通过探讨notch1 siRNA对过表达EGFRvⅢ胶质瘤细胞凋亡及放射敏感度的影响,来了解notch1信号通路对体外胶质瘤细胞的生物学作用,为胶质瘤的临床治疗提供新的理论依据和方法。
1 材料和方法 1.1 主要材料和试剂过表达EGFRvⅢ的人U87胶质瘤细胞(U87-EGFRvⅢ)由本室保存。DMEM培养液、Lipofectamine 2000和胎牛血清购自美国Gibco公司;MTT购自美国Sigma公司;Annexin V-FITC凋亡检测试剂盒购自美国BD生物公司;酶联免疫检测仪Bio-RAD550购自美国伯乐公司。针对notch1的siRNA由上海吉玛公司合成,合成的两条链的序列分别为:UGG CGG GAA GUG UGA AGC GTT;CGC UUC ACA CUU CCC GCC ATT 。对照siRNA购自上海吉玛公司。其他试剂均为分析纯。
1.2 方法 1.2.1 细胞培养和转染人U87-EGFRvⅢ细胞株在含10%胎牛血清和400 μg/ml G418的完全培养液中,置37℃、5%CO2的培养箱中培养。取对数生长期的U87-EGFRvⅢ细胞接种于6孔板中。实验分为空白对照组、siRNA对照组和notch1 siRNA组。按照Lipofectamine 2000说明书进行转染,置37℃、5%CO2的培养箱中培养。转染48 h后进行相关检测。
1.2.2 免疫印迹实验取对数生长期的U87-EGFRvⅢ细胞,以1×106个每孔接种于6孔板。转染siRNA 48 h后收集细胞,并用RIPA裂解液提取细胞总蛋白,取30 μg蛋白进行免疫印迹实验。其中兔抗人notch1抗体的稀释度为1:300,HRP标记山羊抗兔二抗的稀释度为1:3 000,内参抗体β-actin作为对照。实验重复3次,测定条带灰度值并计算蛋白的相对表达量。
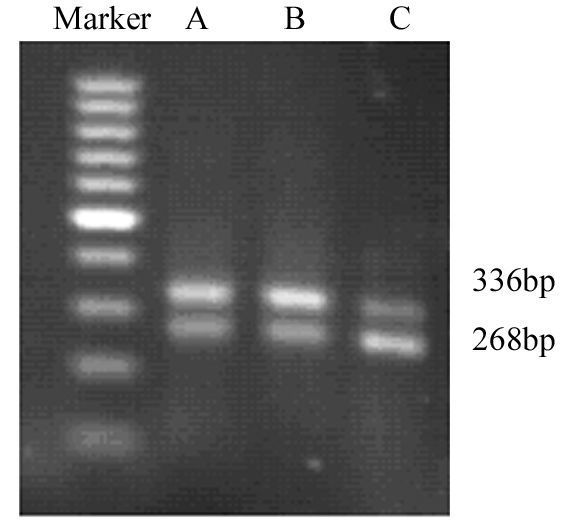
1.2.3 半定量RT-PCR实验用siRNA转染U87-EGFRvⅢ细胞48h后收集细胞,用PBS洗涤2次,采用Trizol法提取细胞的总RNA。利用Takara公司的RT-PCR试剂盒进行以下实验:取4μgRNA用MMLV反转录酶反转录成cDNA。然后以β-actin作为内参对照,用RT-PCR来检测notch 1的基因表达水平。其中β-actin基因上游引物:5’-CTC CAT CCT GGC CTC GCT GT-3’;下游引物:5’-GCT GTC ACC TTC ACC GTT CC-3’。notch1基因上游引物:5’-CCG CAA GCC CAG CAA A-3’;下游引物:5’-GGA CCC GCC CAC AGT GAA AT-3’。PCR反应体系如下:95℃预变性30s;PCR反应95℃变性15s,60℃退火20s,72℃延伸20s,共35个循环。实验重复3次。PCR产物经1.2%琼脂糖凝胶电泳鉴定并进行相对表达量分析。
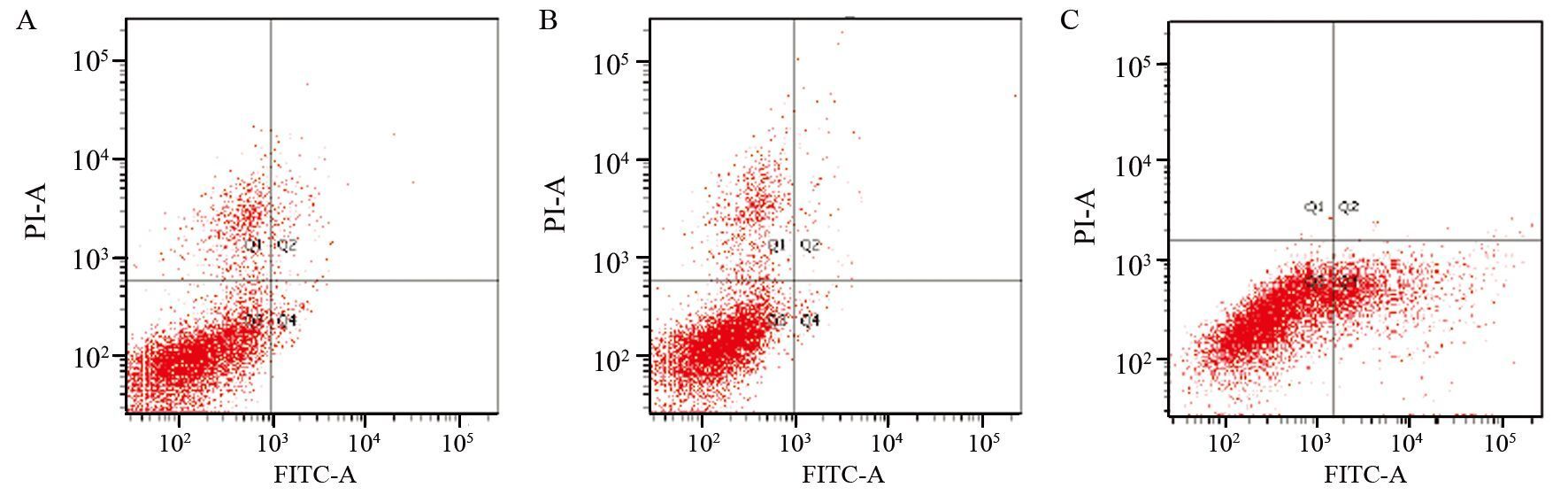
1.2.4 凋亡检测将siRNA转染48h后的U87-EGFRvⅢ细胞用不含EDTA的胰酶进行消化,2 000 r/min离心5min后收集细胞。并用PBS洗涤细胞2次,调整细胞浓度为1×106个/毫升,以100r/min离心10min。弃上清液,然后将细胞重悬溶于1 ml结合缓冲液中。先后加入5μlAnnexin Ⅴ-FITC和5μl的碘化丙啶(propidiumiodine,PI),并轻轻混匀。室温避光保存15min后进行流式细胞仪检测细胞凋亡情况。上述实验重复三次。
1.2.5 平板集落实验细胞按实验分组接种到培养皿中,转染细胞在24h给予剂量为3Gy的X线机照射细胞。照射后立即消化细胞,以每孔200的密度接种于6孔板,每组3个复孔,DMEM完全培养液培养,每3天半换液1次。静置培养14天后,弃去培养液,PBS漂洗1次。用100%甲醇固定15min,1%结晶紫染色10min后用去离子水充分漂洗。晾干后照相并计数各孔细胞克隆数,每组克隆数为3个复孔的平均值,并进行计算:种植率(%)=对照组克隆数/接种数×100%。并计算存活分数SF,SF=照射后形成克隆数/(接种细胞数×细胞种植率)。
1.3 统计学方法采用SPSS13.0软件对实验数据进行统计分析,数据用均数±标准差表示($\overset{-}{\mathop x}\,$±s),组间比较用方差分析。α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结果 2.1 siRNA转染细胞对notch1蛋白表达和mRNA水平的影响免疫印迹实验结果显示siRNA转染细胞48h后,siRNA对照组和空白对照组中notch1蛋白表达量差异无统计学意义(P=0.658),而siRNA转染组中notch1蛋白表达量明显降低,抑制率为(60.41±3.08)%(P=0.002),见图 1。半定量RT-PCR实验结果显示siRNA转染细胞48h后,siRNA对照组和空白对照组的notch1的mRNA表达水平差异无统计学意义(P=0.239),而notch1 siRNA转染组中的notch1mRNA相对表达水平显著降低(P=0.016),见图 2。上述结果提示notch1 siRNA可有效阻断notch1基因和蛋白水平的表达。

|
| 图 1 免疫印迹法检测siRNA对notch1蛋白表达的影响 Fig. 1 Effect of siRNA on notch1 protein expression detected by Western blot |
|
| 图 2 RT-PCR检测siRNA对notch1 mRNA表达的影响 Fig. 2 Effect of siRNA on notch1 mRNA expression detected by RT-PCR |
转染siRNA 48h后用流式细胞仪检测U87-EGFRvⅢ细胞的凋亡情况,空白对照组、siRNA对照组和notch1 siRNA转染组的细胞凋亡率分别为(6.481±0.112)%、(7.256±0.104)% 、(21.093±0.178)%,其中notch1 siRNA转染组的细胞凋亡率明显高于空白对照组和siRNA对照组,差异有统计学意义(P=0.027)。而空白对照组和siRNA对照组的凋亡率相比,差异无统计学意义(P=0.381),见图 3。

|
| 图 3 AnnexinⅤ-FITC/PI法检测siRNA对细胞凋亡率的影响 Fig. 3 Effect of siRNA on cells apoptosis detected by Annexin Ⅴ-FITC/PI |
利用平板集落实验来检测单纯放射组、单纯转染组、转染+3Gy放射组的集落形成率,结果显示单纯放射组为(47.81±6.04)%(n=3),单纯转染组为(49.37±6.42)%(n=3),转染+3Gy放射组为(20.19±4.85)%(n=3),其中转染+3Gy照射组与单纯放射组和单纯转染组之间比较差异有统计学意义(P=0.027、 0.013),而单纯放射组和单纯转染组之间比较差异无统计学意义(P=0.436),见图 4。
|
| 图 4 notch1 siRNA对细胞集落形成率的影响 Fig. 4 Effect of notch1 siRNA on cells colony forming rate |
近年来研究认为Notch信号转导途径在细胞的增殖、分化、凋亡、维持干细胞特性等方面有重要作用。已在一些肿瘤中发现notch的高表达。增加notch活性可促进肿瘤增生,抑制notch活性可以抑制肿瘤的存活[6]。notch家族含有多种notch受体(1~4)及多种notch配体。信号激活并切割释放的跨膜肽的胞内区(notch intracellular domain,NICD)是notch活性所必需的[7]。
现在发现notch1在多种胶质瘤细胞株和原发胶质瘤标本中出现高表达。抑制notch的siRNA可在体内外抑制胶质瘤的生长[8, 9]。我们在以前的研究中发现用GSI-I(一种γ-分泌酶抑制剂)抑制Notch信号转导通路可以提高胶质瘤的放射敏感度[10]。
本研究以notch1为靶点的siRNA作用于U87-EGFRvⅢ细胞,来观察阻断notch1基因对细胞的凋亡和放射敏感的影响。首先证实了notch1 siRNA可特异地阻断U87-EGFRvⅢ细胞中的notch1 mRNA和蛋白质水平的表达,同时用流式细胞术检测了其对细胞的促凋亡作用。平板集落形成实验可初步得出notch1 siRNA可提高U87-EGFRvⅢ细胞的放射敏感度,它可能通过促进细胞凋亡和抑制细胞增殖来达到增敏作用。
现在认为在胶质瘤中存在的胶质瘤干细胞是肿瘤放化疗抗性及复发的主要原因。Notch信号通路通过促进自我更新和抑制分化来维持胶质瘤干细胞的特性,并且是胶质瘤产生放射抗性的主要原因。JAGGED1是人胶质瘤中含量最丰富的notch配体,也是维持胶质瘤干细胞特性所必需分子。近来研究发现EGFRvⅢ也是维持胶质瘤干细胞干性的重要分子[11]。EGFRvⅢ可能通过MAPK信号通路诱导JAGGED1来使某些胶质瘤细胞获得胶质瘤干细胞特性,从而提高胶质瘤细胞的放射抗性,也就是EGFRvⅢ可能通过调节JAGGED1-Notch信号途径来使胶质瘤细胞产生更强的放射抗性[12],所以抑制notch1的siRNA可能通过抑制此途径来增加过表达EGFRvⅢ的胶质瘤细胞的放射敏感度。在60%~70%胶质瘤中有EGFR的过表达,这其中约有一半伴随出现EGFRvⅢ突变,我们使用的U87-EGFRvⅢ有野生型和突变型EGFRvⅢ的存在。由于notch1可能会通过调节p53使EGFR增加[13],所以notch1 siRNA可能通过减少EGFR的作用产生抑制增殖和促进凋亡等作用。鉴于本实验为体外细胞实验,notch1 siRNA在体内的作用机制可能与体外实验不同,我们会继续探讨notch1 siRNA在体内作用的可能机制。
本研究只是初步探讨了notch1和胶质瘤放射敏感度的关系,其分子机制还需要进一步探讨。这些结果对胶质瘤的放疗敏感度和放疗抗性等方面的应用提供了有用信息。
| [1] | Carrasco-García E, Saceda M, Martínez-Lacaci I. Role of receptor tyrosine kinases and their ligands in glioblastoma[J]. Cells, 2014, 3(2): 199-235. |
| [2] | Mukherjee B, McEllin B, Camacho CV, et al. EGFRvⅢand DNA double-strand break repair: a molecular mechanism for radioresistance in glioblastoma[J]. Cancer Res, 2009, 69(10): 4252-9. |
| [3] | Herranz D, Ambesi-Impiombato A, Palomero T, et al. A NOTCH1-driven MYC enhancer promotes T cell development, transformation and acute lymphoblastic leukemia[J]. Nat Med, 2014, 20(10):1130-7. |
| [4] | Liu M, Inoue K, Leng T, et al. TRPM7 channels regulate glioma stem cell through STAT3 and Notch signaling pathways[J]. Cell Signal, 2014, 26(12): 2773-81. |
| [5] | Wang J, Wakeman TP, Lathia JD, et al. Notch promotes radioresistance of glioma stem cells[J]. Stem Cells, 2010, 28(1): 17-28. |
| [6] | Takebe N, Nguyen D, Yang SX. Targeting notch signaling pathway in cancer: clinical development advances and challenges[J]. Pharmacol Ther, 2014, 141(2): 140-9. |
| [7] | Capaccione KM, Pine SR. The Notch signaling pathway as a mediator of tumor survival[J]. Carcinogenesis, 2013, 34(7): 1420-30. |
| [8] | Xie M, He CS, Wei SH, et al. Notch-1 contributes to epidermal growth factor receptor tyrosine kinase inhibitor acquired resistance in non-small cell lungcancer in vitro and in vivo[J]. Eur J Cancer, 2013, 49(16): 3559-72. |
| [9] | Xu P, Zhang A, Jiang R, et al. The different role of Notch1 and Notch2 in astrocytic gliomas[J]. PLoS One, 2013, 8(1): e53654. |
| [10] | Lin J, Zhang XM, Yang JC, et al. γ-secretase inhibitor-I enhances radiosensitivity of glioblastoma cell lines by depleting CD133+ tumor cells[J]. Arch Med Res, 2010, 41(7): 519-29. |
| [11] | Emlet DR, Gupta P, Holgado-Madruga M, et al. Targeting a glioblastoma cancer stem-cell population defined by EGF receptor variant Ⅲ[J]. Cancer Res, 2014, 74(4): 1238-49. |
| [12] | Kim EJ, Kim SO, Jin X, et al. Epidermal growth factor receptor variant III renders glioma cancer cells less differentiated by JAGGED1[J]. Tumour Biol, 2015, 36(4): 2921-8. |
| [13] | Purow BW, Sundaresan TK, Burdick MJ, et al. Notch-1 regulates transcription of the epidermal growth factor receptor through p53[J]. Carcinogenesis, 2008, 29(5): 918-25. |
 2016, Vol. 43
2016, Vol. 43


