文章信息
- 纪子梅,梅晓冬,费广茹,郭欣,蒋旭琴.
- JI Zimei, MEI Xiaodong, Fei Guangru, Guo Xin, JIANG Xuqin.
- 配体靶向多聚酶链反应法检测非小细胞肺癌患者胸腔积液中肿瘤细胞水平的临床价值
- Evaluation of Ligand-targeted PCR Method in Detecting Tumor Cell Levels in Pleural Effusion of Patients with Non-small Cell Lung Cancer
- 肿瘤防治研究, 2016, 43(03): 226-229
- Cancer Research on Prevention and Treatment, 2016, 43(03): 226-229
- http://www.zlfzyj.com/CN/abstract/abstract8717.shtml
-
文章历史
- 收稿日期: 2015-05-30
- 修回日期: 2015-09-14
肺癌的发病率和死亡率在恶性肿瘤中居首位,15%患者首诊已出现胸腔积液。然而有研究报道约5%肺癌患者出现的胸腔积液并非转移引起,患者仍然有手术机会[1, 2]。目前确诊恶性胸腔积液的金标准仍然是脱落细胞病理学检查,但其阳性率并不能满足临床诊断的需要[3],有时难以区别正常细胞和反应不典型增生细胞以及恶性细胞[4]。因此,探索鉴别良、恶性胸腔积液的新的实验室方法,提高肿瘤细胞检出率,具有重要的临床意义。
循环肿瘤细胞(circulating tumor cell,CTC)是逃离肿瘤组织进入循环系统并具有侵袭转移能力的细胞[5, 6]。研究发现,循环肿瘤细胞检测技术有助于肿瘤早期诊断、正确地临床分期及判断患者预后。在治疗期间定期监测循环肿瘤细胞的变化,可为评价治疗方案的敏感度提供依据,有利于开展个体化治疗[7]。鉴于该技术对肿瘤细胞检测的高敏感度,本研究采用该方法对肺癌合并的胸腔积液进行肿瘤细胞定量检测,分析患者胸腔积液中肿瘤细胞水平与病情状况以及某些实验室结果之间的关系,并与传统脱落细胞病理学检查进行比较,评价其诊断恶性胸腔积液的临床价值。
1 资料与方法 1.1 一般资料选择2013年1月~2013年12月在安徽省立医院确诊的初诊非小细胞肺癌合并胸腔积液患者50例为研究对象。纳入标准:(1)病理学检查确诊为原发性肺癌且合并胸腔积液的患者;(2)新诊断且未接受放、化疗的患者;(3)胸腔积液常规检查提示为渗出液。排除标准:(1)合并终末期肝病或者肾病患者;(2)入组前5年内合并其他恶性肿瘤的患者。50例患者中,男27例,女23例;年龄47~81岁(平均62.1±9.5岁),≥62岁27例,<62岁23例;腺癌25例,鳞癌25例。抽取50 ml胸腔积液放入EDTA抗凝管,静置,4℃冰箱保存,所有实验在24 h内完成。
1.2 研究方法 1.2.1 一般资料及胸腔积液采集资料收集包括入选患者的年龄、性别、肺癌的病理类型。所有患者通过CT、核磁共振或PET-CT等方法确定有无肺内、淋巴结、肝脏、骨、头颅和肾上腺转移,并记录转移部位的数目,一个部位有转移记录为1,以此类推,评价患者身体状况PS评分。予以患者胸腔穿刺抽液,留取胸腔积液。
1.2.2 胸腔积液中肿瘤细胞检测循环肿瘤细胞检测盒由格诺思博生物科技(上海)有限公司生产提供,具体操作按照试剂盒说明书并参考有关文献报告[8]进行。首先采用磁珠分选法富集肿瘤细胞;然后采用LT-PCR法扩增对肿瘤细胞进行定量分析。
1.2.3 胸腔积液CEA检测胸腔积液标本5 ml,3000 r/min(200 g)离心10 min后取上清液检测,使用美国贝克曼DXI800自动发光兔疫分析仪,采用微粒子酶促化学发光法检测胸腔积液中CEA水平。
1.2.4 胸腔积液脱落细胞病理学检查胸腔积液标本充分沉淀,弃去上清液,取10 ml沉淀以2 000 r/min离心10 min,弃上清液,取细胞层涂片4张。涂片潮干时,立刻放入95%乙醇中固定,作HE染色;2张在自然干燥后立即进行Wright染色。两者综合分析作出诊断。
1.3 统计学方法 采用SigmaPlot12.0和SPSS17.0进行统计学分析。连续变量以( ±s)表示,独立样本t检验或者Mann-Whitney U检验比较两组均数或者分布位置之间的差异是否有统计学意义,以单因素方差分析或Kruskal-Wallis H检验比较多组之间的差异是否具有统计学意义。两组连续变量之间的相关性分析采用Spearman相关法。P<0.05为差异有统计学意义。
±s)表示,独立样本t检验或者Mann-Whitney U检验比较两组均数或者分布位置之间的差异是否有统计学意义,以单因素方差分析或Kruskal-Wallis H检验比较多组之间的差异是否具有统计学意义。两组连续变量之间的相关性分析采用Spearman相关法。P<0.05为差异有统计学意义。
结果显示,肿瘤细胞数值与患者性别(P>0.05)、年龄(r=0.156,P>0.05)、病理类型(P>0.05)之间无明显关系,见图 1。
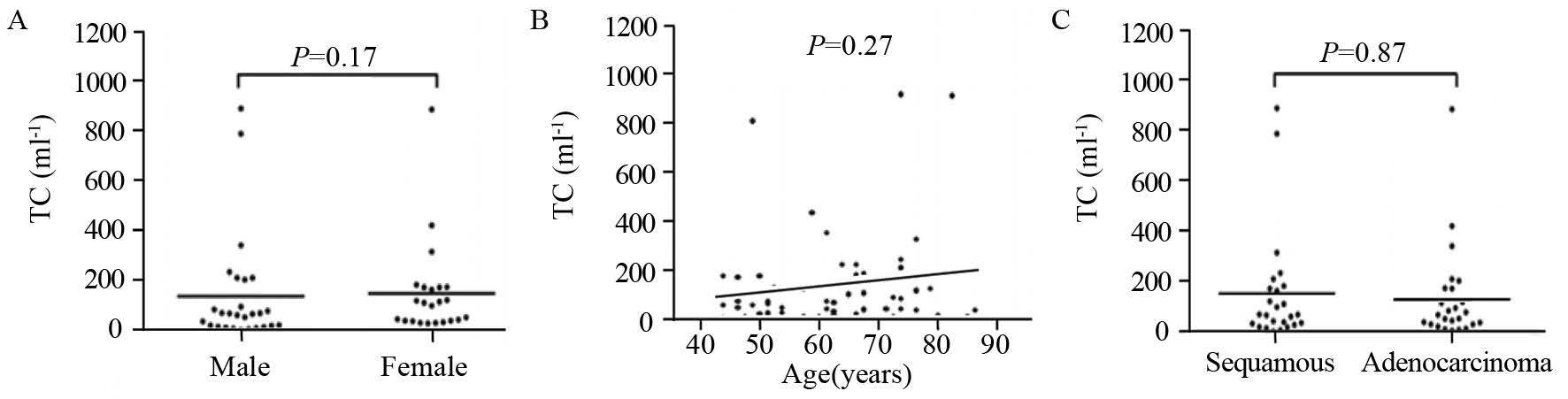
|
| 图 1 NSCLC患者胸腔积液中肿瘤细胞水平与性别(A)、年龄(B)以及不同病理分型(C)的关系 Figure. 1 Association between tumor cell(TC) levels and sex(A), age(B) and pathological types(C) in pleural effusion of NSCLC patients |
患者身体状况PS评分共分为0、1、2、3分4级,结果显示,4级肿瘤细胞水平依次为:(85.6±99.7)/ml、(68.94±76)/ml、(144.97±113.8)/ml、(507.46±387.27)/ml。随着患者PS评分越高,胸腔积液中肿瘤细胞水平有逐渐增高的趋势,PS评分3分的患者肿瘤细胞水平显著高于0、1和2分的患者,差异有统计学意义(P<0.01),见图 2。

|
| 图 2 不同PS评分NSCLC患者胸腔积液中肿瘤细胞水平的差异 Figure. 2 TC levels in pleural effusion of NSCLC patients with different PS scores |
结果显示,胸腔积液中肿瘤细胞水平和CEA水平呈显著正相关(r=0.9092,P<0.0001),见图 3。
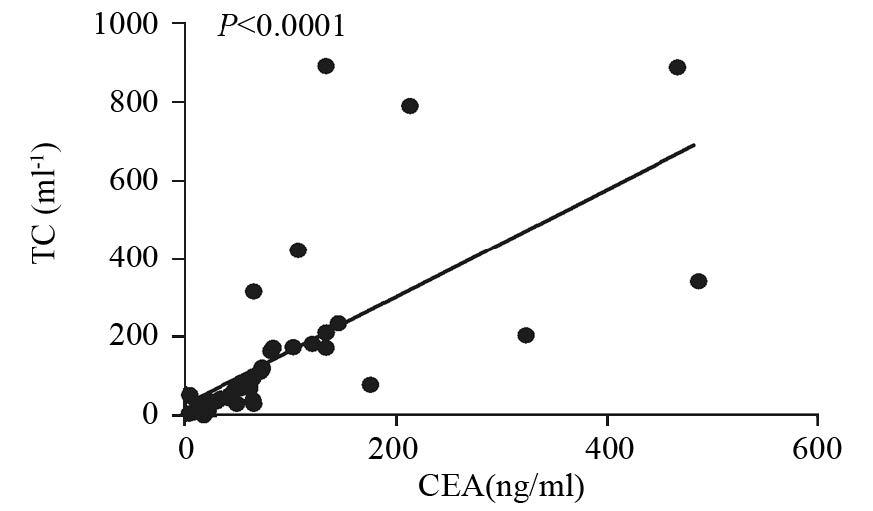
|
| 图 3 NSCLC患者胸腔积液中肿瘤细胞水平与胸腔积液中CEA水平的相互关系 Figure. 3 Relationship between TC levels and CEA levels in pleural effusion of NSCLC patients |
分别记录每例研究对象发生转移部位的多少,转移部位分为1、2、3、4个的患者肿瘤细胞水平依次为(31.26±35.27)/ml、(77.67±56.05)/ml、(177.73±222.98)/ml、(374.41±330.48)/ml。结果表明,转移部位越多,肿瘤细胞水平也越高(P<0.01),见图 4。

|
| 图 4 NSCLC患者胸腔积液中肿瘤细胞水平与患者转移部位数目的关系 Figure. 4 Relationship between TC levels and tumor metastasis numbers in pleural effusion of NSCLC patients |
胸腔积液脱落细胞学检查结果显示阳性组与阴性组患者胸水肿瘤细胞水平分别为(261.74±272.44)/ml和(90.61±144.24)/ml,阳性组显著高于阴性组,两组间差异有统计学意义(P<0.01),见图 5。

|
| 图 5 胸腔积液中肿瘤细胞水平与细胞学阳性率的关系 Figure. 5 Relationship of TC levels in pleural effusion of NSCLC patients with negative or positive results of cytology examination |
循环肿瘤细胞检测技术是近年发展起来的一种高效检测技术,被誉为“液体活检”,能够检测到循环系统中的极微量肿瘤细胞,理论上能检测出3 ml血液中的一个肿瘤细胞。有研究报道,采用该技术检测发现循环肿瘤细胞与非小细胞肺癌患者临床分期相关,可用来预测患者的化疗疗效[9]。该技术主要原理是采用标志物结合肿瘤表面的特异性标志物,进行肿瘤细胞定量检测。方法有直接镜检法或者流式细胞术法对肿瘤细胞进行计数;或对肿瘤细胞进行免疫磁珠富集后,采用高灵敏度的荧光定量基因扩增技术对肿瘤表面特定肿瘤标记物进行检测,计算得到结果。该技术已在临床应用并被证实有极高的准确性和可靠性[10, 11]。研究发现,循环肿瘤细胞数量在肺癌进展和转移过程中均增加,在病情监测中具有重要作用[12]。NSCLC患者外周血中循环肿瘤细胞与病情分期、无进展生存期和总生存期有密切关系,且患者首次化疗后循环肿瘤细胞的降低程度和预后也有良好的相关性[13]。小细胞肺癌(SCLC)患者外周血中循环肿瘤细胞阴性组的生存率显著高于阳性组,化疗后循环肿瘤细胞数值较基线水平显著降低,其降低的程度与总生存期明显相关[14]。
本研究使用了肿瘤细胞表面特异性标记结合检测的方法,对NSCLC患者的胸水肿瘤细胞水平进行检测。该方法是采用特异性小分子探针对肿瘤细胞进行标记并结合形成复合物,然后利用特异性引物,对探针上的寡聚核苷酸分子进行PCR定量检测,换算出单位容积标本中肿瘤细胞的数量,并以肿瘤细胞水平(TC/ml)表示。本研究结果显示初诊NSCLC患者胸腔积液中肿瘤细胞水平与患者性别、年龄、病理类型无明显关系,与PS评分、转移程度有关。 PS评分与患者生存状态、预后的关系密切,胸腔积液中肿瘤细胞水平和患者的PS评分呈正相关,肿瘤细胞水平越高的患者,肿瘤负荷越高,PS评分越高,预后可能越差;胸水中肿瘤细胞水平与转移部位的数量有关,转移部位多的患者,肿瘤细胞水平也较高,提示肿瘤细胞水平与转移有关。NSCLC患者胸腔积液肿瘤细胞水平还与CEA水平显著正相关,提示肿瘤细胞水平和肿瘤标志物之间具有良好的互补性以提高恶性胸腔积液确诊率。在检测效能方面,胸腔积液中脱落细胞学检查阳性组的肿瘤细胞水平,显著高于脱落细胞检查阴性组,显示肿瘤细胞水平检测技术优于常规病理学脱落细胞检查,能够检测出脱落细胞检查阴性但实际上胸水中已经存在有肿瘤细胞,从而确定某些患者的胸水是恶性胸腔积液,提高了恶性胸腔积液的诊断率。
总之,胸水中肿瘤细胞水平检测有助于肺癌患者胸腔积液的鉴别诊断,肿瘤细胞水平与患者PS评分、病情严重程度、转移有关,检测敏感度优于传统的胸水脱落细胞检测方法。在现有的NSCLC诊疗评估体系中加入肿瘤细胞水平检测,可能有助于患者预后的正确评估及治疗方案的合理选择,深入研究并使之标准化,有重要的临床意义。
| [1] | Xie L, Chen X, Wang L, et al. Cell-free miRNAs may indicate diagnosis and docetaxel sensitivity of tumor cells in malignant effusions[J]. BMC Cancer, 2010, 10: 591. |
| [2] | Morgensztern D, Waqar S, Subramanian J, et al. Prognostic impact of malignant pleural effusion at presentation in patients with metastatic non-small-cell lung cancer[J]. J Thorac Oncol, 2012, 7(10): 1485-9. |
| [3] | Murali R, Loughman NT, McKenzie PR, et al. Cytological features of melanoma in exfoliative fluid specimens[J]. J Clin Pathol, 2009, 62(7): 638-43. |
| [4] | A L H, M K U, U A, et al. Are unstained smears, effective tools in the evaluation of the cytological sample adequacy?[J]. J Clin Diagn Res, 2012, 6(10): 1672-4. |
| [5] | Joosse SA, Pantel K. Biologic challenges in the detection of circulating tumor cells[J]. Cancer Res, 2013, 73(1): 8-11. |
| [6] | Khan MS, Kirkwood A, Tsigani T. Circulating tumor cells as prognostic markers in neuroendocrine tumors[J]. J Clin Oncol, 2013, 31(3): 365-72. |
| [7] | Yu M, Bardia A, Wittner BS, et al. Circulating breast tumor cells exhibit dynamic changes in epithelial and mesenchymal composition[J]. Science, 2013, 339(6119): 580-4. |
| [8] | Yu Y, Chen Z, Dong J, et al. Folate receptor-positive circulating tumor cells as a novel diagnostic biomarker in non-small cell lung cancer[J]. Transl Oncol, 2013, 6(6): 697-702. |
| [9] | Li J, Jiang B, Wan P, et al. Clinical Significance of Circulating Tumor Cells Detection in Non-small Cell Lung Cancer Patients[J].Zhongguo Quan Ke Yi Xue, 2013, 16(27): 3202-4. [李晶, 姜北, 万鹏, 等. 晚期非小细胞肺癌患者循环肿瘤细胞检测的临床意义[J]. 中国全科医学, 2013, 16(27): 3202-4.] |
| [10] | Stathopoulos GT, Kalomenidis I. Malignant pleural effusion: tumor-host interactions unleashed[J]. Am J Respir Crit Care Med, 2012, 186(6): 487-92. |
| [11] | Lou J, Ben S, Yang G, et al. Quantification of rare circulating tumor cells in non-small cell lung cancer by ligand-targeted PCR[J]. PLoS One, 2013, 8(12): e80458. |
| [12] | Tanaka F, Yoneda K, Kondo N, et al. Circulating tumor cell as a diagnostic marker in primary lung cancer[J]. Clin Cancer Res, 2009, 15(22): 6980-6. |
| [13] | Krebs MG, Sloane R, Priest L, et al. Evaluation and prognostic significance of circulating tumor cells in patients with non-small-cell lung cancer[J]. J Clin Oncol, 2011, 29(12): 1556-63. |
| [14] | Hiltermann TJ, Pore MM, van den Berg A, et al. Circulating tumor cells in small-cell lung cancer: a predictive and prognostic factor[J]. Ann Oncol, 2012, 23(11): 2937-42. |
 2016, Vol. 43
2016, Vol. 43


