文章信息
- 张凤娟,刘飞,谷丽娜,桑梅香.
- ZHANG Fengjuan, LIU Fei, GU Li’na, SANG Meixiang.
- EZH2和H3K27me3在食管鳞状细胞癌中的表达及意义
- Expression of EZH2 and H3K27me3 in Esophageal Squamous Cell Carcinoma and Their Significance
- 肿瘤防治研究, 2016, 43(03): 216-220
- Cancer Research on Prevention and Treatment, 2016, 43(03): 216-220
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.03.010
-
文章历史
- 收稿日期: 2015-05-08
- 修回日期: 2015-10-12
2. 050011石家庄,河北医科大学第四医院肿瘤研究所
2. Tumor Research Institute, The Fourth Hospital of Hebei Medical University, Shijiazhuang 050011, China
EZH2(ehancer of zeste homolog 2)是果蝇zeste基因增强子的人类同源物,是PcG(polycomb group)基因家族的重要成员[1, 2]。PcG蛋白构成不同的PRC蛋白复合物(polycomb repressive complex),主要包括PRC1和PRC2。EZH2是组成PRC2蛋白复合物的一个催化亚基,在该复合物中起核心作用。EZH2具有组蛋白甲基转移酶的作用,能使核小体组蛋白H3的第27位赖氨酸(H3K27)侧链上的ε氨基发生三甲基化,三甲基化后的H3K27(H3K27me3)能将PRC2复合 物招募到特定的基因位点,沉默靶基因的表达[3]。研究表明EZH2在恶性肿瘤中表达增高,并与肿瘤的侵袭和转移相关[4, 5, 6, 7, 8]。关于EZH2及H3K27me3在人食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)中的表达相关研究目前较少。本研究拟利用免疫组织化学方法检测ESCC标本中EZH2和H3K27me3的表达,并分析两者表达与ESCC患者预后的关系,以探讨EZH2及H3K27me3在ESCC发生发展中的作用。
1 资料和方法 1.1 临床资料选取河北医科大学第四医院2009年1月至2009年8月间胸外科行肿瘤切除术的食管鳞状细胞癌(ESCC)患者65例,其中男45例、女20例,患者的具体临床资料见表 1。所有患者术前未经任何抗肿瘤治疗且均于术后得到确切的病理学诊断。每例患者均取ESCC原发灶组织及癌旁组织(距离癌灶边缘3~5 cm)标本。组织标本离体后均经10%中性甲醛固定,常规石蜡包埋,制成厚4 μm的连续病理切片,行免疫组织化学染色。
 |
免疫组织化学染色按照SP法进行,免疫组织化学试剂盒购自于北京中杉金桥生物技术有限公司。石蜡包埋组织制成4 μm的病理切片,二甲苯常规脱蜡,乙醇梯度水化,自来水缓水冲洗3次,1×PBS洗2次,pH值9.0的EDTA抗原修复,冷却后1×PBS洗2次,3%过氧化氢孵育20 min,1×PBS洗2次,置于湿盒中,正常山羊血清37℃条件下封闭45 min,1×PBS洗2次,滴加1: 200倍稀释的兔抗人的EZH2多克隆抗体(美国Invitrogen公司)或兔抗人的H3K27me3多克隆抗体(美国Cell Signaling公司),4℃过夜,1×PBS洗2次,滴加试剂盒提供的生物素化山羊抗兔二抗工作液原液一滴,温箱中孵育30 min,1×PBS洗2次,滴加试剂盒提供的辣根酶标记链酶卵白素工作液(三抗)原液一滴,温箱中孵育30 min,应用DAB液显色,蒸馏水终止显色,苏木精对比染色3 min,过水三次,盐酸酒精一过,过水,氨水返蓝3 min,过水,80%乙醇5 min,95%乙醇5 min,无水乙醇5 min浸泡两次,中性树胶封片。
1.3 阳性判定标准光学显微镜下观察,随意选取5个高倍视野(×200),计数肿瘤细胞总数和阳性细胞数,得出阳性细胞百分率。阳性细胞率≤25%为0分,25%~50%为1分,>50%~75%为2分,>75%为3分;再按多数阳性细胞呈现的染色强度予以记分,无显色为0分,浅棕黄色为1分,棕黄色为2分,棕褐色为3分。以上均有两名有经验的临床病理医师阅片,并采用双盲法进行判定。将上述两项得分相加,0分判为(-),1~2分判为(+),3~4分判为(++),5~6分判为(+++)。本研究以(++)和(+++)定义为该蛋白表达阳性,(-)和(+)定义为该蛋白表达阴性。
1.4 统计学方法采用SPSS13.0统计软件进行统计分析,计数资料以率表示,采用卡方检验或连续校正的卡方检验统计EZH2和H3K27me3的表达与ESCC患者临床病理学指标之间的关系,利用Kaplan-Meier方法及Log rank检验分析两者表达与食管癌生存率之间的关系。P<0.05为差异有统计学意义。
2 结果 2.1 EZH2蛋白在ESCC组织中的表达EZH2蛋白在ESCC组织中主要表达于细胞核,部分表达于细胞质,主要呈棕黄色颗粒,见图 1。65例癌旁组织中EZH2蛋白阳性表达率为44.6%。65例ESCC组织中EZH2蛋白阳性表达率为70.8%,明显高于癌旁组织,差异有统计学意义(P=0.004),见表 2。

|
| A: positive expression of EZH2 in ESCC tissues; B: negative expression of EZH2 in para-carcinoma tissues; ESCC: esophageal squamous cell carcinoma 图 1 EZH2蛋白在ESCC组织中的阳性表达及癌旁组织中 的阴性表达 (IHC ×200) Figure 1 Expression of EZH2 in ESCC and paracarcinoma tissues (IHC ×200) |
 |
H3K27me3蛋白在ESCC组织中表达于细胞核,主要呈棕黄色颗粒,见图 2。65例食管癌旁组织中H3K27me3蛋白阳性表达率为26.2%。65例ESCC组织中H3K27me3蛋白阳性表达率为47.7%,明显高于癌旁组织,差异有统计学意义(P=0.018),见表 2。

|
| A: positive expression of H3K27me3 in ESCC tissues; B: negative expression of H3K27me3 in para-carcinoma tissues 图 2 H3K27me3蛋白在ESCC组织中的阳性表达及癌旁组 织中的阴性表达 (IHC ×200) Figure 2 Expression of H3K27me3 in ESCC and paracarcinoma tissues (IHC ×200) |
19例EZH2蛋白表达阴性的ESCC组织中有5例H3K27me3蛋白表达阳性,阳性率为26.3%;46例EZH2蛋白表达阳性的ESCC组织中有26例H3K27me3蛋白表达阳性,阳性率为56.5%;明显高于EZH2表达阴性组,提示EZH2蛋白表达与H3K27me3蛋白表达之间存在正相关关系(P=0.032),见表 3。
 |
EZH2蛋白表达与ESCC患者的年龄、性别、原发肿瘤侵犯程度均无相关性(P=0.791、1.000、0.413)。在13例组织学分级为G1的患者中EZH2蛋白表达阳性的有6例(46.2%),35例组织学分级为G2的患者中EZH2蛋白表达阳性的有25例(71.4%),17例组织学分级为G3~4的患者中EZH2蛋白表达阳性的有15例(88.2%),提示EZH2蛋白表达与患者的组织学分级呈正相 关关系(χ2=6.408,P=0.041)。11例淋巴结转移阴性的患者中,EZH2蛋白表达阳性的有4例(36.4%),54例淋巴结转移阳性的患者中,EZH2蛋白表达阳性的有42例(77.8%),提示EZH2蛋白表达与患者的淋巴结转移状态呈正相关关系(χ2=5.707,P=0.011),见表 1。
2.5 H3K27me3蛋白表达与ESCC患者临床病理学指标的关系H3K27me3蛋白表达与ESCC患者的年龄、性别、原发肿瘤侵犯程度均无相关性(P=1.000、1.000、0.632)。在13例组织学分级为G1的患者中H3K27me3蛋白表达阳性的有4例(30.8%),35例组织学分级为G2的患者中H3K27me3蛋白表达阳性的有14例(40.0%),17例组织学分级为G3~4的患者中H3K27me3蛋白表达阳性的有13例(76.5%),提示H3K27me3蛋白表达与患者的组织学分级呈正相关关系(χ2=8.261,P=0.016)。11例淋巴结转移阴性的患者中,H3K27me3蛋白表达阳性的有2例(18.2%),54例淋巴结转移阳性的患者中,H3K27me3蛋白表达阳性的有29例(53.7%),提示H3K27me3蛋白表达与患者的淋巴结转移状态呈正相关关系(χ2=3.308,P=0.047),见表 1。
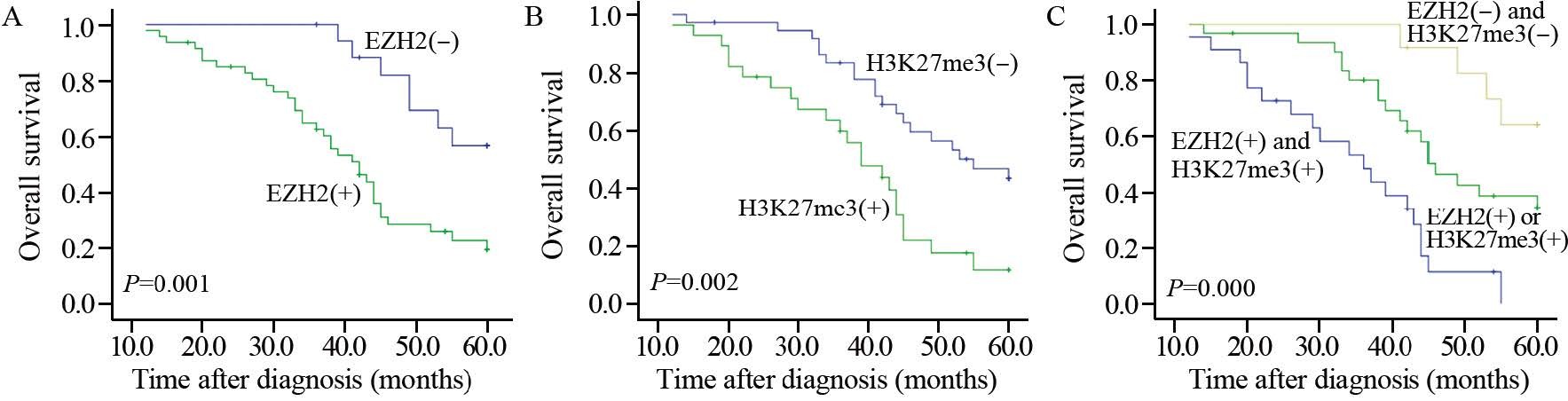
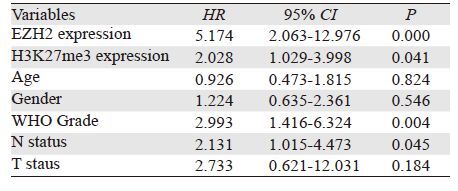
2.6 EZH2和H3K27me3蛋白表达与ESCC患者预后的关系EZH2和H3K27me3表达阳性的ESCC患者五年总生存率明显低于表达阴性的患者(P=0.001和P=0.002);EZH2和H3K27me3双阳性的ESCC患者五年总生存率明显低于EZH2和H3K27me3单阳性和双阴性的患者(P=0.000),见图 3。提示EZH2和H3K27me3蛋白的高表达与ESCC患者的不良预后相关。多因素Cox回归分析结果显示,淋巴结转移、组织学分级、EZH2表达和H3K27me3表达是ESCC患者的独立预后因素,见表 4。
|
| A: correlation between EZH2 expression and overall survival of ESCC patients; B: correlation between H3K27me3 expression and overall survival of ESCC patients; C: correlation between EZH2, H3K27me3 expression and overall survival of ESCC patients 图 3 EZH2和H3K27me3蛋白表达与ESCC患者五年总生存率的关系 Figure 3 Correlation between EZH2, H3K27me3 expression and 5-year overall survival of ESCC patients |
 |
组蛋白甲基化是一种重要的表观遗传学修饰,参与基因的表达调控。作为一种组蛋白甲基转移酶,EZH2可以和SUZ12、EED、RbAP46/48形成PRC2复合物,从而使核小体组蛋白H3的第27位赖氨酸发生三甲基化,三甲基化后的H3K27(H3K27me3)能将PRC2复合物招募到特定的基因位点,抑制靶基因的转录[3, 9]。这些靶基因中包含了一些肿瘤抑制基因,这些基因在细胞周期的调控以及细胞分化等方面发挥重要作用。研究表明EZH2的高表达与多种肿瘤的侵袭和转移相关[5, 6, 10, 11]。
有研究显示,H3K27me3在肝癌、前列腺癌、结肠癌和鼻咽癌中存在异常表达[12, 13, 14, 15],是重要的独立预后指标。He等同时研究了EZH2和H3K27me3在胃癌中的表达状况,结果显示EZH2和H3K27me3的同时高表达可作为胃癌患者预后不良的重要标记,且EZH2和H3K27me3的高表达可作为胃癌患者淋巴结转移的预测指标[16]。关于EZH2和H3K27me3在人食管鳞癌中的表达状况及相关性研究目前尚未见报道。本研究结果显示,EZH2蛋白在ESCC组织中的阳性表达率为70.8%,明显高于癌旁组织;H3K27me3蛋白在ESCC组织中的阳性表达率为47.7%,明显高于癌旁组织;提示EZH2和H3 K27me3在ESCC的发生发展过程中发挥重要作用。研究结果还显示,EZH2和H3K27me3蛋白表达与ESCC患者的年龄、性别、肿瘤部位、T状态及远处转移状态均无相关性。EZH2和H3K27me3蛋白均与ESCC患者的组织学分级及淋巴结转移状态呈正相关关系。肿瘤的分化程度越差表明肿瘤的恶性程度越高,淋巴结转移是肿瘤进展过程中的重要事件,淋巴结转移预示着肿瘤的不良预后。因此,EZH2和H3K27me3蛋白在ESCC患者中的高表达可能为ESCC患者不良预后的标记。同时,EZH2表达阳性的ESCC患者五年总生存率明显低于EZH2表达阴性的患者,H3K27me3表达阳性的ESCC患者五年总生存率明显低于EZH2表达阴性的患者,EZH2和H3K27me3双阳性的ESCC患者五年总生存率明显低于EZH2和H3K27me3单阳性和双阴性的ESCC患者。多因素Cox回归分析结果显示,淋巴结转移、组织学分级、EZH2表达和H3K27me3表达是ESCC患者的独立预后因素。以上结果均提示,EZH2和H3K27me3蛋白的高表达与ESCC患者的不良预后相关。研究结果还显示,EZH2和H3K27me3在ESCC组织中的表达存在正相关关系,从组织学角度验证了EZH2和H3K27me3之间的调控关系。
总之,EZH2和H3K27me3在ESCC组织中高表达,且与ESCC患者的组织学分级及淋巴结转移状态呈正相关关系,提示EZH2对H3K27的甲基化调控在ESCC患者的发生发展中起重要作用,有可能成为ESCC治疗的靶点。
| [1] | Cardoso C, Mignon C, Hetet G, et al. The human EZH2 gene: genomic organisation and revised mapping in 7q35 within the critical region for malignant myeloid disorders[J]. Eur J Hum Genet, 2000, 8(3): 174-80. |
| [2] | Viréd E, Brenner C, Deplus R, et al. The Polycomb group protein EZH2 directly controls DNA methylation[J]. Nature, 2006, 439(7078): 871-4. |
| [3] | Cao R, Wang L, Wang H, et al. Role of histone H3 lysine 27 methylation in polycomb-group silencing[J]. Science, 2002, 298(5595): 1039-43. |
| [4] | Studo T, Utsunomiya T, Mimori K, et al. Clinicopathological significance of EZH2 mRNA expression in patients with hepatocellular carcinoma[J]. Br J Cancer, 2005, 92(9): 1754-8. |
| [5] | Sasaki M, Ikeda H, Itatsu K, et al. The overexpression of polycomb group proteins Bmi1 and EZH2 is associated with the progression and aggressive biological behavior of hepatocellular carcinoma[J]. Lab Invest, 2008, 88(8): 873-82. |
| [6] | Bryant RJ, Cross NA, Eaton CL, et al. EZH2 promotes proliferation and invasiveness of prostate cancer cells[J]. Prostate, 2007, 67(5): 547-56. |
| [7] | Debeb BG, Gong Y, Atkinson RL, et al. EZH2 Expression correlates with locoregional recurrence after radiation in inflammatory breast cancer[J]. J Exp Clin Cancer Res, 2014, 33: 58. |
| [8] | Liu Y, Liu T, Bao X, et al. Increased EZH2 expression is associated with proliferation and progression of cervical cancer and indicates a poor prognosis[J]. Int J Gynecol Pathol, 2014, 33(3): 218-24. |
| [9] | Yoo KH, Hennighausen L. EZH2 Methylation and H3K27 methylation in breast cancer[J]. Int J Biol Sci, 2012, 8(1): 59-65. |
| [10] | Ma R, Wei Y, Huang X, et al. Inhibition of GSK3β activity is associated with excessive EZH2 expression and enhanced tumor invasion in nasopharyngeal carcinoma[J]. PLoS One, 2013, 8(7): e68614. |
| [11] | Eskander RN, Ji T, Huynh B, et al. Inhibition of enhancer of zeste homolog 2 (EZH2) expression is associated with decreased tumor cell proliferation, migration, and invasion in endometrial cancer cell lines[J]. Int J Gynecol Cancer, 2013, 23(6): 997-1005. |
| [12] | Cai MY, Hou JH, Rao HL, et al. High expression of H3K27me3 in human hepatocellular carcinomas correlates closely with vascular invasion and predicts worse prognosis in patients[J]. Mol Med, 2011, 17(1-2): 12-20. |
| [13] | Ngollo M, Lebert A, Dagdemir A, et al. The association between Histone 3 Lysine 27 Trimethylation (H3K27me3) and prostate cancer: relationship with clinicopathological parameters [J]. BMC Cancer, 2014, 14: 994. |
| [14] | Benard A, Goossens-Beumer IJ, van Hoesel AQ, et al. Prognostic value of polycomb proteins EZH2, BMI1 and SUZ12 and histone modification H3K27me3 in colorectal cancer[J]. PLoS One, 2014, 9(9): e108265. |
| [15] | Cai MY, Tong ZT, Zhu W, et al. H3K27me3 protein is a promising predictive biomarker of patients’ survival and chemoradioresistance in human nasopharyngeal carcinoma[J]. Mol Med, 2011, 17(11-12): 1137-45. |
| [16] | He LJ, Cai MY, Xu GL, et al. Prognostic significance of overexpression of EZH2 and H3K27me3 proteins in gastric cancer [J]. Asian Pac J Cancer Prev, 2012, 13(7): 3173-8. |
 2016, Vol. 43
2016, Vol. 43


