文章信息
- 杨向东,杨文华,刘宝山,伊学军,高宏,姚芳,王兴丽,闫理想.
- YANG Xiangdong, YANG Wenhua, LIU Baoshan, YI Xuejun, GAO Hong, YAO Fang, WANG Xingli, YAN Lixiang.
- 蝎毒多肽提取物对白血病细胞株K562/A02荷瘤鼠耐药性的影响
- Reversion Impact of Peptide Extract from Scorpion Venom on Multidrug-resistance of Leukemia Stem Cell Line K562/A02 in vivo
- 肿瘤防治研究, 2016, 43(03): 181-187
- Cancer Research on Prevention and Treatment, 2016, 43(03): 181-187
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.03.003
-
文章历史
- 收稿日期: 2015-05-19
- 修回日期: 2015-09-25
2. 300052 天津,天津医科大学总医院中医 科;
3. 300193 天津,天津中医药大学研究生院
2. Traditional Chinese Medicine Department, General Hospital Affiliated to Tianjin Medical University, Tianjin 300052, China;
3. Postgraduate School, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
白血病细胞对化疗药物产生多药耐药(multidrug resistance,MDR)现象是急性白血病(acute leukemia,AL)化疗失败及复发的主要原因之一[1]。
白血病细胞MDR的根源是白血病干细胞(leukemic stem cells,LSC)MDR使LSC残留在患者体内[2]。MDR的LSC通常会发生几种改变:细胞膜ATP结合盒式蛋白(ATP-binding cassette,ABC)家族中ABCB1编码的P-糖蛋白(P-glycoprotein,P-gp)和ABCG2编码的乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)表达上调[3],外排进入细胞内化疗药物;细胞质中磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)激活下游核转录因子(nuclear factor,NF-κB)启动多药耐药基因(multidrug resistance 1,MDR1)[4]和乙醛脱氢酶(aldehyde dehydrogenase1,ALDH1)氧化胞质中醛类物质如环磷酰胺(CTX)的中间代谢产物醛磷酰胺等水解化疗药物活性基团[5];细胞核内NF-κB和MDR1过度表达介导白血病LSC的MDR细胞信号通路;LSC在细胞膜、细胞质和细胞核中各种分子的改变帮助其实现MDR。课题组前期研究发现蝎毒多肽(peptide extract from scorpion venom,PESV)可以通过上调柔红霉素(DNR)损伤细胞的PTEN基因、tie-2基因表达改变KG1α干细胞凋亡与分化[6],也有研究表明PTEN基因上调Bax等多种信号分子,逆转K562/ADM细胞的MDR现象[7],这提示PESV有逆转白血病细胞耐药的可能。所以,拟采用经典髓系白血病MDR的K562/A02细胞株[8]成模白血病BALB/c裸鼠为例,探讨PESV在体内逆转白血病干细胞MDR作用的分子机制。
1 材料与方法 1.1 白血病细胞株耐阿霉素(adriamycin,ADM)K562/A02细胞株由中国医学科学院血液病研究所提供。
1.2 实验动物BALB/c裸小鼠,雌性,6~7周龄,体质量18~22 g,共计40只,购自北京华阜康动物公司[SCXK(京)2014-0004],在SPF级环境下饲养,采用滤膜饲养笼,裸鼠所需饲料、饮水及其他物品均高压灭菌。
1.3 实验药物采用电刺激东亚蝎尾采集新鲜毒液,经高速离心分离,真空干燥制成蝎毒干粉,-20℃保存。从蝎毒冻干粉按文献[9]提取蝎毒多肽,含50~60氨基酸的多肤混合物,分子量6 000~7 000,纯度89.1%,耐热,pH稳定,使用前用0.9%氯化钠溶液溶解稀释到所需浓度。
1.4 实验试剂RPMI 1640培养液(HyClone公司);10%胎牛血清(Gibco公司);CCK-8试剂盒(索罗门生物科技有限公司);CD34 Micro Bead Kit-Human(Miltenyi Biotec公司,130046702);CD38 Micro Bead Kit-Human(Miltenyi Biotec公司,130046702);MACS分选架及LD、MS柱(Miltenyi Biotec公司);P-gp抗体试剂盒(美国BD公司);Anti-ALDH1 antibody试剂盒(英国Abcam公司);Elisa检测试剂盒(美国BD公司);Western blot检测试剂盒(北京世纪康为公司);RT-PCR试剂盒 ( 北京康为世纪公司),MDR1基因引物序列[10]:上游引物:5’-CCCATCATTGCAATAGCAGG-3’,下游引物:5’-GTTCAAACTTCTGCTCCTGA-3’;BCRP基因引物序列[11]:上游引物:5’-ATTGAAGGCAAAGGCAGATG-3’,下游引物:5’-TGAGTCCTGGGCAGAAGTTT-3’;内参照β-actin引物序列:上游引物:5’-TGA CGG GGT CAC CCA CAC TGTGCC CAT CTA-3’,下游引物:5’-CTA GAA GCA TTTGCG GTG GAC GATGGAGGG-3’。
1.5 实验方法 1.5.1 细胞培养常规复苏液氮冻存K562/A02细胞,置于含15%胎牛血清的RPMI 1640(100 u/ml青霉素和100 mg/ml链霉素)培养液中常规培养,每3~4天传代1次。培养条件:5%CO2、37℃恒温培养箱。
1.5.2 K562/A02干细胞分选采用免疫磁珠法分选K562/A02干细胞,收集1×108个对数生长期的K562/A02细胞,严格按照 MACS磁珠分选说明书进行,经流式细胞仪分析样本中1×104个细胞中的阳性细胞数,鉴定后实验备用。
1.5.3 CCK-8检测细胞增殖活性收集K562/A02细胞稀释至16×104个/毫升。按0、500、1 000、2 000、4 000、8 000、16 000、32 000细胞数梯度接种于96孔板(A~H,1~3),每孔最终体积200 μl。每梯度设3个平行孔。收集K562/A02细胞稀释至4×104个/毫升,每孔100 μl接种于96孔板(B~G,4~8)。将ADM(10 mg)稀释至 4 80 μg/ml,按0、15、30、60、120、240 mg浓度分别加入96孔K562/A02细胞中(B~G,4~8),每孔终液200 μl,每梯度设5个平行孔。取200 μl PBS加入边缘孔作为对照。培养72 h,每孔加入 8 μl CCK8溶液,再孵育1 h,用酶标仪测定在450 nm处的吸光度值(OD值)及计算细胞IC50。
1.5.4 K562/A02干细胞植入BALB/c成模及分组给药实验预先选取5只BALB/c小鼠,经皮下注射K562/A02干细胞,每次间隔3天,每次注射0.2 ml(5×107个/毫升),形成皮下瘤块备用。再将30只雌性BALB/c小鼠给予裸鼠直线加速器3 Gy全身照射后,经包埋穿刺针接种0.2 cm×0.2 cm大小瘤块1处。成模裸鼠随机分为6组:对照组、ADM组、PESV组、ADM+PESV(H)组、ADM+PESV(M)组、ADM+PESV(L)组。对照组予0.9%氯化钠溶液腹腔注射,其余各组予腹腔注射ADM和(或)PESV。ADM 1 mg/kg[按成人每天40 mg/m2换算],腹腔注射0.05 mg隔天1次(第1、3、5、7、9、11、13天),PESV按高、中、低(5、1、0.2 μg)剂量腹腔注射给药14天,PESV组PESV剂量同中剂量组给药。第21天颈推脱臼处死小鼠。
1.5.5 流式细胞术检测P-gp剪取1 g中心部位的瘤组织,PBS(0.01 mol/L,pH7.0~7.2)冲洗3次,同组标本混合。将组织充分剪碎,加入100 μl胶原酶消化(37℃、30 min),过滤。加1 ml PBS,混匀,过滤,离心洗涤2遍(2000 r/min,5 min),计数。取1×106细胞,加入5 μl FITC M-H P-gp抗体,避光,4℃,孵育30 min。加 1 ml PBS洗涤(2000 r/min,5 min),上机检测。
1.5.6 RT-PCR检测MDR1mRNA表达
剪取1 g中心部位的瘤组织,PBS(0.01 mol/L,pH7.0~7.2)冲洗3次,同组标本混合。用TRIzol法提取移植瘤总RNA,反转录成cDNA。将cDNA模板用去离子水稀释5~10倍后用于Real-time PCR,反应体系50 μl(PCR MasterMix 25 μl、Forward Primer 2 μl、Reverse Primer 2 μl、Template cDNA 1 μl、PCR Enhancer 10 μl、RNase-Free Water up to 10 μl);反应条件为95℃预变性5 min;95℃变性30 s,60℃退火30 s,72℃延伸30 s,40个循环;72℃终延伸 5 min。设β-actin为管家基因,同时检测。本次半定量RT-PCR检测结果比较时,设2-△△Ct测定值≥5为高表达标准。
1.5.7 免疫组织化学法检测ALDH1用10%甲醛固定瘤块,常规脱水、浸蜡、包埋,切片6 μm、贴片置入65℃恒温箱内烤片20 min,HE染色;免疫组织化学染色:脱蜡、水化,抗原修复液(配制:柠檬酸三钠3 g、柠檬酸0.4 g、加蒸馏水1 L)行抗原修复,3%H2O2室温10 min灭活内源性过氧化氢酶,5%BSA液封闭 30 min,Anti-ALDH1 antibody一抗4℃隔夜孵育,山羊抗兔二抗染色,DAB染液显色反应,苏木精对比染色3 min,中性树胶封片,显微镜下观察染色结果,照相。
1.5.8 Western blot检测PI3K蛋白剪取1 g中心部位的瘤组织,PBS(0.01 mol/L,pH7.0~7.2)冲洗3次,同组标本混合,加1 ml液氮研磨,200 μl蛋白裂解液,吹打混匀,4℃摇晃震荡10 min,冰上裂解30 min。4℃,12 000 r/min,离心30 min,取上清液总蛋白,采用BCA方法测蛋白浓度,样本煮沸5 min使变性,冰上冷却后10 000 r/min离心30 s,取上清液进行SDS-PAGE,然后转移蛋白至PVDF(100 V,1 h),0.5%脱脂牛奶室温封闭PVDF膜1 h,分别加入一抗40℃孵育过夜,0.1% TBST洗膜3次,室温孵育加入二抗1 h ,TBST洗膜3次,加ECL发光剂后显影。
1.5.9 ELISA法检测NF-κB含量剪取1 g中心部位的瘤组织,PBS(0.01 mol/L,pH7.0~7.2)冲洗3次,同组标本混合,加入5~10 ml预冷研磨,5 000 g离心5 min,取上清液。将标准品稀释为10 ng/ml (标准曲线最高浓度)后,再依次倍比稀释成10、5、2.5、1.25、0.625、0.312、0.156、0 ng/ml。酶标板分别设标准孔、待测样品孔、空白孔,标准孔7孔,依次加入100 μl不同浓度的标准品,空白孔加100 μl,余孔加待测样品100 μl,覆膜,37℃温育2 h。弃液,甩干,加试剂盒中A液,覆膜,温育1 h。弃液浸泡,洗板3次,1~2 min,覆膜,温育30 min,加试剂盒中B液,覆膜,温育30 min,弃液,加底物溶液90 μl,避光显色,弃液,加终止溶液50 μl终止反应,用酶标仪在450 nm波长测量各孔的吸光度(OD值)。
1.6 统计学方法采用SPSS16.0统计软件进行分析,计量资料用均数±标准差(x±s)表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果 2.1 K562/A02干细胞耐药性对数生长期K562/A02细胞,在免疫磁珠分选前经流式细胞仪检测CD34+CD38-细胞占31.5%,见图 1A,CCK-8法检测耐药率得到IC50值为(60.33±10.68)μg/ml,经免疫磁珠分选后检测CD34+CD38-细胞占分选后细胞的92.8%,见图 1B,IC50值为(58.33±9.72)μg/ml,分选后K562/A02细胞干性显著性提高,而耐药性无差异性损失,适合以下动物实验。

|
| 图 1 K562/A02细胞分选前后CD34+CD38-细胞比率 Figure 1 CD34+CD38- K562/A02 cell ratio before and after selection |
BALB/c裸鼠皮下包埋K562/A02瘤块后7天,100%出现不同程度成模表现:消瘦、弓背症状、皮下包块存在,见图 2A。按照瘤体大小随机分组实验。各组小鼠给药14天,未出现死亡,顺利完成实验,期间观测瘤组织大小,见图 2D。外周血常规变化情况,见表 1。

|
|
A: blank group and control group; B: control group tumors; C: tumors
HE(20×); D: tumor volume growth curve Tumor volume calculation formula: V=lw2/2 (l: longest diameter, w: shortest diameter) 图 2 成模裸鼠、瘤体情况及肿瘤体积曲线 Figure 2 Model mice, tumors and tumor volume growth curves |
BALB/c荷瘤裸鼠在ADM药物刺激作用下瘤块细胞P-gp表达由89.8%轻度上调至91.9%,在PESV刺激作用下无明显改变88.4%;在ADM与PESV联合作用下P-gp表达下调,ADM+PESV(H)组53.9%、ADM+PESV(M)组78.7%、ADM+PESV(L)组78.0%,呈现对PESV浓度依赖关系,见图 3。

|
| A: FACS detection figure of P-gp expression quantity among groups; B: P-gp expression of each group; ADM: adriamycin; PESV: polypeptide extract from scorpion venom 图 3 BALB/c裸鼠瘤块中LSC细胞膜上P-gp的表达比率 Figure 3 P-gp expression ratio on LSC cytomembrane of tumor blocks in BALB/c nude mice |
经IHCA检测裸鼠移植瘤组织中ALDH1结果显示,对照组与ADM组、PESV组相比,ALDH1阳性表达率无明显差异,ALDH1阳性表达在ADM+PESV(H/M/L)3组中逐渐减少,ADM+PESV(H)组<ADM+PESV(M)组<ADM+PESV(L)组,与PESV剂量相关,见图 4。

|
| A: control group; B: ADM group; C: PESV group; D: ADM+PESV(H) group; E: ADM+PESV(M) group; F: ADM+PESV(L) group 图 4 各组移植瘤免疫组织化学检测结果比较 (HE ×20) Figure 4 Comparison of immumohistochemical condition of transplanted tumor among groups (HE ×20) |
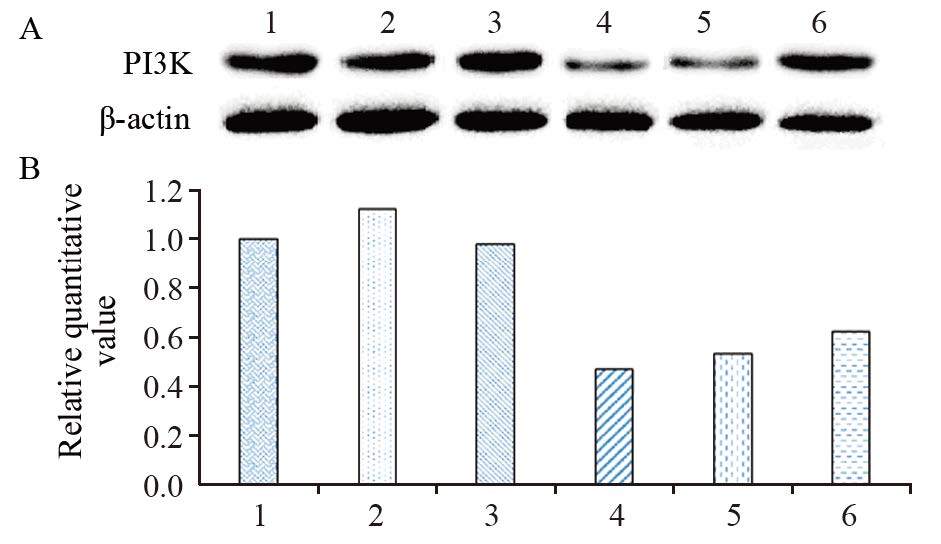
PI3K蛋白在ADM组、PESV组表达上调,在ADM+PESV组中表达下调,下调强度从高到低依次:ADM+PESV(H)组>ADM+PESV(M)组>ADM+PESV(L)组,见图 5。
|
| A: PI3K protein analysed by Western blot; B: histogram of PI3K protein relative expression; PI3K: phosphoinositide 3-kinase. 1: control group; 2: ADM group; 3: PESV group; 4: ADM+PESV(H) group; 5: ADM+PESV(M) group; 6: ADM+PESV(L) group 图 5 Western blot分析BALB/c小鼠瘤块K562/ADM细胞 PI3K水平 Figure 5 PI3K expression level in K562/ADM cells in tumor blocks of BALB/c mice analysed by Western blot |
标准曲线:使用专业制作曲线软件Curve expert 1.30进行分析,以标准品的浓度为纵坐标,OD值为横坐标,依据回归方程R2值绘出标准曲线。用标准物的浓度与OD值计算出标准曲线的回归方程式,将样品的OD值代入方程式,计算出样品浓度。R2=0.9996,绘制标准曲线,见图 6A。NF-κB值:对照组6.438 ng/ml,ADM组7.139,PESV组8.866,ADM+PESV(H)组5.876,ADM+PESV(M)组6.594,ADM+PESV(L)组7.159,见图 6B。

|
| A: typical standard curve of NF-κB; B: comparison of NF-κB expression quantity among groups 图 6 NF-κB标准曲线及各组中NF-κB浓度比较 Figure 6 Standard curve of NF-κB and comparison of NF-κB concentrations among groups |
测得K562/A02干细胞的MDR1 mRNA基因表达量PESV组>ADM+PESV(L)组>ADM+PESV(M)组>ADM+PESV(H)组>ADM组,其中PESV组、中剂量组、低剂量组高表达,见表 2。
 |
LSC产生MDR阻碍了化疗治愈白血病,尽管一些MDR机制已经提出,但MDR机制极其复杂,是肿瘤细胞对化学药物攻击的重要防御机制。
LSC依靠细胞膜ABC超家族中P-gp药物泵降低细胞内化疗药物浓度,P-gp是Biedler等于1976年在研究CHO细胞时发现的,在多药耐药细胞的细胞膜上存在一种分子量为1.7×105道尔顿,整个分子由几乎完全相同的两个亚基构成,每部分具有6个跨膜区和一个ATP结合位点,P-gp位于细胞膜和细胞质的高尔基体,两者是P-gp转运药物的重要场所[12]。
LSC在细胞质中表达的ALDH1是一种解毒细胞溶质酶,能氧化细胞内的乙醛变成乙酸,包括视黄醇转变成视黄酸,视黄酸具有调节细胞增殖和分化的功能,并能维系不同干细胞的表型[13]。ALDH1位于9q21染色体,由53×103个碱基对组成,含13个外显子,共编码501个氨基酸,无重复序列,N端为蛋氨酸(Met),有1个谷氨酸(Glu)和1个半肤氨酸(Cys)激活点,其基因启动区含1个ATA盒和1个CCAAT盒,分别位于转录起始部位上游的32 bp和74 bp处[14]。研究证实ALDH1与恶性肿瘤的耐药性相关[15],它能氧化环磷酞胺的中间代谢产物醛磷酞胺,形成无毒的梭基磷酞胺,从而发挥对环磷酞胺的解毒作用。
此外,LSC形成MDR的PI3K/NF-κb/MDR1信号通路激活细胞核内MDR1基因,MDR1 cDNA位于人类7号染色体的q21.1带上,编码4.5~5.0 kb mRNA,长4 669 bp,其第179~3 840 bp为可读区,起始密码为ATG,共编码1 280个氨基酸残基,经折叠修饰后形成定位于细胞质和高尔基体的P-gp[16]。白血病细胞表面的酪氨酸蛋白激酶受体(receptor tyrosine kinases,RTK)通过接收胞外多种生长因子如胰岛素(Insulin)、成纤维细胞生长因子(FGF)、人生长因子(HGF)、血管内皮生长因子(VEGF)等配体信号刺激而被激活,激活的RTK通过PI3K将信号转递到细胞内激活AKT。AKT属于PI3K重要的下游分子,激活IκB激酶(IKKα)进而导致NF-κB的抑制剂IκB的降解,使NF-κB从细胞质中释放出来进行核转位,NF-κB与MDR1基因启动子结合,MDR1的DNA完成mRNA转录。这样,LSC贯穿细胞膜、细胞质及细胞核的MDR机制体系形成。
PESV是蝎毒多肽提取物的简称,是由蝎毒冻干粉经葡聚糖凝胶,收集蝎毒Ⅲ~Ⅳ蛋白峰,再进行阳离子交换层析而成。PESV组份Ⅲ通过下调bcl-2基因和激活Caspase-3途径促进人肝癌细胞株Hep G2的凋亡[17],PESV组份Ⅳ作用及机理尚未明确。本次实验中发现PESV和ADM都能够独立激活LSC细胞膜、细胞质及细胞核的MDR机制体系,ADM组、PESV组与对照组相比MDR1 mRNA高表达,P-gp、ALDH、PI3K同样出现差异性升高;但是,当PESV和ADM联合应用时LSC却未表现出MDR体系作用的增强,相反随着PESV剂量增加MDR体系作用在减弱,ADM+PESV(H)组、ADM+PESV(M)组、ADM+PESV(L)组相比ADM组、PESV组出现信号通路中PI3K蛋白、NF-κB因子表达开始下调,P-gp、ALDH、MDR1的表达水平显著性下调,与PESV剂量呈正相关;以上结果证实了LSC在ADM损伤后PESV对其MDR的逆转作用显著性增强,PESV可以提高白血病细胞对ADM的敏感度,这与大黄蛰虫丸含药血清[18]和植物雌激素毛蕊异黄酮[19]的研究结果相一致。然而LSC的MDR除细胞膜、细胞质及细胞核的分子改变外,还与LSC在龛内迁移、活化、G0期变化等方面细节尚需进一步研究探讨。
| [1] | Mattern J, Volm M. Multiple pathway drug-resistance(review)[J].Int J Oncol, 1993, 2(4): 557-61. |
| [2] | Wang CH, Chen YX. Advances of drug resistance mechanism in leukemic stem cell[J]. Fen Zi Zhen Duan Yu Zhi Liao Za Zhi, 2009, 1(3): 203-6. [王春淮, 陈运贤. 白血病干细胞的耐药机制研究[J]. 分子诊断与治疗杂志, 2009, 1(3): 203-6.] |
| [3] | Ross DD, Doyle LA. Mining our ABCs: pharmacogenomic approach for evaluating transporter function in cancer drug resistance[J]. Cancer Cell, 2004, 6(2): 105-7. |
| [4] | Osaki M, O shinura M, Ito H. P13K-Akt pathway: its functions and alterations in human cancer[J]. Apoptosis, 2004, 9(6): 667-76. |
| [5] | Morimoto K, Kim SJ, Tanei T, et al. Stem cell marker alde hydedehydrogenate 1-positive breast cancers are characterized by negative estrogen receptor, positive human epidermal growth factor receptor type 2, and high Ki67 expres-sion[J]. Cancer Sci, 2009, 100(6): 1062-8. |
| [6] | Yang XD, Li HY, Li DG, et al. Scorpion venom peptide effects on leukemia cell lines KG1a stem cell activity[J]. Zhonghua Zhong Yi Yao Za Zhi, 2015, 30(4): 1278-81. [杨向东, 李红玉, 李德冠, 等. 蝎毒多肽对白血病细胞株KG1a干细胞活性的影响[J]. 中华中医药杂志, 2015, 30(4): 1278-81.] |
| [7] | Cheng ZY, Li L, Wang YL, et al. Role of PTEN gene in multidrug resistance reversal in leukemia cells[J]. Di Er Jun Yi Da Xue Xue Bao, 2013, 34(2): 142-7. [成志勇, 李琳, 王亚丽, 等. PTEN基因逆转白血病多因素多药耐药机制探讨[J]. 第二军医大学学报, 2013, 34(2): 142-7.] |
| [8] | Luan FJ, Yang CZ, Ma JG, et al. One person multi-resistant red leukemia cell line (K562/A02) set up and its drug resistance characteristics of the study[J]. Zhonghua Zhong Liu Za Zhi, 1993, 15(2): 101-3. [栾凤君, 杨纯正, 马建国, 等. 一株人红白血病多药耐药细胞系(K562/A02)的建立及其耐药特性的研究[J]. 中华肿瘤杂志, 1993, 15(2): 101-3.] |
| [9] | Hao Z, Yang WH. Scorpion venom skin more outside intervention of acute leukaemia marrow infiltration mechanism of the change [J]. Zhonghua Zhong Yi Yao Za Zhi, 2012, 27(4): 1106-8. [郝征,杨文华. 蝎毒多肽干预急性白血病髓外浸润传变的机制[J]. 中华中医药杂志, 2012, 27(4): 1106-8.] |
| [10] | Xu Y, Zhi F, Xu G, et al. Overcoming multidrug-resistance in vitro and in vivo using the novel P-glycoprotein inhibitor 1416[J]. Biosci Rep, 2012, 32(2): 559-66. |
| [11] | Huang FF, Zhang L, Wu DS, et al. PTEN regulates BCRP/ABCG2 and the Side population through the PI3K/Akt pathway in chronic myeloid leukemia[J]. PLoS One, 2014, 9(3): e88298. |
| [12] | Tian K, Wang Y, Huang Y. Methylation of WTH3, a possible drug resistant gene,inhibits p53 regulated expression[J]. BMC Cancer, 2008, 8: 327. |
| [13] | Adam SA, Schnell O, Pöschl J, et al. ALDH1A1 is a marker of astrocytic differentiation during brain development and correlates with better survival in glioblastoma patients[J]. Brain Pathol, 2012, 22(6): 788-97. |
| [14] | Moore SM, Liang T, Graves TJ, et al. ldentification of a novel cytosolic aldehyde dehydrogenase allele, ALDH1A1*4[J]. Hum Genomics, 2009, 3(4): 304-7. |
| [15] | Yang XW, Chen ZX, Wang W, et al. Mediated gene transfer ring phthalic aldehyde dehydrogenase amine tolerance research[J].Zhonghua Nei Ke Za Zhi, 2002, 41(8): 552-3. [阳小卫, 陈子兴,王玮, 等. 醛脱氢酶基因转移介导的环磷酞胺耐受性研究[J]. 中华内科杂志, 2002, 41(8): 552-3.] |
| [16] | Perrin L, Gatouillat G, Balasse E, et al. lnduction of autoantibodies to murine P-glycoprotein: consequences on drug sensitivity in MDR cancer cells and on the expression of MDR genes[J].Biochem Biophys Res Commun, 2007, 358(1): 325-30. |
| [17] | Li JW, Hu J, Zhang GR, et al. east Asia buthus scorpion venom peptide composition Ⅲ effect on liver cancer cell apoptosis[J]. Jilin Da Xue Xue Bao, 2006, 32(4): 625-7,745. [李建伟, 胡静, 张桂荣, 等. 东亚钳蝎蝎毒多肽组分Ⅲ对肝癌细胞凋亡的影响[J]. 吉林大学学报, 2006, 32(4): 625-7,745.] |
| [18] | Qin BN, Teng WJ, Liu RJ, et al. Rhubarb sting worm pill on chronic myelogenous leukemia K562 cell proliferation, apoptosis and PI3K/AKT signaling pathways[J]. Shizhen Guo Yi Guo Yao, 2015, 26(3): 522-5. [秦宝宁, 滕文静, 刘瑞娟, 等. 大黄蛰虫丸对慢性粒细胞白血病K562细胞增殖凋亡及PI3K/AKT信号传导通路的影响[J]. 时珍国医国药, 2015, 26(3): 522-5.] |
| [19] | Xin M, Chen J, Guo YH. Calycosin separately for bladder cancer cell apoptosis and the influence of PI3K/Akt signal pathway[J]. Guangdong Yi Xue, 2015, 36(5): 690-3. [辛敏, 陈健, 郭艳红. 毛蕊异黄酮对膀胱癌细胞凋亡和PI3K/Akt信号通路的影响[J]. 广东医学, 2015, 36(5): 690-3.] |
 2016, Vol. 43
2016, Vol. 43