文章信息
- 盛佳钰,时百玲,陈红风.
- SHENG Jiayu, SHI Bailing, CHEN Hongfeng.
- 三阴性乳腺癌MDA-MB-231顺铂耐药细胞株的建立及鉴定
- Establishment and Appraisal of DDP Resistant Variant of Triple Negative Breast Cancer Cell Line MDA-MB-231
- 肿瘤防治研究, 2016, 43(03): 175-180
- Cancer Research on Prevention and Treatment, 2016, 43(03): 175-180
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.03.002
-
文章历史
- 收稿日期: 2015-08-12
- 修回日期: 2015-11-27
乳腺癌是一种在分子水平上高度异质性的肿瘤,临床上将免疫组织化学检测的雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor2,HER2)表达均阴性者被称为三阴性乳腺癌(triple negative breast cancer,TNBC)。该亚型乳腺癌对内分泌治疗及抗HER2的靶向治疗均不敏感,化疗是其主要的治疗手段。近年来研究发现,TNBC这类与乳腺癌易感基因1(breast cancer susceptibility gene-1,BRCA1)相关的乳腺癌亚型对铂类药物表现出较高的敏感度[1]。然而,事实证明对化疗相对敏感的TNBC患者并不意味着拥有更高的生存率。与其他化疗药物一样,在临床应用过程中多数患者经铂类药物化疗缓解后,即会产生耐药性,使后续治疗效果受到严重影响。本实验以顺铂(cisplatin,DDP)为诱导药物,人三阴性乳腺癌细胞株MDA-MB-231为诱导对象,采用逐步增加剂量、间歇体外诱导的方法,建立稳定的人三阴性乳腺癌DDP耐药细胞株,为耐药逆转研究提供实验依据。
1 材料与方法 1.1 材料及试剂紫杉醇注射液购自海口市制药厂有限公司(批号:130403),5-氟尿嘧啶注射液购自旭东海普有限公司(批号:FA30814),注射用顺铂(冻干粉)购自齐鲁制药有限公司(批号:ZWA2A1305034A),注射用环磷酰胺购自江苏恒瑞医药股份有限公司(批号:130403)。L-15液体培养液、胎牛血清、胰酶、磷酸盐缓冲液(PBS)均为美国Gibco公司产品;四甲基噻唑蓝(methylthiazolyl tetrazolium,MTT)及DMSO均购自上海生工生物有限公司。TRIzol提取试剂盒、反转录试剂盒和实时荧光定量PCR试剂盒购自日本TaKaRa公司;实时荧光定量PCR所用引物均由宝生物工程(大连)有限公司合成;抗磷酸化Akt(phosphorate-Akt,p-Akt)、总Akt(total-Akt, t-Akt)、内参GAPDH(均为抗兔单克隆抗体)及其相应的二抗均购自美国Cell Signaling公司。
1.2 方法 1.2.1 细胞培养人三阴性乳腺癌细胞株MDA-MB-231购自中国科学院上海细胞库,用含10%胎牛血清的L15培养液培养,培养液中加入100 u/L青霉素和10 mg/ml链霉素。置于37℃、5%CO2恒温培养箱中培养,次日观察细胞贴壁情况并换液。贴壁生长良好的乳腺癌细胞经0.25%胰蛋白酶消化,选用对数生长期细胞进行实验。
1.2.2 MDA-MB-231/DDP耐药细胞株建立采用逐步增加药物浓度,持续诱导法建立DDP耐药三阴性乳腺癌细胞株。取对数生长期MDA-MB-231细胞,换新鲜培养液,加入DDP,使其作用浓度为100 ng/ml,继续培养,适时换液,维持100 ng/ml药物浓度直至存活细胞能在此浓度稳定生长、传代;适当增加DDP的作用浓度后继续培养,适时换液,维持药物浓度直至存活细胞能在此浓度稳定生长、传代;每阶段DDP增加量控制在(200~500)ng/ml之间,经过7月获得一株稳定的耐药细胞株MDA-MB-231/DDP(DDP维持浓度为4 μg/ml),所有实验在停用DDP培养2周后取处于对数生长期的细胞进行。
1.2.3 生长曲线及倍增时间测定取对数生长中期、生长状态良好的MDA-MB-231和MDA-MB-231/DDP细胞,按2.5×103个每毫升接种在96孔板,1次/天,连续5天,采用锥虫兰染色法分别测定细胞生长情况,绘制细胞生长曲线;根据Patterson公式计算细胞在对数生长期的倍增时间(Td)。
1.2.4 细胞药物敏感度检测分别取对数生长期MDA-MB-231和MDA-MB-231/DDP细胞,调整细胞密度为5×104个每毫升,接种于96孔培养板中,100微升/孔。置恒温培养箱中培养24 h后,加药组更换为含不同浓度药物的完全培养液继续培养。每组都设6个复孔,并设置调零孔(只含相应培养液,无细胞)和对照孔(只含细胞、培养液)。待药物组作用24 h后,每孔加入MTT(5 mg/ml)15 μl,继续培养4 h,小心吸弃培养液和MTT溶液,每孔加入DMSO 150 μl,振荡10 min充分溶解显色。用全波长酶标仪测定吸光度值(A490),实验重复3次,取平均值,按下式计算细胞生长抑制率。生长抑制率(%)=(1-药物组A490/对照组A490)×100%,根据生长抑制率,采用SPSS16.0软件计算药物半数抑制浓度(IC50),并按下式计算耐药倍数(RF)。耐药倍数(RF)=耐药细胞IC50/亲本细胞IC50
1.3 高效液相色谱法检测细胞内顺铂质量浓度分别取对数生长期MDA-MB-231和MDA-MB-231/DDP细胞,分别以空白培养液及DDP浓度为6 μg/ml的含药培养液培养24 h后,消化收集各组细胞并计数,PBS冲洗3次后,加入双蒸水1 ml,液氮快速冷冻,37℃下迅速解冻后超声5 min(70 W),反复冻融超声3次,置显微镜下观察无完整细胞,14 000 r/min离心10 min,取上清液为细胞裂解液。
空白培养液培养MDA-MB-231和MDA-MB-231/DDP细胞获得的细胞裂解液1:1混合用于制备标准曲线,取一定浓度的顺铂标准品溶液50 μl加入950 ml细胞裂解液,配制成为含2、5、10、20、50和100 ng/ml顺铂的细胞裂解液作为标准曲线样品用于建立标准曲线。DDP浓度为6 μg/ml的含药培养液获得的两种细胞裂解液为实际待测样品。
取上述标准曲线样品和细胞裂解液各900 μl,加入内标液(37.5 ng/ml 氯化镍)和二乙基二硫代氨基甲酸钠(DDTC)溶液(0.25 mol/L)各50 μl,摇匀,37℃孵育30 min,放至室温后,加入500 μl氯仿,涡旋振荡1 min进行抽提,14 000 r/min离心5 min,下层溶液为衍生化后的待测样品。将此样品进样高效液相色谱(安捷伦1260型);色谱柱为Diamonsil C18(2)5u 150×4.6 mm,柱温25℃;检测波长为254 nm;流动相比例为水:甲醇:乙腈=25:40:35, 流速1 ml/min;进样量50 μl。以37.5 μg/ml氯化镍为内标,色谱峰面积对DDP的质量浓度进行线性回归,其线性回归曲线为Y= 4814.1X - 1.9217(R2=1,n=5)。
1.4 耐药相关基因检测采用TRIzol法提取MDA-MB-231及MDA-MB-231/DDP细胞的总RNA,分光光度法测定其纯度及浓度。按反转录试剂盒说明书将各组细胞总RNA反转录,生成cDNA,进一步用MDR1、BCRP、MMP7、GST-π引物及内参GAPDH引物扩增(引物相关信息见表 1)。 Real-time PCR结果由Rotor-Gene 6软件分析,确定各反应样本的Ct值,采用相对定量的2-ΔΔCt法计算目的基因的相对表达量,分析各样本之间基因的表达差异。
所有实验均平行重复3次,数据以(x±s)表示。应用SPSS16.0软件,两两比较采用单因素方差分析,检验水准α=0.05。
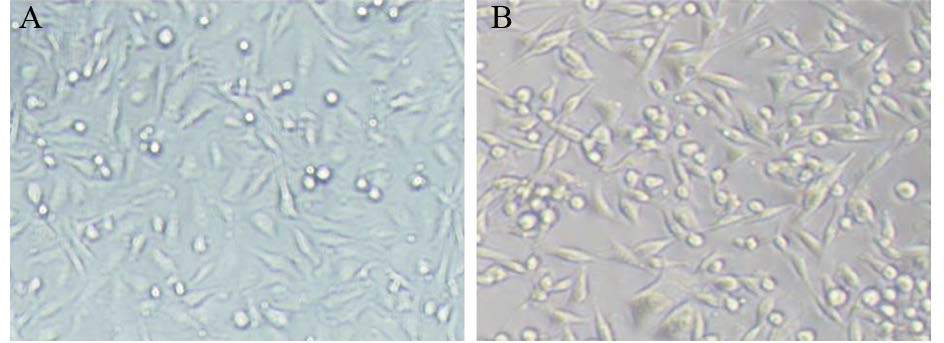
2 结果 2.1 形态学观察取对数生长期MDA-MB-231和 MDA-MB-231/DDP细胞各一瓶,换液后在倒置相差显微镜下观察活细胞形态并拍照。可见MDA-MB-231细胞呈多角形,形态较一致,细胞内结构均匀;MDA-MB-231/DDP细胞大小、形态均发生变化,细胞更细长,细胞内尤其是近胞膜处有较多深色物质聚集,见图 1。
|
| A: MDA-MD-231; B: MDA-MB-231/DDP 图 1 MDA-MB-231及MDA-MB-231/DDP细胞形态变化 (× 200) Figure 1 Morphologic change of MDA-MB-231 and MDAMB- 231/DDP cells (×200) |
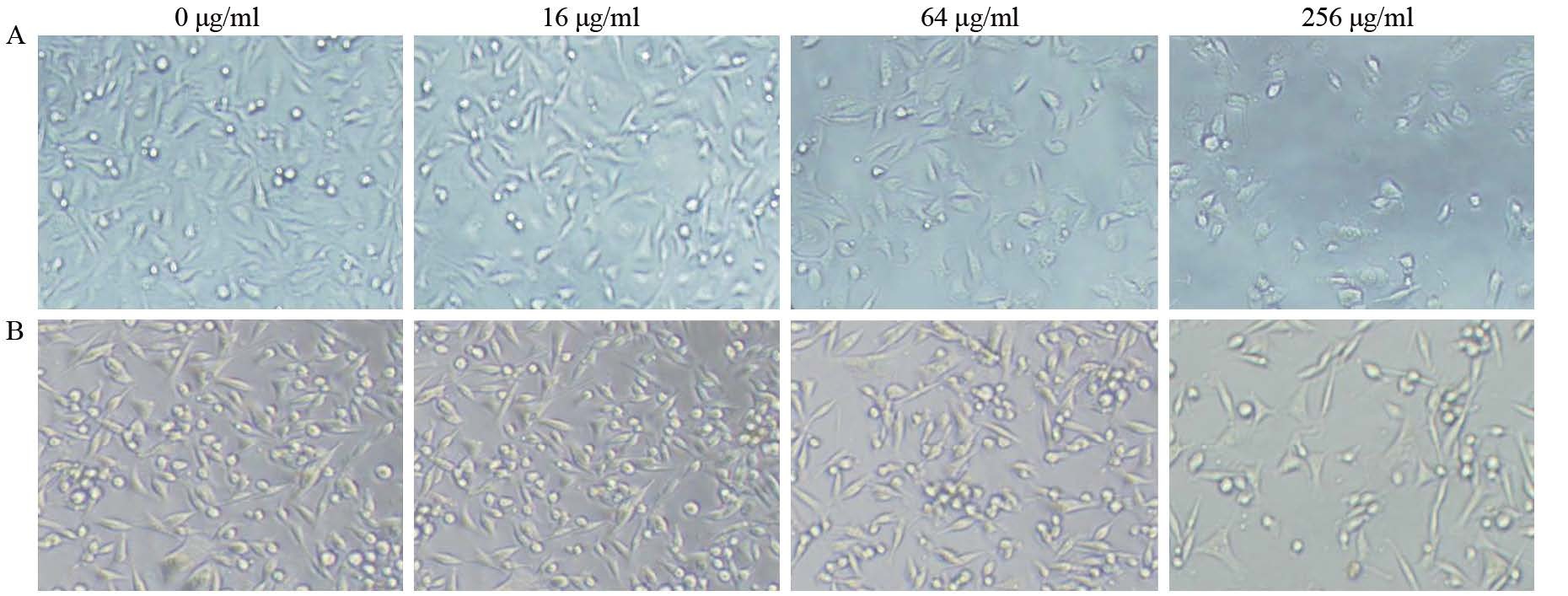
不同浓度DDP作用MDA-MB-231细胞及MDA-MB-231/DDP细胞24 h后,部分细胞胞体变圆、变小,部分细胞边界不清,胞质内颗粒粗大。随着DDP浓度的增高,细胞死亡增多,而MDA-MB-231/DDP细胞组细胞贴壁紧,形态规则,状态良好。相同浓度DDP作用下,MDA-MB-231细胞组的正常形态细胞数量更少,而变圆、变小细胞更多,见图 2。
|
| 图 2 不同浓度DDP干预24h后MDA-MB-231(A)及MDA-MB-231/DDP(B) 细胞形态变化 (×200) Figure 2 Effect of different concentration of DDP on morphologic change of MDA-MB-231(A) and MDA-MB-231/DDP(B) cells after 24h (×200) |
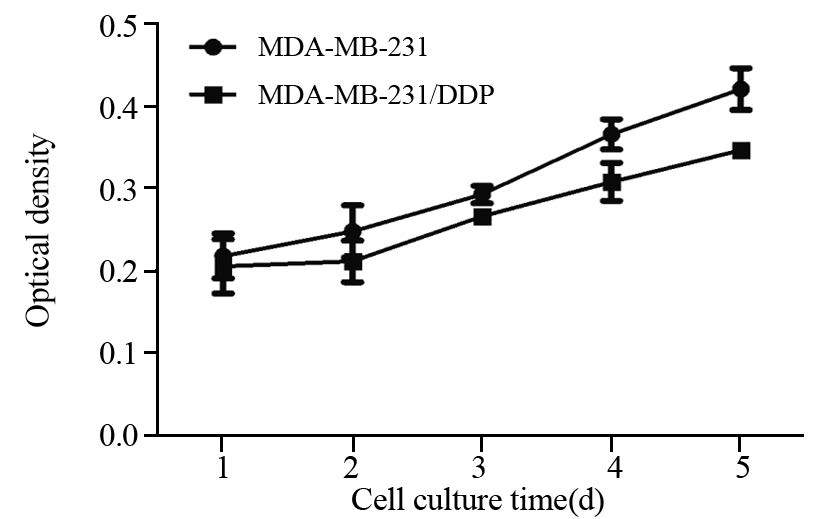
两种细胞在相同条件下培养5天,细胞增殖产生一定的差异。MDA-MB-231/DDP细胞的生长较MDA-MB-231细胞减慢,生长曲线的斜率减小,见图 3。同时,根据生长曲线计算出MDA-MB-231/DDP细胞株的细胞群体倍增时间为(159.14±3.31)h,明显长于MDA-MB-231亲本细胞株的(126.60±5.72)h,差异有统计学意义(P<0.05)。
|
| 图 3 MDA-MB-231与MDA-MB-231/DDP细胞生长曲线 Figure 3 Growth curves of MDA-MB-231 and MDAMB- 231/DDP cells |
MTT法检测MDA-MB-231和MDA-MB-231/DDP对DDP的IC50分别为17.72和173.70 μg/ml,MDA-MB-231/DDP细胞对DDP的耐药指数(resistance fold,RF)为9.80,见图 4。
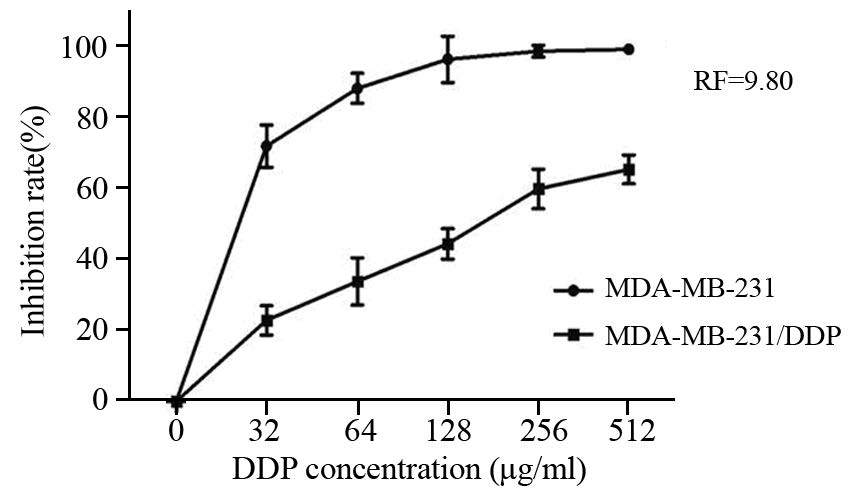
|
| 图 4 不同浓度的顺铂对MDA-MB-231及MDA-MB-231/ DDP增殖抑制率的影响 Figure 4 Effect of different concentration of DDP on proliferation inhibition rate of MDA-MB-231 and MDAMB- 231/DDP cells |
MDA-MB-231/DDP细胞对其他两种化疗药物的敏感度较MDA-MB-231细胞低,其对5-氟尿嘧啶及环磷酰胺的RF分别为4.43及2.21,见表 2,符合多药耐药细胞株构建标准。
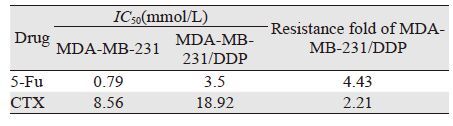 |
用HPLC法测定MDA-MB-231及MDA-MB-231/DDP细胞内DDP的浓度,两种细胞分别与6 μg/ml的DDP接触24 h后,MDA-MB-231细胞内DDP的浓度为(47.10±2.37)ng/(5×104)cells,而MDA-MB-231/DDP细胞则为(6.30±1.64)ng/(5×104)cells,两者差异具有统计学意义(P<0.01),见图 5。
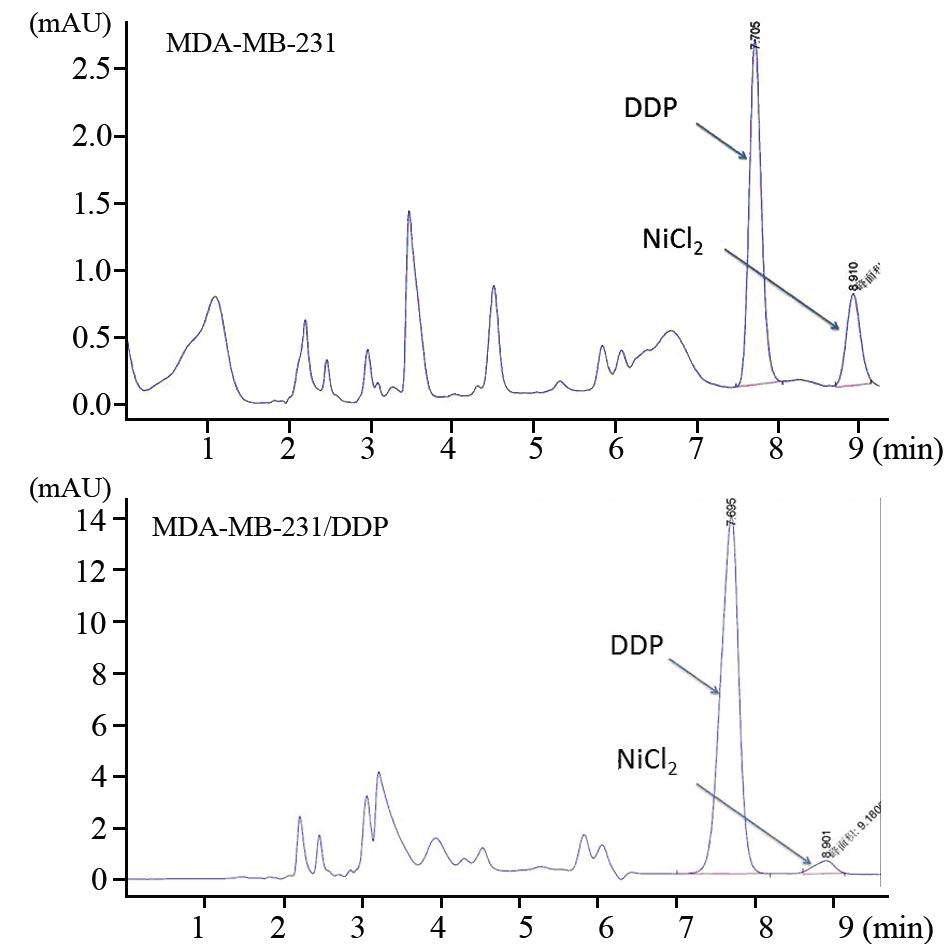
|
| 图 5 MDA-MB-231和MDA-MB-231/DDP细胞内顺铂浓度 Figure 5 Intracellular concentration of DDP in MDAMB- 231 and MDA-MB-231/DDP cells |
Real-time PCR检测结果显示,耐药细胞MDA-MB-231/DDP中MDR1、BCRP、MMP7及GST-π基因mRNA的表达量均高于MDA-MB-231组,差异有统计学意义(P<0.01),分别是MDA-MB-231细胞的15.39、13.73、22.52及44.90倍,见图 6。
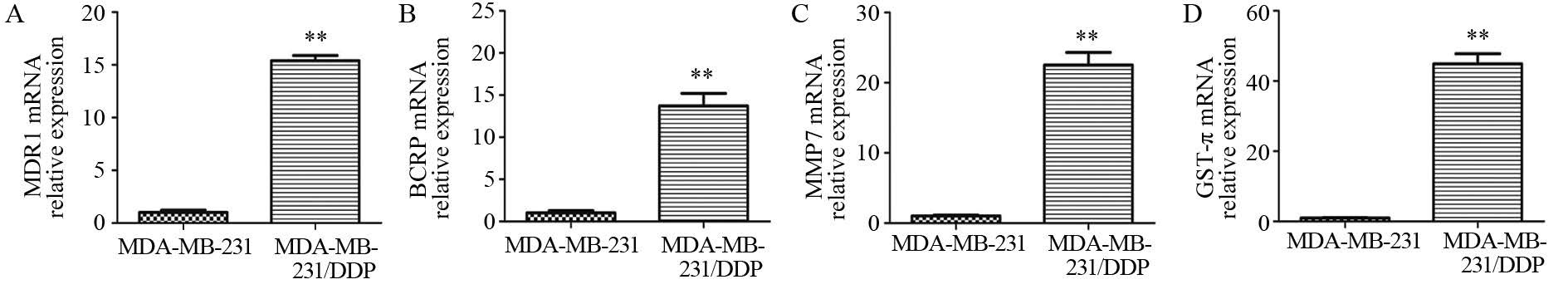
|
| **: P<0. 01, compared with MDA-MB-231cells 图 6 MDR1、BCRP、MMP7和GST-π的基因在MDA-MB-231和MDA-MB-231/DDP细胞中的表达 Figure 6 Expression of MDR1, BCRP, MMP7 and GST-π mRNA in MDA-MB-231 and MDA-MB-231/DDP cells |
顺氯氨铂(cisplatin,DDP),简称顺铂,其抗瘤谱广泛、活性高,且骨髓抑制等不良反应较轻[2],常被纳入联合方案应用于实体瘤的治疗,是第一个上市的铂类抗肿瘤药物。近年来研究发现,TNBC这类与BRCA1相关的乳腺癌亚型对铂类药物表现出较高的敏感度[1]。Silver等采用75 mg/m2剂量的DDP单药治疗TNBC患者,每3周一个周期,共4周期,临床的总有效率达50%,且病理完全缓解率和多药联合的疗效相似[3]。DDP的作用部位是DNA,它与DNA碱基产生链内及链间交叉连结,阻止DNA的转录和复制,从而抑制肿瘤细胞的分裂[4]。三阴性乳腺癌存在一定的DNA损伤修复障碍,因此该类型乳腺癌对铂类药物敏感度较高。临床研究也证明接受含铂方案新辅助及辅助化疗的乳腺癌患者的pCR和cCR在TNBC患者均显著高于非TNBC者。此外,由于在新辅助治疗和术后辅助治疗中广泛运用蒽环和紫杉类药物,使患者在疾病复发转移时常常对这两类药物产生了耐药,因此铂类药物成了三阴性乳腺癌术后复发、转移治疗的有效选择。DDP物美价廉,治疗效果好,但应用中却发现其容易产生耐药性,部分患者先天和后天对铂类药物具有耐药性[5],严重降低该药物的治疗效果,使其抗肿瘤谱降低,限制了该药物的临床使用。
近年来,肿瘤耐药细胞株已成为重要的研究工具,许多研究者利用它来揭示肿瘤细胞的耐药机制、研究肿瘤细胞的耐药性的逆转、开发及评价新的抗癌方法等,因此建立肿瘤耐药细胞株具有重要应用价值。MDA-MB-231细胞是乳腺癌细胞株,是从一名51岁的白人女性乳腺癌患者的胸水中分离建立的。经免疫组织化学鉴定该细胞株ER、PR、HER均为阴性,属于三阴性乳腺癌细胞株。该细胞株是目前研究乳腺癌,特别是三阴性乳腺癌十分常用的一种细胞株。国内外建立乳腺癌对阿霉素的耐药细胞株已经很常用,而针对三阴性乳腺癌的耐药细胞株仍较少见,特别是由DDP诱导的三阴性乳腺癌耐药细胞株未见报道。本实验是首次建立MDA-MB-231细胞对DDP的耐药细胞株,建立该细胞株能够为肿瘤耐药相关研究提供必要的研究模型,具有实用价值,其对DDP的耐药指数达到9.80,对环磷酰胺、5-氟尿嘧啶也有不同程度的耐药。
乳腺癌MDR的形成机制复杂,涉及多个因素、多个环节及多条途径,主要包括:(1)ATP结合盒(ATP-binding cassette,ABC)转运蛋白表达增加:这类通道蛋白共有7大类48个成员组成,其中与肿瘤多药耐药关系最为密切的是P-糖蛋白(P-gP)、乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)和多药耐药相关蛋白(multidrug resistance-associated protein,MRP)等[6]。ABC转运蛋白是一类ATP依赖的跨膜糖蛋白,它们位于细胞膜上,具有“外排泵”的作用,当其表达增加或活性增强时,可以将包括治疗药物在内的已进入细胞内的物质再次转运到细胞外,导致药物在细胞内的累积减少,因而产生耐药性。近年来研究证明ABC转运蛋白在乳腺癌、肺癌、白血病等许多恶性肿瘤的多药耐药中扮演着重要角色[7]。研究发现[8],雌激素能降低内源性BCRP的表达,因此ER阴性的乳腺癌细胞株中BCRP表达高于ER阳性细胞株。Yamada等[9]发现ABCC1、ABCG2、ABCC11等经常高表达于TNBC以及HER2乳腺癌亚型中,无病生存期(disease-free survival,DFS)比其他亚型差(P<0.01)。另一些研究也提示这些转运蛋白的表达增加是乳腺癌及其他恶性肿瘤的预后不良因子[10, 11]。(2)信号转导通路激活:如PI3K/Akt通路激活导致的肿瘤细胞多药耐药。(3)药物作用靶点结构发生改变或受损,靶点修复能力提高:如DNA拓扑异构酶Ⅱ(Topo Ⅱ)的水平下降或性质改变。(4)解毒系统有关基因的表达增加或激活:如谷胱甘肽转移酶(GST)的表达增加或活性增强促进药物排泄。(5)肿瘤细胞存活相关应答(包括DNA修复、细胞周期和凋亡)因素的改变等。
在众多耐药机制中,膜转运蛋白介导的药物外排泵是目前认为最重要的一类肿瘤耐药机制,该机制认为肿瘤细胞具有防御性的“药物外泵”功能,利用横跨在细胞膜内外的转运蛋白,将进入肿瘤细胞内的化疗药物“泵”到细胞外,造成细胞内药物浓度减低,产生MDR。基于上述“药泵”机制,本研究采用HPLC法对经相同浓度DDP处理的不同细胞胞内DDP浓度进行检测,可以直观地看到与亲本细胞相比,耐药细胞将更多的药物泵出了细胞膜外。而Real-time PCR研究结果也证实了“药泵”的存在是MDA-MB-231/DDP细胞耐药的重要机制,该部分研究结果发现MDA-MB-231/DDP耐药细胞株中编码上述耐药蛋白相关的基因MDR1及BCRP基因的mRNA表达均较亲本细胞MDA-MB-231细胞明显增高。此外,我们还发现MDA-MB-231/DDP细胞耐药的发生是多种机制共同作用的,例如与肿瘤MDR密切相关的GST以及MMP7等。这对我们进一步研究多药耐药的具体机制有重要作用,也为临床上寻找解决三阴性乳腺癌的多药耐药方案奠定了基础。
| [1] | Rottenberg S, Nygren AO, Pajic M, et al. Selective induction of chemotherapy resistance of mammary tumors in a conditional mouse model for hereditary breast cancer[J]. Proc Natl Acad Sci U S A, 2007, 104(29): 12117-22. |
| [2] | Yang L, Liu WC, Li R. The comparison of the cytotoxicity between cisplatin solution and cisplatin powder in vitro[J]. Xian Dai Zhong Liu Yi Xue, 2008, 16(7): 1101-2. [杨乐, 刘文超, 李蓉. 顺铂水针剂与粉针剂体外细胞毒作用的差异性研究[J]. 现代肿瘤医学, 2008, 16(7): 1101-2.] |
| [3] | Silver DP, Richardson AL, Eklund AC, et al. Efficacy of neoadjuvant Cisplatin in triple-negative breast cancer[J]. J Clin Oncol, 2010, 28(7): 1145-53. |
| [4] | Guo QL. Cancer Pharmacology[M]. 1nd ed. Beijing: Chemical Industry Publication, 2008: 140-1. [郭青龙. 肿瘤药理学[M]. 1版. 北京: 化学工业出版社, 2008: 140-1.] |
| [5] | Liedert B, Materna V, Schadendorf D, et al. Overexpression of cMOAT (MRP2/ABCC2) is associated with decreased formation of platinum-DNA adducts and decreased G2-arrest in melanoma cells resistant to cisplatin[J]. J Invest Dermatol, 2003, 121(1): 172-6. |
| [6] | Natarajan K, Xie Y, Baer MR, et al. Role of breast cancer resistance protein (BCRP/ABCG2) in cancer drug resistance[J]. Biochem Pharmacol, 2012, 83(8): 1084-103. |
| [7] | Amiri-Kordestani L, Basseville A, Kurdziel K, et al. Targeting MDR in breast and lung cancer: discriminating its potential importance from the failure of drug resistance reversal studies[J]. Drug Resist Updat, 2012, 15(1-2): 50-61. |
| [8] | Zhang Y, Wang H, Wei L, et al. Transcriptional modulation of BCRP gene to reverse multidrug resistance by toremifene in breast adenocarcinoma cells[J]. Breast Cancer Res Treat, 2010, 123(3): 679-89. |
| [9] | Yamada A, Ishikawa T, Ota I, et al. High expression of ATP-binding cassette transporter ABCC11 in breast tumors is associated with aggressive subtypes and low disease-free survival[J]. Breast Cancer Res Treat, 2013, 137(3): 773-82. |
| [10] | Lee SH, Kim H, Hwang JH, et al. Breast cancer resistance protein expression is associated with early recurrence and decreased survival in resectable pancreatic cancer patients[J]. Pathol Int, 2012, 62(3): 167-75. |
| [11] | Oliveira Rodrigues FF, Dos Santos RE, de Oliveira AL, et al. Prognostic assessment of polymorphisms of the MDR-1 and GSTP1 genes in patients with stageⅡand Ⅲ breast cancer submitted to neoadjuvant chemotherapy[J]. Breast J, 2012, 18(2): 185-7. |
 2016, Vol. 43
2016, Vol. 43