文章信息
- 武海涛,杨肖军,孙建华,黄超群,姬忠贺,龚俊,李雁
- WU Haitao, YANG Xiaojun, SUN Jianhua, HUANG Chaoqun, JI Zhonghe, GONG Jun, LI Yan
- 洛铂联合多西他赛行肿瘤细胞减灭术加腹腔热灌注化疗治疗腹膜癌的临床观察
- Clinical Observation of Cytoreductive Surgery plus Hyperthermic Intraperitoneal Chemotherapy with Lobaplatin and Docetaxel on Peritoneal Carcinoma
- 肿瘤防治研究, 2016, 43(02): 150-157
- Cancer Research on Prevention and Treatment, 2016, 43(02): 150-157
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.02.012
-
文章历史
- 收稿日期: 2015-06-05
- 修回日期: 2015-07-10
腹盆腔恶性肿瘤局域性进展可形成腹膜癌(peritoneal carcinoma,PC),通常采取姑息治疗,预后差,其中位生存期仅约6月[1],随着对肿瘤生物学行为的深入研究及治疗技术的发展,对PC的认识也发生了较大转变,认为PC属区域性病变,进而发展了肿瘤细胞减灭术(cytoreductive surgery,CRS)加腹腔热灌注化疗术(hyperthermic intraperitoneal chemotherapy,HIPEC)的综合治疗新策略,即利用外科手术切除肉眼可见的肿瘤,利用区域热灌注化疗清除微转移灶和腹腔游离肿瘤细胞[2]。
热效应与化疗药物有协同作用,该协同作用在42℃时即明显增强[3, 4, 5]。目前常用化疗药物为顺铂、奥沙利铂、卡铂、氟尿嘧啶、丝裂霉素、紫杉醇、多西他赛等[6, 7, 8, 9]。
洛铂(lobaplatin,LBP)作为第3代铂类抗肿瘤药物,稳定性好、抗瘤谱广,相对分子量较大,腹腔化疗具有药代动力学优势,抗瘤活性与第1代顺铂和第2代卡铂相当,但无明显的肾毒性和神经毒性[10, 11]。多西他赛(docetaxel,TXT)是新一代半合成紫杉类抗癌药物,抗微管解聚能力是紫杉醇的2倍,且对紫杉醇耐药的细胞株仍有一定的活性。
LBP联合TXT进行化疗安全有效[12, 13],且具有协同增强效应[14],本课题旨在研究LBP联合TXT进行CRS+HIPEC的安全性、不良事件及生存结果。
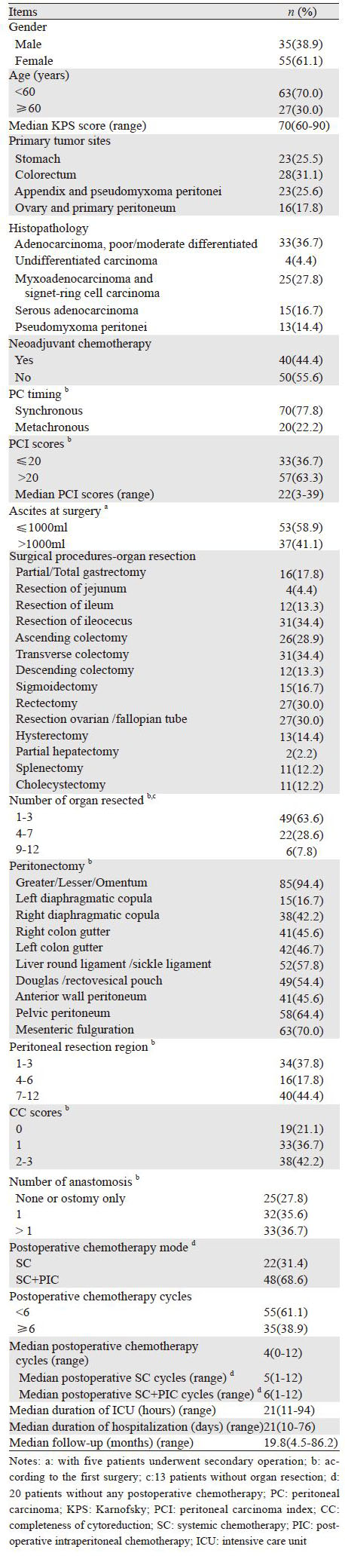
1 资料与方法 1.1 临床资料收集在本单位2008年1月至2014年11月接受CRS+HIPEC治疗的90例PC患者,其中胃癌(gastric cancer,GC)23例、结直肠癌(colorectal cancer,CRC)28例、阑尾癌(appendical cancer,AC)和腹膜假黏液瘤(pseudomyxoma peritonei,PMP)23例、卵巢癌(ovarian cancer,OC)和原发性腹膜癌(primary peritoneum carcinoma,PPC)16例。
根据腹膜癌治疗的专家共识[8]进行血液学检查和影像学检查。主要纳入标准[8]:(1)年龄20~75岁;(2)KPS评分>50分;(3)外周血检查、心肝肾肺功能检查提示能耐受手术。主要排除标准:(1)年龄<20岁或>75岁;(2)术前检查发现肺、肝、骨等远处转移或明显腹膜后淋巴结转移;(3)血常规、心、肝、肾功能严重异常,不能耐受手术。研究方案得到武汉大学中南医院医学伦理委员会批准,患者签署知情同意书。
1.2 治疗仪器HIPEC设备为武汉一海数字工程有限公司研制的ES-6001型腹腔热灌注化疗仪。
1.3 CRS+HIPEC操作专业PC治疗团队行CRS+HIPEC操作[6, 15]。患者全麻后摆“大”字位,取剑突至耻骨联合正中切口,开腹后从膈面腹膜到盆腔腹膜探查肿瘤侵犯程度、PC及范围,记录原发瘤和(或)PC的大小、部位,进行腹膜癌指数(peritoneal carcinoma index,PCI)评分[16]。凡能完全缩瘤者行根治性切除;姑息切除者行最大程度CRS,并行细胞减灭程度(completeness of cytoreduction,CCR)评分[17]。完成CRS后行开放式非循环HIPEC,化疗药物[12]洛铂50 mg/m2联合多西他赛60 mg/m2,分别加入6 000 ml 0.9%氯化钠溶液中,加热至灌注温度(43±0.5)℃,200 ml/min低流量灌注,持续灌注60 min,HIPEC后行常规减张缝合关腹,术后患者转入重症监护室,生命体征平稳后转回普通病房。
术后患者恢复后,进行常规辅助化疗,根据病理报告及血清肿瘤标志物检查结果,制定化疗方案,包括全身化疗(FOLFOX、FOLFIRI为主)单独全身化疗和(或)全身化疗(FOLFOX、FOLFIRI为主)联合腹腔化疗(铂类),化疗6周期。
1.4 观察和监测指标观察和监测指标包括:(1)术后1~6天心率、体温和引流量;(2)术后第1、7天血常规、肝肾功能电解质及术前、术后肿瘤标志物变化;(3)术后有无吻合口瘘、腹腔内感染及出血、肠梗阻等危及生命严重不良事件;(4)切口愈合情况:脂肪液化、切口裂开、切口感染、切口疝及术后拆线时间;(5)术后胃肠功能恢复:肠鸣音、拔胃管、进流质饮食时间、肛门排便及排气时间;(6)生存结果。
1.5 相关定义 1.5.1 围手术期手术日至术后30天。 1.5.2 不良事件
按照美国国立癌症研究所通用术语标准(National Cancer Institute Common Terminology Criteria,NCI-CTC)[18],1~3级为不良事件,主要包括实验室检验指标异常,经过对症治疗后恢复正常;4~5级为严重不良事件,主要包括与本治疗直接相关死亡、严重感染、肠瘘或吻合口瘘等危及生命的并发症。 1.5.3 总生存期(overall
survival,OS)确诊PC开始治疗时至死亡或随访结束。 1.5.4 细胞减灭程度(completeness
of cytoreduction,CCR)评分临床常用的是Sugarbaker CCR评分法[17]:0分:细胞减灭术后无腹膜残余瘤;1分:残余瘤直径<2.5 mm;2分:残余瘤直径2.5 mm~2.5 cm;3分:残余瘤>2.5 cm,或存在无法切除病灶。 1.6 随访
所有患者通过门诊、电话随访,最后一次随访截至2015年3月8日,随访率100%。
1.7 统计学方法所有计数资料以频数表示,分析组距和中位数;计量资料以实测数据表示,分析平均值和标准差(x±s)。Kaplan-Meier法比较患者的总生存,Log rank检验比较生存曲线,采用统计学软件SPSS 19.0进行数据分析,P<0.05为差异有统计学意义。
2 结果 2.1 主要临床资料数据90例PC患者行95次CRS+HIPEC手术,其中5例患者各行2次CRS+HIPEC手术,主要临床病理学特征见表 1。
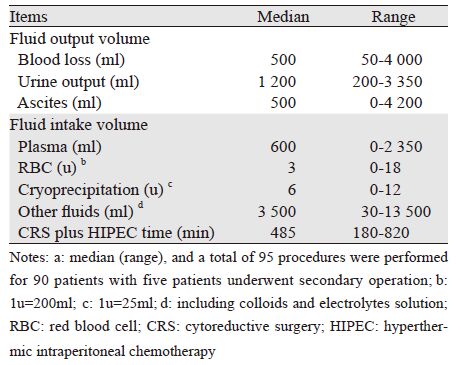
手术切除器官和腹膜区域数目见表 1,CRS+HIPEC时间及术中血液动力学指标等见表 2。术后患者住ICU中位时间21 h(11~94 h),尿管拔出中位时间3天(2~6天),术后肛门排便、排气及拔胃管中位时间均为5天(3~23天),进流质饮食中位时间6天(4~24天),拔引流管中位时间9天(5~69天),拆线时间15天(10~30天)。
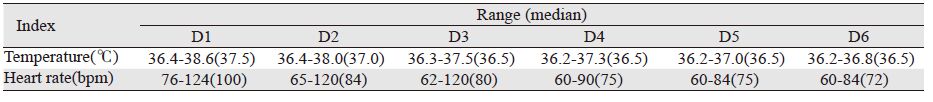
术后第1~6天,体温和心率呈下降趋势,且逐渐恢复至正常;术后第1、2、3、4天体温超过37℃的患者例数分别为77、30、5、1,见表 3。
 |
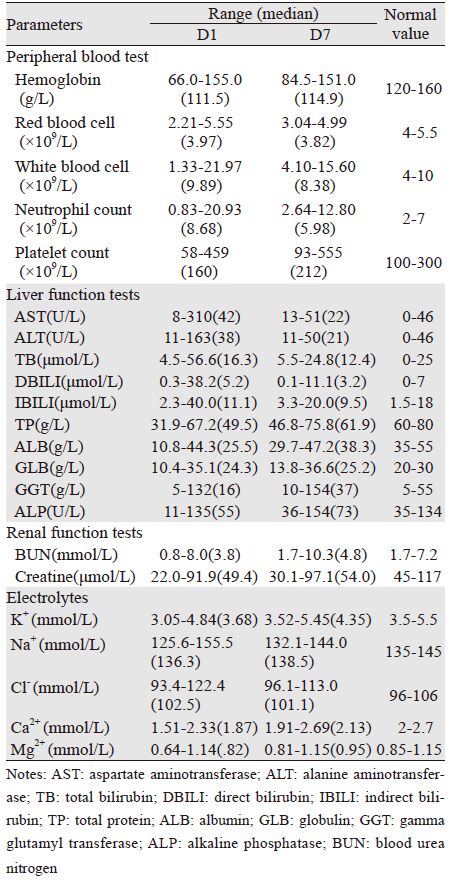
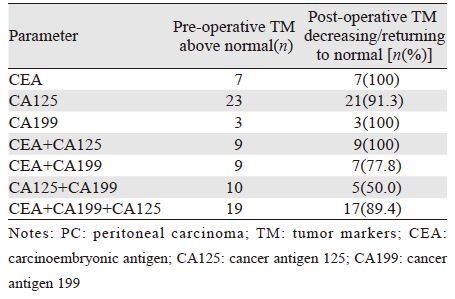
术后第1、7天的主要检验结果见表 4。术前1周复查肿瘤标志物CEA、CA125、CA199单独或联合升高者80例,术后1周该指标下降或至正常值范围者69例(86.3%),见表 5。
 |
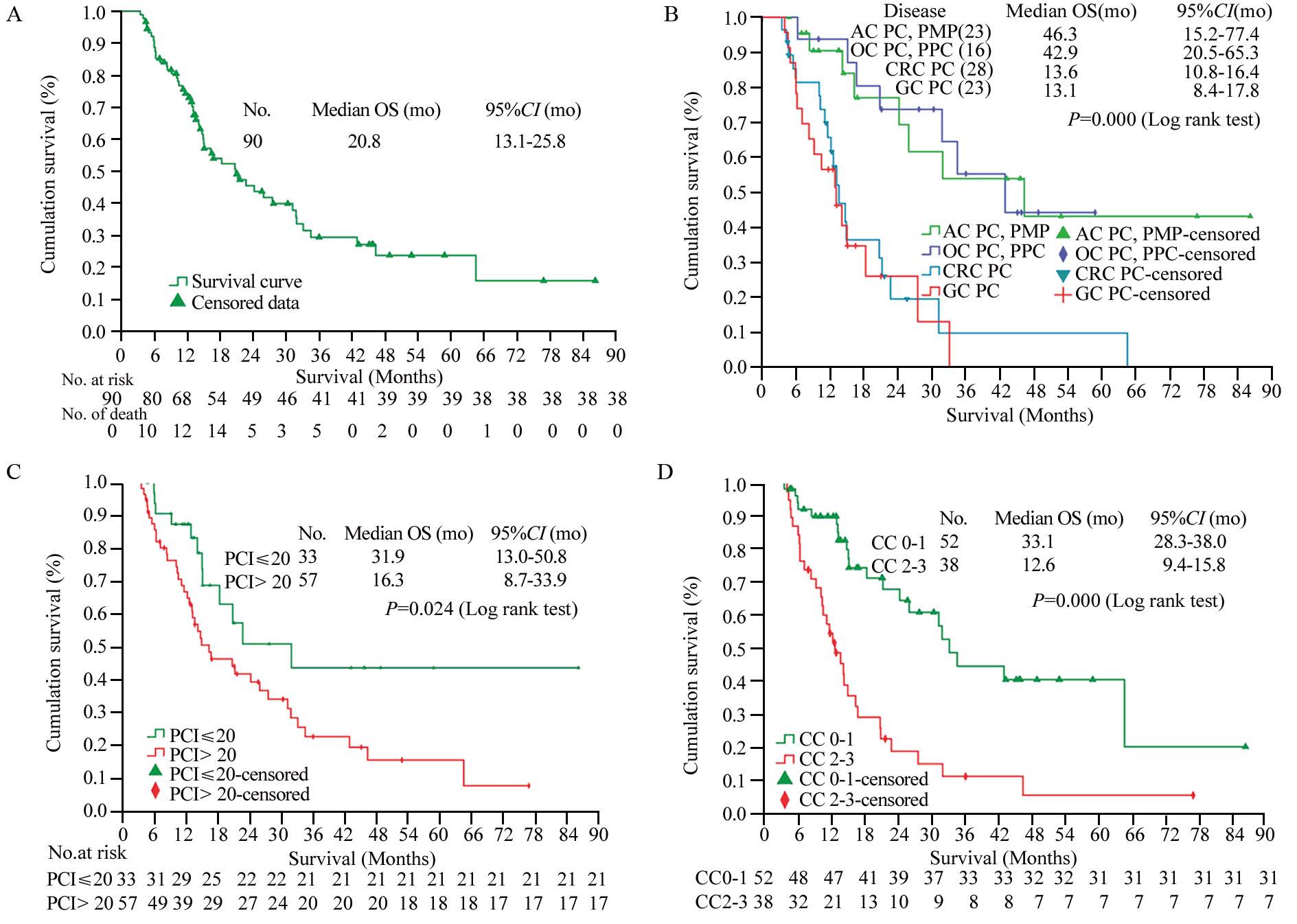
患者中位随访时间19.8月(4.5~86.2月),1、3、5年生存率分别为75.6%、45.6%、43.3%;90例PC患者中,52例死亡,17例带瘤生存,21例无瘤生存,中位OS为20.8月(95%CI: 13.1~25.8月),见图 1A,其中ACPC和PMP者中位OS为46.3月(95%CI: 15.2~77.4 月),OCPC和PPC者中位OS为42.9月(95%CI: 20.5~65.3月),CRC PC者中位OS为13.6月(95%CI: 10.8~16.4月),GC PC者中位OS为13.1月(95%CI: 8.4~17.8月),差异有统计学意义(P=0.000),见图 1B。
|
| A: the overall survival of PC patients treated by CRS+HIPEC; the statistical significance in overall survival (OS) comparisons stratified by different diseases(B), PCI(C) and CC(D); mo:months; AC: appendical cancer; PMP: pseudomyxoma peritonei; OC:ovarian cancer; PPC:primary peritoneum carcinoma; CRC: colorectal cancer; GC: gastric cancer; CCR: completeness of cytoreduction 图 1 腹膜癌患者的生存曲线 Fig. 1 Kaplan-Meier survival curves of PC patients |
低PCI(PCI≤20,LPCI,n=33)患者中位OS为31.9月(95%CI: 13.0~50.8 月),而高PCI(PCI>20,HPCI,n=57)患者中位OS为16.3月(95%CI: 8.7~33.9月),差异有统计学意义(P=0.024),见图 1C。
CC0-1患者的中位OS为33.1月(95%CI: 28.3~38.0月),而CC2-3患者的中位OS为12.6月(95%CI: 9.4~15.8月),差异有统计学意义(P= 0.000),见图 1D。
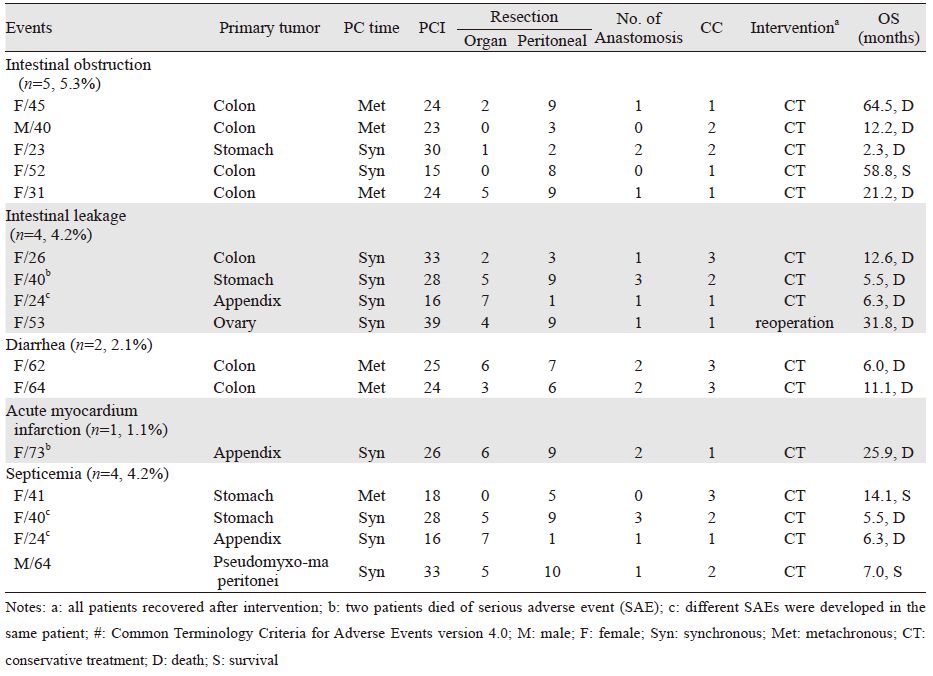
2.6 不良事件3级以上不良事件者16例(16.8%),包括肠梗阻5例,均经保守治疗后缓解;吻合口瘘4例,第1例患者瘘后第6天再次行肠瘘修补术,修补失败后保守治疗,术后生存2.2月;第2例患者术后30天出现吻合口瘘,保守治疗后生存3月;第3例患者术后第6天出现金黄色葡萄球菌感染性弥漫性腹膜炎,术后第24天死亡;第4例患者术后11天出现革兰染色阴性杆菌感染,术后2.3月死亡。重度腹泻2例,给予止泻、调节肠道菌群治疗后治愈。感染败血症4例,感染细菌为金黄色葡萄球菌、近平滑假丝酵母菌、屎肠球菌、染色阴性杆菌,2例死亡,2例康复。5级不良事件2例(2.1%),第1例术后第2天死于突发急性心肌梗死;第2例术后第4天吻合口瘘,生存期24天,见表 6。
 |
CRS+HIPEC综合利用手术切除、区域化疗、热化疗协同作用清除术后残留的脱落癌细胞和微癌灶,是目前治疗PC最有效的策略[19]。本课题组开展了实验[20]和临床[6, 15]研究,证实了CRS+HIPEC的安全性和有效性。荷兰癌症研究中心完成了CRC PCⅢ期前瞻性随机对照临床研究,推荐CRS+HIPEC作为标准治疗模式[19],Spiliotis等[21]进行的复发性卵巢癌Ⅲ期前瞻性随机对照临床研究表明,与现有标准疗法比较,CRS+HIPEC能使中位生存期延长近一倍(13.4月 vs. 26.8月)。
由于存在“腹膜-血浆屏障”,限制腹膜对大分子药物的吸收,使腹腔能够维持高药物浓度,而外周血药物浓度较低。因此,HIPEC既增加了药物对PC的直接细胞毒作用,又减轻了全身毒副作用。LBP主要是通过形成Pt-GG以及Pt-AG的链内交联,从而阻断DNA复制与转录过程,对非小细胞肺癌、乳腺癌、卵巢癌、结直肠癌、胃癌、睾丸肿瘤以及淋巴瘤等均有广谱抗瘤活性[12, 22]。TXT主要是抑制蛋白单体解聚,促进微管蛋白装配成微管,干扰细胞有丝分裂,使细胞周期阻滞于G~M期,从而抑制细胞增殖,也属于广谱抗肿瘤药物[23, 24]。
Ⅰ期和Ⅱ期临床研究显示,LBP的毒性主要表现为骨髓抑制,尤其是血小板减少,但消化道和肾毒性均较轻[13, 25],LBP联合TXT全身化疗Ⅰ期临床研究治疗进展期实体瘤安全性及近期疗效已有报道[12]。本研究中,术后第1天白蛋白、血红蛋白降低者分别为87例(87.4%)、66例(69.5%),主要是由于手术切除器官、腹膜区域多、创面大、手术时间长及腹腔43℃持续灌注导致渗出体液较多等。因此术中需输注全血、新鲜冰冻血浆、冷沉淀、白蛋白等。
术前肿瘤标志物CEA、CA125、CA199单独或联合升高者80例,术后复查肿瘤标志物降低或至正常值69例(86.3%),说明该疗法能够降低肿瘤标志物水平。CEA可辅助判断肿瘤侵袭度[26],CA125可辅助判断腹水形成和腹膜肿瘤负荷程度[27],CA199可辅助判断腹水中或原发癌细胞的增生活性[28]。
为求多器官及腹膜切除,实现最大程度CRS,需较大手术视野,术后风险高,术后并发症发生率14%~55%,死亡率0~19%,尤其是术后肠瘘和脓毒血症[29]。Arias等[30]报道了72例PC患者行CRS+HIPEC后,发生严重不良事件27例(37.5%)、包括肠梗阻9例(12.5%)、肠瘘2例(2.7%)、医院获得性感染5例(6.9%)、切口感染13例(18.1%)、肺栓塞9例(12.5%)、心律失常1例(1.4%)等。本研究中,严重不良事件发生率较低,团队总结经验包括:(1)专业PC治疗手术团队进行CRS+HIPEC操作,在保证手术安全的情况下,尽量消灭肉眼可见的转移灶,是延长OS的关键;(2)使用抗瘤谱广,抗瘤活性强化疗药物行HIPEC(LBP 50 mg/m2+TXT 60 mg/m2);(3)减张缝合关腹,切口每日换药及延迟拆线;(4)术中和术后输注全血、新鲜冰冻血浆、冷沉淀及白蛋白,弥补胶体丢失;(5)术后使用广谱抗生素,覆盖革兰氏染色阳性和阴性细菌及厌氧菌;(6)术后ICU监护,生命体征稳定后转入普通病房;(7)全量营养支持及调节电解质平衡。本组16例严重不良事件的原因分析:(1)患者中位PCI指数24,临床分期较晚;(2)手术切除范围广,时间长,手术难度大(中位器官、腹膜切除数分别为4、8,中位手术时间670 min,中位CC评分2分;(3)严重不良事件导致患者病情持续恶化,出现严重不良事件后,患者中位OS 11.1月。因此,应选择PCI较低者行CRS+HIPEC,同时加强围手术期护理及治疗,最大限度减少严重不良事件发生。
总之,对于PC患者,LBP联合TXT进行CRS+HIPEC安全性可接受,可延长患者OS。还需要大样本、多中心临床研究提供更有力的证据,对该疗法进行更全面的评价。
| [1] | Chua TC, Esquivel J, Pelz JO, et al. Summary of current therapeutic options for peritoneal metastases from colorectal cancer[J]. J Surg oncol, 2013, 107(6): 566-73. |
| [2] | Sugarbaker PH. Surgical responsibilities in the management of peritoneal carcinomatosis[J]. J Surg oncol, 2010, 101(8): 713-24. |
| [3] | Glehen O, Osinsky D, Cotte E, et al. Intraperitoneal chemohyperthermia using a closed abdominal procedure and cytoreductive surgery for the treatment of peritoneal carcinomatosis: morbidity and mortality analysis of 216 consecutive procedures[J]. Ann Surg Oncol, 2003, 10(8): 863-9. |
| [4] | Elias D, Bonnay M, Puizillou JM, et al. Heated intra-operative intraperitoneal oxaliplatin after complete resection of peritoneal carcinomatosis: pharmacokinetics and tissue distribution[J]. Ann Oncol, 2002, 13(2): 267-72. |
| [5] | El-Kareh AW, Secomb TW. A theoretical model for intraperitoneal delivery of cisplatin and the effect of hyperthermia on drug penetration distance[J]. Neoplasia, 2004, 6(2): 117-27. |
| [6] | Huang CQ, Feng JP, Yang X, et al. Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy improves survival of patients with peritoneal carcinomatosis from colorectal cancer: a case-control study from a Chinese center[J]. J Surg Oncol, 2014, 109(7): 730-9. |
| [7] | Coccolini F, Campanati L, Catena F, et al. Hyperthermic intraperitoneal chemotherapy with cisplatin and paclitaxel in advanced ovarian cancer: a multicenter prospective observational study[J]. J Gynecol Oncol, 2015, 26(1): 54-61. |
| [8] | Li Y, Zhou YF, Liang H, et al. Expert Consensus on the Cytoreductive Surgery (CRS) and Hyperthermic Intraperitoneal Chemotherapy (HIPEC) to Treat Peritoneal Surface Malignancies[J]. Zhongguo Zhong Liu Lin Chuang, 2015, 42(4): 198-206. [李雁, 周云峰, 梁寒, 等. 细胞减灭术加腹腔热灌注化疗治疗腹膜表面肿瘤的专家共识[J]. 中国肿瘤临床, 2015, 42(4): 198-206.] |
| [9] | Tan YN, Yuang Y. Treatment advances of peritoneal metastasis from gastric cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2015, 42(5): 506-10.[谭依诺,袁瑛. 胃癌腹膜转移的治疗进展[J]. 肿瘤防治研究, 2015, 42(5): 506-10.] |
| [10] | Ali I, Wani WA, Saleem K, et al. Platinum compouds: a hope for future cancer chemotherapy[J]. Anticancer Agents Med Chem, 2013, 13(2): 296-306. |
| [11] | Wheate NJ, Walker S, Craig GE, et al. The status of platinum anticancer drugs in the clinic and in clinical trials[J]. Dalton Trans, 2010, 39(35): 8113-27. |
| [12] | Peng Y, Liu YE, Ren XC, et al. A phase I clinical trial of dose escalation of lobaplatin in combination with fixed-dose docetaxel for the treatment of human solid tumours that had progressed following chemotherapy[J]. Oncol Lett, 2015, 9(1): 67-74. |
| [13] | Long GX, Lin JW, Liu DB, et al. Single-arm, multi-centre phase II study of lobaplatin combined with docetaxel for recurrent and metastatic nasopharyngeal carcinoma patients[J]. Oral Oncol, 2014, 50(8): 712-20. |
| [14] | Xie CY, Xu YP, Jin W, et al. Antitumor activity of lobaplatin alone or in combination with antitubulin agents in non-small-cell lung cancer[J]. Anticancer Drugs, 2012, 23(7): 698-705. |
| [15] | Yang XJ, Huang CQ, Suo T, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy improves survival of patients with peritoneal carcinomatosis from gastric cancer: final results of a phase Ⅲ randomized clinical trial[J]. Ann Surg Oncol, 2011, 18(6): 1575-81. |
| [16] | Sugarbaker PH. Successful management of microscopic residual disease in large bowel cancer[J]. Cancer Chemother Pharmacol, 1999, 43 Suppl:15-25. |
| [17] | Jacquet P, Sugarbaker PH. Clinical research methodologies in diagnosis and staging of patients with peritoneal carcinomatosis[J]. Cancer Treat Res, 1996, 82: 359-74. |
| [18] | National Cancer Institute: Common Terminology Criteria for Adverse Events version 4.0[EB/OL]. http://ctep.cancer.gov/protocolDevelopment/electronic_applications/ctc.htm. |
| [19] | Verwaal VJ, van Ruth S, de Bree E, et al. Randomized trial of cytoreduction and hyperthermic intraperitoneal chemotherapy versus systemic chemotherapy and palliative surgery in patients with peritoneal carcinomatosis of colorectal cancer[J]. J Clin Oncol, 2003, 21(20): 3737-43. |
| [20] | Tang L, Mei LJ, Yang XJ, et al. Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy improves survival of gastric cancer with peritoneal carcinomatosis: evidence from an experimental study[J]. J Transl Med, 2011, 9: 53. |
| [21] | Spiliotis J, Halkia E, Lianos E, et al. Cytoreductive Surgery and HIPEC in Recurrent Epithelial Ovarian Cancer: A Prospective Randomized PhaseⅢStudy[J]. Ann Surg Oncol, 2015, 22(5): 1570-5. |
| [22] | Deng QQ, Huang XE, Ye LH, et al. PhaseⅡtrial of Loubo?(Lobaplatin) and pemetrexed for patients with metastatic breast cancer not responding to anthracycline or taxanes[J]. Asian Pac J Cancer Prev, 2013, 14(1): 413-7. |
| [23] | Ford H, Gounaris I. Docetaxel and its potential in the treatment of refractory esophagogastric adenocarcinoma[J]. Therap Adv Gastroenterol, 2015, 8(4): 199-205. |
| [24] | Tan Q, Joshua AM, Saqqar JK, et al. Effect of pantoprazole to enhance activity of docetaxel against human tumor xenografts by inhibiting autophagy[J]. Br J Cancer, 2015, 112(5): 832-40. |
| [25] | Li XC, Li YH. Clinical study on chemotherapy of lobplatin combined with docetaxel in patients with relapsed ovarian cancer[J]. Zhongnan Da Xue Xue Bao (Yi Xue Ban), 2014, 39(11): 1131-6. [李新春, 李瑛花. 洛铂联合多西他赛治疗复发性卵巢癌的疗效[J]. 中南大学学报(医学版), 2014, 39(11): 1131-6.] |
| [26] | Zhang YH, Li Y, Chen C, et al. Carcinoembryonic antigen level is related to tumor invasion into the serosa of the stomach: study on 166 cases and suggestion for new therapy[J]. Hepatogastroenterology, 2009, 56(96): 1750-4. |
| [27] | Nakata B, Hirakawa-YS Chung K, Kato Y, et al. Serum CA125 level as a predictor of peritoneal dissemination in patients with gastric carcinoma[J]. Cancer, 1998, 83(12): 2488-92. |
| [28] | Polat E, Duman U, Duman M, et al. Preoperative serum tumor marker levels in gastric cancer[J]. Pak J Med Sci, 2014, 30(1): 145-9. |
| [29] | Scaringi S, Kianmanesh R, Sabate JM, et al. Advanced gastric cancer with or without peritoneal carcinomatosis treated with hyperthermic intraperitoneal chemotherapy: a single western center experience[J]. Eur J Surg Oncol, 2008, 34(11): 1246-52. |
| [30] | Arias F, Herrera-Almario G, Pozo ME, et al. Safety and quality outcomes in peritoneal surface malignancy patients: developing a national center for excellence in Colombia[J]. Ann Surg Oncol, 2015, 22(5): 1733-8. |
 2016, Vol. 43
2016, Vol. 43