文章信息
- 王圆,常志伟,闫洁,任爽,郭威,秦艳茹
- WANG Yuan, CHANG Zhiwei, YAN Jie, REN Shuang, GUO Wei, QIN Yanru WANG Yuan, CHANG Zhiwei, YAN Jie, REN Shuang, GUO Wei, QIN Yanru
- 食管鳞状细胞癌组织中DMRT2的表达及临床意义
- Expression of DMRT2 in Esophageal Squamous Cell Carcinoma Tissues and Related Clinical Significance
- 肿瘤防治研究, 2016, 43(02): 146-149
- Cancer Research on Prevention and Treatment, 2016, 43(02): 146-149
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.02.011
-
文章历史
- 收稿日期: 2015-05-26
- 修回日期: 2015-10-30
2. 456500 林州,林州市人民医院病理科
2. Department of Pathology, Linzhou City People’s Hospital, Linzhou 456500, China
食管鳞癌是常见的消化道肿瘤之一,晚期患者预后较差,在我国恶性肿瘤中死亡率排名第四[1]。食管鳞癌的发生与复杂的基因和环境有关,遗传基因突变的假说在肿瘤发生研究中仍占主导地位。研究发现,基因DMRT2(double-sex and mab-3 relatated transcription factor 2)主要参与机体的生长发育过程,它编码的一类转录因子主要影响胚胎的性别分化和胚胎体节细胞的分化[2, 3]。转录因子表达量的改变可直接影响细胞功能改变。目前发现在肾透明细胞癌中,该基因显著性下调,其功能机制尚不明确[4]。而在食管鳞癌中,该基因显著性上调,其机制不清[5]。本文通过相关实验,检测DMRT2在食管鳞癌及癌旁正常黏膜组织中的表达情况,并进一步分析其与临床病理资料的关系,旨在了解该基因在食管鳞癌组织中的表达情况及与食管鳞癌的发生、发展、预后的关系,为后续食管鳞癌的研究提供更多资料。
1 资料与方法 1.1 临床资料64对术后ESCC组织及相应癌旁正常食管黏膜组织(距离肿块组织5 cm以上)分别来自河南省林州市人民医院手术患者,所有标本经病理证实均为原发性ESCC,所取癌旁正常食管黏膜内不含肿瘤细胞,其中男37例、女27例;分化程度(WHO分级标准):Ⅰ级5例、Ⅱ级41例、Ⅲ级18例;有淋巴结转移38例;TNM分期(UICC指南第6版分期):Ⅰ期1例、Ⅱ期31例、Ⅲ期28例、Ⅳ期4例。肿瘤大体类型:斑块型1例、髓质型33例、溃疡 型 21例、缩窄性4例、蕈伞型5例。患者均知情签署同意书,符合伦理要求。
主要试剂:Trizol试剂购自美国Invitrogen公司,反转录试剂盒(HiScript Q Select RT SuperMix for qPCR)及QRT-PCR试剂盒购自南京诺唯赞生物科技有限公司,QRT-PCR引物购自广州复能公司,兔抗人DMRT2多克隆抗体购自瑞典ATLAS公司,羊抗兔二抗检测系统购自北京中杉金桥公司。
1.2 QRT-PCR检测DMRT2 mRNA表达64对ESCC及正常食管黏膜组织标本离体后立即置于液氮中,后储存于-80℃冰箱备用。采用TRIzol法分别提取ESCC组织及正常食管黏膜组织中总RNA,检验总RNA的完整性后,得到54对有效样本。各取5 μg总RNA按反转录试剂盒说明书进行反转录。DMRT2及GAPDH上下游引物序列购自GeneCopoeia公司,DMRT2引物ID:Hs-QRP-21422,GAPDH引物ID: Hs-QRP-20169。扩增产物大小分别为128 bp、152 bp。用Roche SYBR Green PCR Mix Kit进行QRT-PCR,扩增反应条件:50℃反应2 min;95℃反应10 min,95℃反应15 s,60℃反应1 min,共40个循环。应用ABI PRISM 7900 Sequence Detector序列检测系统对反应产物进行定量测定和溶解曲线分析。以threshold cycle(CT)法比较食管癌中序列含量相对于癌旁相对正常食管黏膜组织和内参GAPDH的变化,对应的表达水平以相应的倍数变化体现,用以下公式计算:(ΔΔCT=ΔCTTumor-ΔCTNontumor),每个ΔCT=ΔCTtarget-ΔCTGAPDH,54例癌旁相对正常的食管黏膜组织的倍数变化平均值为1.0,进行标准化。
1.3 组织芯片制作将64对ESCC及相应癌旁正常黏膜组织标本均经10%甲醛溶液固定、石蜡包埋、HE染色,病理确诊为ESCC,癌旁正常组织无肿瘤细胞。64对ESCC组织及对应癌旁正常组织做为供体蜡块,确定取样部位,并制备空蜡块,用组织芯片制作仪在空蜡块上连续打孔(直径1 mm,间隔0.9 mm),在取样位置上穿刺取样。然后,将穿刺所得的微小圆柱形组织植入到空蜡块上的阵列孔中。
1.4 免疫组织化学检测DMRT2蛋白表达采用免疫组织化学DAB法对64对组织芯片进行DMRT2抗体染色,抗体孵育前均经抗原热修复,操作步骤按说明书进行。以非免疫小鼠或兔IgG代替一抗作阴性对照。阳性信号为细胞质中出现棕色颗粒。组织脱片、组织缺乏代表性、肿瘤组织细胞数量<100不计入统计。统计标准方法:无显色或<2/3的细胞轻度显色或<1/3的细胞中度显色为阴性;≥2/3的细胞轻度显色或≥1/3的细胞中度或深度显色为阳性。以“DMRT2在食管癌肿瘤组织中表达低于相应癌旁正常组织中的表达为低表达,高于或相似于相应癌旁正常组织中的表达为正常表达”。
1.5 统计学方法采用SPSS16.0进行分析,χ2检验分析ESCC与癌旁正常黏膜组织中DMRT2蛋白表达的差异及与临床资料的关系;t检验分析ESCC与正常黏膜组织中DMRT2 mRNA表达差异。P<0.05为差异有统计学意义。
2 结果 2.1 ESCC和正常食管黏膜组织中DMRT2 mRNA的表达实验结果显示,DMRT2 mRNA在ESCC中表达明显低于正常食管黏膜组织(t=7.108,P=0.000),见图 1。
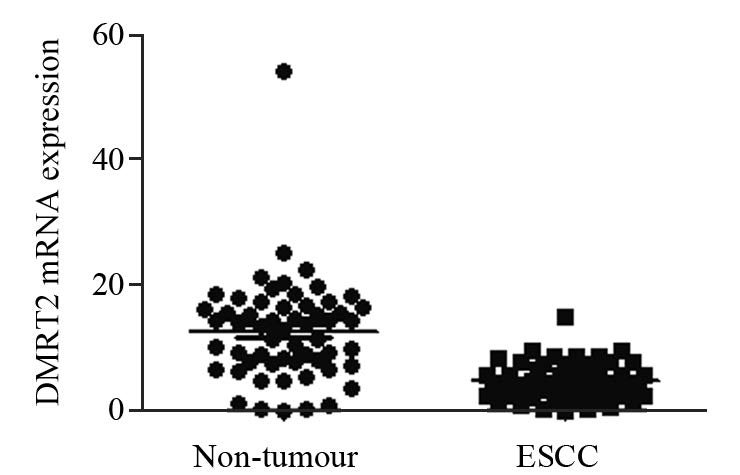
|
| 图 1 QRT-PCR检测DMRT2 mRNA在食管鳞癌组织和相 应癌旁正常组织中的表达 Fig. 1 DMRT2 mRNA expression in esophageal squamous cell carcinoma(ESCC) and corresponding adjacent normal tissues detected by QRT-PCR |
64对标本制成微阵列组织芯片,经DAB免疫组织化学染色后,得到有效数据57对,免疫组织化学结果可见DMRT2蛋白主要在细胞质表达,并且ESCC和癌旁正常食管黏膜均表达。经配对卡方检验统计分析,ESCC组织与配对食管正常黏膜组织DMRT2蛋白表达均阳性的比率为45.6%,表达均阴性的比率为7%(χ2=17.926,P=0.000),见图 2。
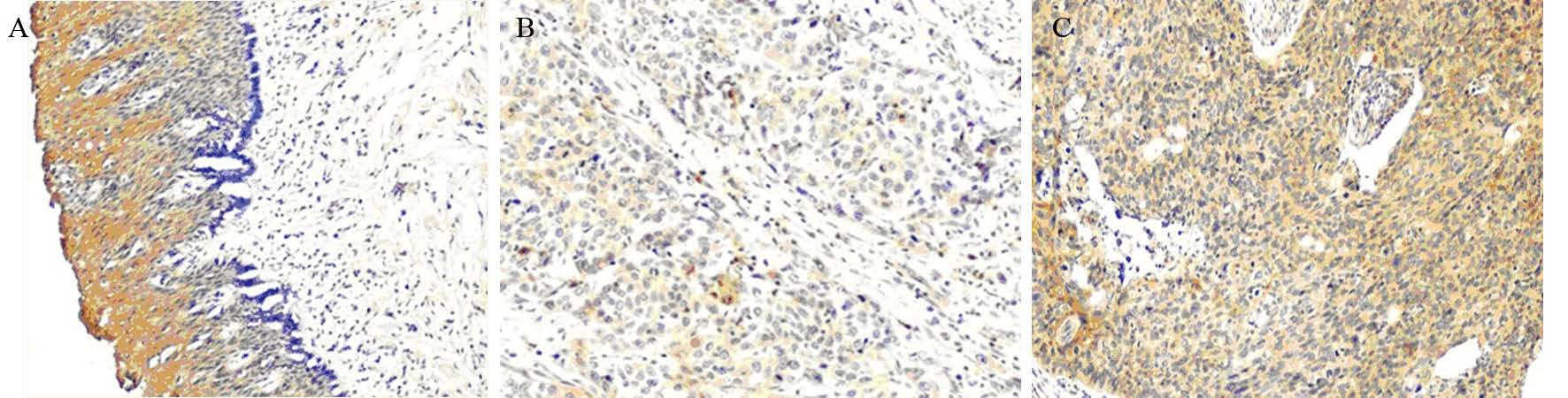
|
| A: strong-positive DMRT2 protein expression in esophageal normal epithelial tissues; B: weak-positive DMRT2 protein expression in ESCC tissues; C: strong-positive DMRT2 protein expression in ESCC tissues 图 2 免疫组织化学DAB法检测食管鳞癌组织及癌旁正常组织DMRT2蛋白的表达 (×100) Fig. 2 DMRT2 protein expression in ESCC and corresponding adjacent normal tissues detected by immunohistochemistry staining (×100) |
DMRT2蛋白表达在有淋巴结转移者阳性率为56%,无淋巴结转移者阳性率为26%,差异有统计学意义,而与性别、分期、大体分型无关,见表 1。
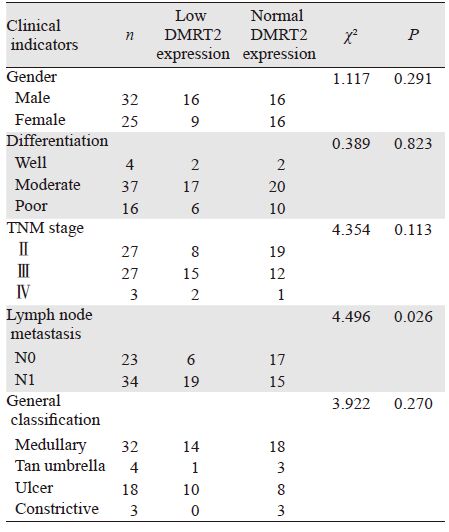 |
DMRT2属于DMRT基因家族的一员,位于染色体9p24,该基因家族位于与性腺发育不全和XY性反转相关联的人类基因组的一个区域,编码为一类转录因子。人类中DMRT家族包括DMRT1-8[2],不同的DMRT基因类型功能不全相同,DMRT1-7结构中均含有高度保守的DM结构域,是以锌指结构与特异的DNA片段结合调控下游基因表达,主要参与性别分化和性别发育。相关研究已发现人类9p染色体缺失可导致46XY型男性性腺发育不全[6]。DMRT2基因除了与性别发育相关之外,还发现与胚胎体节发育相关,研究发现,DMRT2缺失可导致小鼠在围生期因胸骨及肋骨发育不全死亡[6]。而 Pax3/DMRT2/Myf5[7]作为一条信号通路参与胚胎体节的发育。在肾透明细胞癌中[4],DMRT2作为与发育有关转录因子,表达显著性下调,猜测DMRT2基因缺失参与了肾透明细胞癌的发生,其发生机制未进一步阐明。还有些研究者通过建立人食管鳞癌组织CDNA芯片、比较基因组杂交等技术,在食管鳞癌、乳腺癌等肿瘤组织中发现DMRT2基因水平发生改变[5, 8],基于大样本组织在蛋白水平的表达情况,与肿瘤病理特征的关系研究较少。
本实验通过制作食管鳞癌组织芯片及收集临床数据证明,与癌旁正常食管黏膜组织相比,ESCC组织中DMRT2 mRNA及蛋白表达量降低,且差异均有统计学意义,另外DMRT2蛋白低表达与淋巴结转移(χ2=4.946,P=0.026)有关,提示DMRT2低表达的ESCC肿瘤细胞比正常表达者更具有侵袭性和转移性,这可能导致肿瘤患者的预后较差。由此猜测DMRT2可能参与了癌细胞的转移过程。
总之,食管鳞状细胞癌组织相对正常食管黏膜组织,DMRT2的表达水平降低,差异有统计学意义,并且DMRT2低表达还可能与淋巴结转移有关。目前关于DMRT2基因在肿瘤中的功能机制研究较少,接下来希望通过进一步体外实验,探讨DMRT2在食管鳞癌细胞中的功能性作用,为以后研究提供更多依据。
| [1] | Zhang L, Zhou Y, Cheng C, et al. Genomic analyses reveal mutational signatures and frequently altered genes in esophageal squamous cell carcinoma[J]. Am J Hum Genet, 2015, 96(4): 597-611. |
| [2] | Zhang YY, Wang CL. Advances in the DMRT Gene Family Research[J]. Zhongguo Xi Bao Sheng Wu Xue Xue Bao, 2013, 35(11): 1660-5. [张月圆, 王昌留. DMRT基因家族研究进展[J].中国细胞生物学学报, 2013, 35(11): 1660-5.] |
| [3] | Borycki AG. The myotomal basement membraneInsight into laminin-111 function and its controlby Sonic hedgehog signaling[J]. Cell Adh Migr, 2013, 7(1): 72-81. |
| [4] | Tun HW, Marlow LA, von Roemeling CA, et al. Pathway signature and cellular differentiation in clear cell renal cell carcinoma[J]. PLoS One, 2010, 5(5): e10696. |
| [5] | Lu P, Qiao J, He W, et al. Genome-wide gene expression profile analyses identify CTTN as a potential prognostic Marker in esophageal Cancer[J]. PLoS One, 2014, 9(2): e88918. |
| [6] | Hong CS, Park BY, Saint-Jeannet JP. The function of Dmrt genes in vertebrate development: it is not just about sex[J]. Dev Bio, 2007, 310(1): 1-9. |
| [7] | Sato T, Rocancourt D, Marques L, et al. A Pax3/Dmrt2/Myf5 regulatory cascade functions at the onset of myogenesis[J]. PLoS Genet, 2010, 6(4): e1000897. |
| [8] | Naylor TL, Greshock J, Wang Y, et al. High resolution genomic analysis of sporadic breast cancer using array-based comparative genomic hybridization[J]. Breast Cancer Res, 2005, 7(6): R1186-98. |
 2016, Vol. 43
2016, Vol. 43


