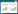文章信息
- 杜军华,乔洪源,尹宜发
- DU Junhua, QIAO Hongyuan, YIN Yifa
- 血清CEA、CA125及Cyfra21-1水平对中晚期非小细胞肺癌患者预后的影响
- Prognostic Value of Serum CEA, CA125 and Cyfra21-1 in Patients with Advanced Non-small Cell Lung Cancer
- 肿瘤防治研究, 2016, 43(02): 137-140
- Cancer Research on Prevention and Treatment, 2016, 43(02): 137-140
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.02.004
-
文章历史
- 收稿日期: 2015-03-11
- 修回日期: 2015-11-17
2. 443000 宜昌,三峡大学第二人民医院肿瘤放化疗科
2. Department of Cancer Chemotherapy, The Second Hospital of Three Gorges University, Yichang 443000, China
肺癌目前仍是世界上发病率和死亡率均较高的恶性肿瘤之一[1]。在我国,由于空气污染日趋加重,吸烟人群数量日益增多和年轻化,中国肺癌的发病率将居世界第一。非小细胞肺癌约占肺癌总人群数的80%[2],由于早期症状缺乏特异性,绝大多数患者确诊时已属晚期,丧失手术机会,以化疗为主的综合治疗模式仍是这类人群的主要治疗手段[3]。
肿瘤标志物逐渐成为肿瘤早期诊断、复发和转移的监测、疗效和预后判断的临床重要参考指标[4]。血清肿瘤标志物测定具有简便、无创、费用低等优点,已成为近年来肿瘤研究领域的重点。临床研究发现[5]血清肿瘤标志物升高是早期非小细胞肺癌预后不良的相关因素,但其在中晚期非小细胞肺癌患者中是否仍具有检测价值,临床尚存在争议。目前在非小细胞肺癌的辅助诊断中应用的肿瘤标志物主要有: CEA、CA125、Cyfra21-1、CA199、CA153、CA50、P53抗体、SCC、NSE等[6, 7],各种肿瘤标志物在不同病理类型肺癌中检出的敏感度及特异性各不相同。本课题通过回顾性研究,对120例ⅢB期、Ⅳ期非小细胞肺癌患者血清肿瘤标志物CEA、CA125以及Cyfra21-1水平与无疾病进展时间的关系进行分析,揭示其在非小细胞肺癌疾病进展和预后判断的重要意义,现将结果报告如下。
1 资料与方法 1.1 资料来源收集2012年6月至2014年5月于宜昌市第二人民医院收治的ⅢB期、Ⅳ期非小细胞肺癌患者120例,入选病例均经痰细胞学、细针肺穿刺细胞学、纤维支气管镜毛刷以及病理学诊断确诊,其中ⅢB期43例、Ⅳ期77例。ⅢB期组:男22例,女21例,年龄21~76岁,平均(61.5±9.6)岁,28例为腺癌、15例为鳞癌。Ⅳ期组:男45例,女32例,年龄20~76岁,平均(65.8±2.7)岁,49例为腺癌、28例为鳞癌。比较两组非小细胞肺癌病例的性别、年龄、肿瘤分型,差异无统计学意义(P>0.05)。
1.2 一般方法对所有入组病例均进行血清肿瘤标志物检测,于入院次日清晨,抽取所有病例静脉血,离心,取血清,应用电化学发光法检测血清肿瘤标志物CEA、CA125、Cyfra21-1水平(仪器选择Roche公司生产的E170系统及配套试剂、质控品、定标液)。所有病例均电话随访,随访时间至2014年9月10日。疾病进展与否按照实体肿瘤的疗效评价标准(RECIST 1.1版),计算疾病无进展生存期(PFS)。
1.3 统计学方法采用SPSS 13.0 统计软件进行统计分析,不同组的计量资料将采用(x±s)进行统计描述,两组间比较采用独立样本t检验。Kaplan-Meier法计算无进展生存期。取P<0.05为差异有统计学意义。
2 结果 2.1 血清CEA、CA125、Cyfra21-1与临床病理特征的关系统计结果显示,血清CEA水平在腺癌患者中明显升高(P=0.002);血清CA125水平在腺癌患者中明显升高(P=0.032),在Ⅳ期患者中也明显升高(P=0.015);血清Cyfra21-1水平在NSCLC患者性别、吸烟史、分期、病理类型、脑转移等特征中差异无明显统计学意义(P>0.05),见表 1。
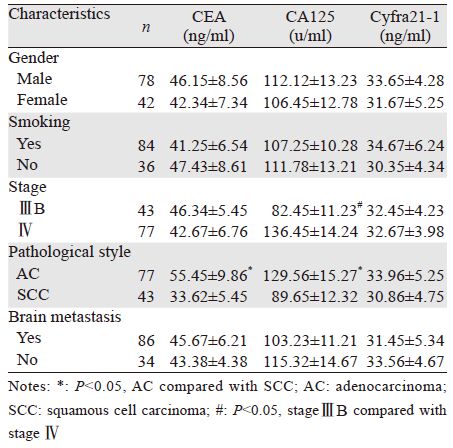 |
根据相关标准,将CEA、CA125、Cyfra 21-1的正常范围分别定为0~6 ng/ml、0~35 u/ml、0~3.3 ng/ml,大于其临界值则视为肿瘤标志物升高,其中位无疾病进展生存期,见表 2。
 |
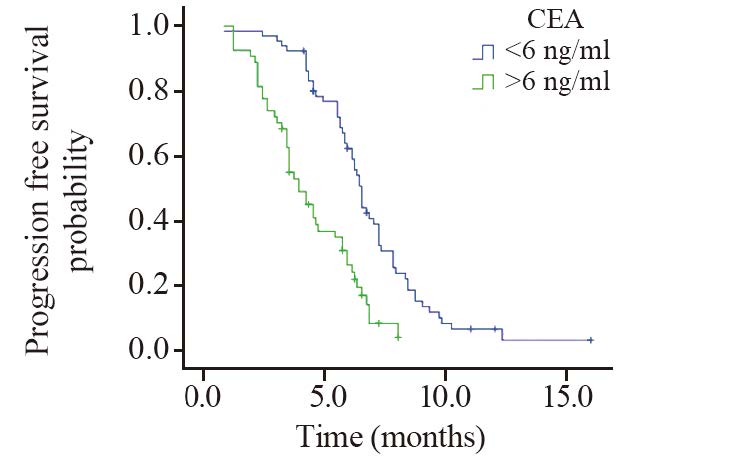
血清CEA指标生存曲线见图 1,CEA<6 ng/ml水平的患者的中位无疾病进展时间为6.8月,CEA>6 ng/ml水平的患者的中位无疾病进展时间为4.2月,两条生存曲线比较差异有统计学意义(P=0.0007)。
|
| 图 1 不同CEA水平患者无疾病进展生存曲线 Fig. 1 PFS survival curves of patients with different CEA levels |
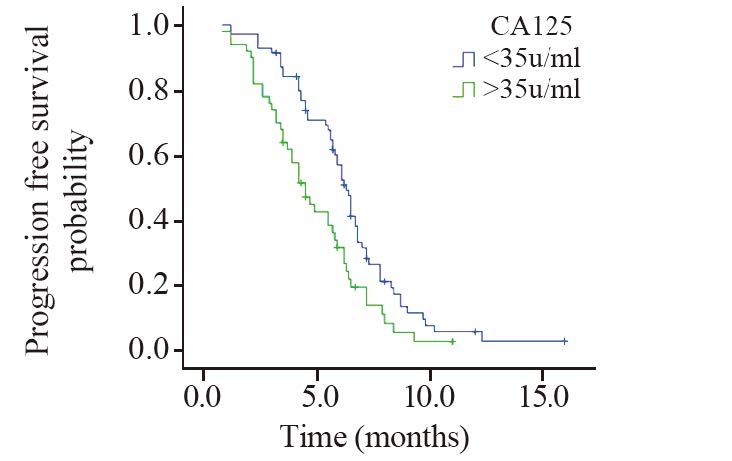
血清CA125指标生存曲线见图 2,CA125<35 u/ml水平的患者的中位无疾病进展时间为6.3月,CA125>35 u/ml水平的患者的中位无疾病进展时间为4.5月,两条生存曲线比较差异有统计学意义(P=0.004)。
|
| 图 2 不同CA125水平患者无疾病进展生存曲线 Fig. 2 PFS survival curves of patients with different CA125 levels |
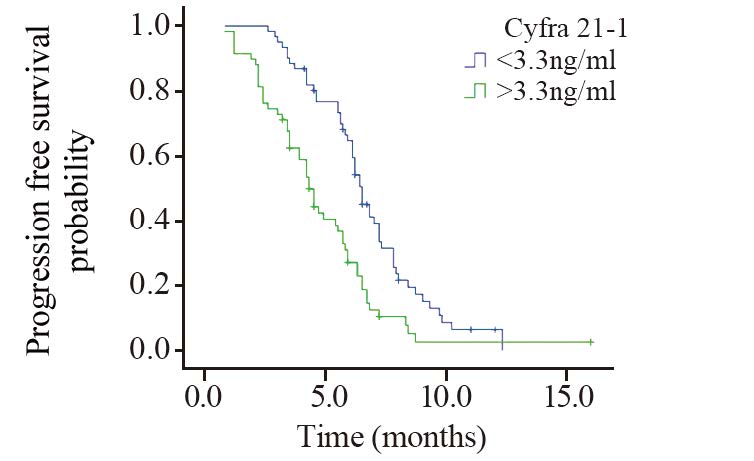
血清Cyfra21-1指标生存曲线见图 3,Cyfra21-1<3.3 ng/ml水平的患者的中位无疾病进展时间为6.5月,Cyfra21-1>3.3 ng/ml水平的患者的中位无疾病进展时间为4.3月,两条生存曲线比较差异有统计学意义(P=0.0009)。
|
| 图 3 不同Cyfra21-1水平患者无疾病进展生存曲线 Fig. 3 PFS survival curves of patients with different Cyfra21-1 levels |
近年来,随着分子生物学的发展,人们逐渐发现肺癌的发生、发展是多基因共同参与的复杂过程[8]。肿瘤标志物是反映肿瘤存在和生长的一类物质,包括激素、蛋白质、酶、癌基因产物、多胺等,存在于患者的体液、细胞或组织中,对肿瘤的诊断、临床分期、疗效观察以及预后判断具有非常重要的价值,大量研究证实相关肿瘤标志物水平在非小细胞肺癌疾病进展预测评估中占有重要的指导意义[9]。
CEA是一种具有人类胚胎抗原决定簇的酸性糖蛋白,属于非器官特异性肿瘤相关抗原,多位于空腔脏器如胃肠道、呼吸道、泌尿道等。糖蛋白由糖链和肽链组成,存在于末梢血及组织中的单核细胞、多核细胞和巨噬细胞中,常被看作是肠癌的肿瘤标志物。研究证实[10]其在肺癌中表达明显,并且与肿瘤复发相关。大量研究表明CEA的阳性率在肺腺癌患者中高达70%以上,明显高于鳞癌[11]。本研究发现其在肺腺癌患者中含量为(55.45±9.86)ng/ml,而在肺鳞癌患者中含量仅为(33.62±5.45)ng/ml,差异有统计学意义(P<0.05)。生存分析显示血清CEA正常组和血清CEA较高组的中位PFS分别为6.8和4.2月,差异有统计学意义( P=0.0007)。
CA125为肿瘤糖类抗原,合成并储存于细胞内,健康人血清中浓度很低,组织恶变或者肿瘤浸润引起组织结构破坏时释放入血。多项研究[12]表明血清CA125对肺癌(尤其是肺腺癌)的诊断有重要作用。本研究发现在中晚期非小细胞肺腺癌患者血清CA125含量为(129.56±15.27)u/ml,明显高于肺鳞癌患者(89.65±12.32)u/ml,其在Ⅳ期患者中的含量明显高于ⅢB期[(82.45±11.23)u/ml vs. (136.45±14.24)u/ml],差异有统计学意义(P<0.05),与既往相关文献[13]报道一致。生存分析显示血清CA125正常组和血清CA125较高组的中位PFS分别为6.3月、4.5月,差异有统计学意义(P=0.004)。
Cyfra21-1是利用鼠的单克隆抗体KS19和BM19-21在人血清中检测细胞角蛋白19的一个可溶性片段。Cyfra21-1是构成细胞的酸性蛋白,主要分布于肺、乳腺上皮,正常人很少分泌,主要由癌变的上皮释放入血。经大量的临床研究资料表明Cyfra21-1是NSCLC患者最有价值的血清肿瘤标志物,对非小细胞肺癌的诊断、病情监测及疗效判断有较高的临床应用价值[14]。本研究发现血清Cyfra21-1在患者疾病一般特征中未见明显差异(P>0.05)。生存分析显示血清Cyfra21-1正常组和血清Cyfra21-1较高组的中位PFS分别为6.5、4.3月,差异有统计学意义(P=0.0009)。
肿瘤细胞生物学具有复杂性和多态性特点,使得目前各种肿瘤标志物在临床应用时都具有一定的局限性。因此,临床应用时常常采用联合检测,可以明显提高诊断阳性率及更有利于临床疗效观察、判断预后。现已有多个研究发现血清肿瘤标志物与肺癌分期、病情轻重及临床预后相关,肿瘤标志物水平随疾病进展而逐渐升高,肿瘤标志物较高的患者常常提示预后差、生存时间短,联合检测肿瘤标志物可更好地判断肺癌患者预后。本研究主要选择CEA+CA125+Cyfra21-1为研究组合,未选择NSE,主要因为NSE是参与糖酵解途径的烯醇化酶中的一种,存在于神经组织和神经内分泌组织中,它被发现主要存在于神经内分泌组织起源有关的肿瘤中,特别是SCLC中有过量的NSE表达,导致血清中NSE明显升高,临床研究发现NSE在非小细胞肺癌患者中并无明显增高,本文是以中晚期NSCLC为研究对象,故未对NSE指标进行探讨。根据本研究结果,我们发现晚期非小细胞肺癌患者肿瘤标志物CEA、CA125以及Cyfra21-1升高与肿瘤进展存在明显的相关性,医师可通过检测患者CEA、CA125以及Cyfra21-1水平判断预后,可将血清CEA、CA125以及Cyfra21 - 1水平作为判断非小细胞肺癌患者预后的参考指标。
| [1] | Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(1): 9-29. |
| [2] | Varughese S, Jahangir KS, Simpson CE, et al. A paradigm shift in the treatment of advanced non-small cell lung cancer[J]. Am J Med Sci, 2012, 344(2): 147-50. |
| [3] | Siegfried JM, Gubish CT, Rothstein ME, et al. Combining the multitargeted tyrosine kinase inhibitor vandetanib with the antiestrogen fulvestrant enhances its antitumor effect in non-small cell lung cancer[J]. J Thorac Oncol, 2012, 7(3): 485-95. |
| [4] | Nolen BM, Brand RE, Prosser D, et al. Prediagnostic serum biomarkers as early detection tools for pancreatic cancer in a large prospective cohort study[J]. PLoS One, 2014, 9(4): e94928. |
| [5] | Lou E, Johnson M, Sima C, et al. Serum biomarkers for assessing histology and outcomes in patients with metastatic lung cancer[J]. Cancer Biomark, 2014, 14(4): 207-14. |
| [6] | Fiala O, Pesek M, Finek J, et al. Predictive role of CEA and CYFRA 21-1 in patients with advanced-stage NSCLC treated with erlotinib[J]. Anticancer Res, 2014, 34(6): 3205-10. |
| [7] | Lei DS, Pei F, Yu J, et al. Evaluation value of tissue polypeptide antigen combined with ProGRP, CEA, NSE, SCC and CYFRA21-1 on patients with lung cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2015, 42(5): 488-92. [雷旦生, 裴锋, 喻晶, 等. 组织多肽抗原联合ProGRP、CEA、NSE、SCC、CYFRA21-1在肺癌诊治中的价值[J]. 肿瘤防治研究, 2015, 42(5): 488-92.] |
| [8] | Moreira AL, Eng J. Personalized therapy for lung cancer[J]. Chest, 2014, 146(6): 1649-57. |
| [9] | Pang L, Wang J, Jiang Y, et al. Decreased levels of serum cytokeratin 19 fragment CYFRA 21-1 predict objective response to chemotherapy in patients with non-small cell lung cancer[J]. Exp Ther Med, 2013, 6(2): 355-60. |
| [10] | Dai H, Liu J, Liang L, et al. Increased lung cancer risk in patients with interstitial lung disease and elevated CEA and CA125 serum tumour markers[J]. Respirology, 2014, 19(5): 707-13. |
| [11] | Qin HF, Qu LL, Liu H, et al. Serum CEA level change and its significance before and after Gefitinib therapy on patients with advanced non-small cell lung cancer[J]. Asian Pac J Cancer Prev, 2013, 14(7): 4205-8. |
| [12] | Cedrés S, Nuñez I, Longo M, et al. Serum tumor markers CEA, CYFRA21-1, and CA-125 are associated with worse prognosis in advanced non-small-cell lung cancer (NSCLC)[J]. Clin Lung Cancer, 2011, 12(3): 172-9. |
| [13] | Zhao J, Zhao M, Jin B, et al. Tumor response and survival in patients with advanced non-small-cell lung cancer: the predictive value of chemotherapy-induced changes in fibrinogen[J]. BMC Cancer, 2012, 12: 330. |
| [14] | Szturmowicz M, Rudziński P, Kacprzak A, et al. Prognostic value of serum C-reactive protein (CRP) and cytokeratin 19 fragments (Cyfra 21-1) but not carcinoembryonic antigen (CEA) in surgically treated patients with non-small cell lung cancer[J]. Pneumonol Alergol Pol, 2014, 82(5): 422-9. |
 2016, Vol. 43
2016, Vol. 43