文章信息
- 高晗, 颜彬, 彭秋子, 刘颖华, 袁冬妮, 吴绪峰.
- GAO Han, YAN Bin, PENG Qiuzi, LIU Yinghua, YUAN Dongni, WU Xufeng.
- IL-6诱导小鼠骨髓中性粒细胞中MMP-9的生成与释放的实验
- IL-6 Induces Production and Releasing of MMP-9 in Murine Bone Marrow Neutrophils
- 肿瘤防治研究, 2016, 43(02): 129-132
- Cancer Research on Prevention and Treatment, 2016, 43(02): 129-132
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.02.007
-
文章历史
- 收稿日期: 2015-04-15
- 修回日期: 2015-11-20
多形核中性粒细胞(polymorphonuclear neutrophils,PMN)作为天然免疫系统的重要组成部分,广泛存在于各种人类癌症中,它能通过生成和释放多种颗粒物质启动和促进肿瘤血管生成[1],其中PMN细胞颗粒物质中释放的活性形式的基质金属蛋白酶-9(matrix metalloproteinases-9,MMP-9)与肿瘤侵袭、转移的启动密切相关[2]。众多细胞因子和趋化因子参与调控PMN的功能[3],白细胞介素-6(interleukin-6,IL-6)作为恶性肿瘤细胞和(或)肿瘤基质细胞能够分泌的炎性细胞因子[4],可能是诱导PMN释放颗粒物质的候选因子。STAT3(signal transducer and activator of transcription-3,STAT3)是信号转导与激活转录家族蛋白成员,被认为是炎症相关肿瘤发生中的主要调控因子[5]。有文献指出骨髓源性细胞中STAT3信号通路在诱导MMP-9的表达中起作用[6]。本研究以小鼠骨髓PMN为研究模型,观察IL-6刺激后PMN中MMP-9的生成及释放情况,及STAT3信号通路特异性抑制剂对MMP-9生成及释放的影响,为防治PMN相关的肿瘤侵袭转移提供理论依据。
1 材料与方法 1.1 动物及主要试剂6~8周龄雌性BALB/c小鼠,体质量18~20 g,购于湖北省医学实验动物中心。RPMI 1640培养液(美国Gibco公司),胎牛血清(杭州四季青生物工程有限公司),PE标记的抗小鼠Ly6G荧光抗体和PE-Cy7标记的抗小鼠CD1b抗体(美国eBioscience公司),TRIzol(美国Invitrogen公司),反转录试剂盒(日本Toyobo公司),SYBR Premix Ex TaqTM 试剂盒(日本Takara公司),Percoll细胞分离液(美国GE公司),抗STAT3蛋白抗体(美国Santa Cruz 公司),STAT3 inhibitor Ⅷ(美国Sigma公司),IL-6细胞因子(美国Cell Signaling Technology公司),PCR反应所用引物为上海英俊生物公司合成。
1.2 主要仪器OLYMPUS-IX71 显微镜(日本Olympus公司),Mini-PROTEIN II Electrophoresis Cell电泳仪(美国Bio- Rad公司),Eppendorf 5417R低温高速离心机(德国Eppendorf公司),Mx3000P实时定量荧光PCR仪(美国Stratagene公司),UV-1601紫外可见分光光度计(日本岛津公司)。
1.3 分离获取小鼠骨髓中性粒细胞颈椎脱臼处死小鼠,取其股骨和胫骨,注射器插入两端膨大处冲洗获取小鼠骨髓细胞悬液。按照Percoll说明书配置体积比为54%、64%、72%的应用液,3 000 r/min,无制动梯度离心30 min,小心吸取64%与72%两层之间的细胞即为骨髓PMN。锥虫蓝染色鉴定细胞活力>99%,流式细胞术检测细胞纯度≥95%。
1.4 IL-6体外刺激骨髓中性粒细胞及特异性STAT3信号通路抑制剂STAT3 inhibitor Ⅷ的使用IL-6浓度为50 ng/ml,STAT3 inhibitor Ⅷ浓度为50 μmol/L,粉剂用DMSO稀释,体外刺激4 h。
1.5 SYBR green实时荧光定量聚合酶链式反应检测细胞中MMP-9 mRNA表达按照TRIzol说明书提取PMN中总RNA,取1 μg总RNA用于反转录,反转录按照反转录酶试剂说明操作。反应所用引物序列:MMP-9:上游引物:5'-TGCCCAGCGACCACAACTC-3',下游引物:5'-CGGACCCGAAGC-GGACATT-3'。内参β-actin:上游引物:5'-TGTCCCTG- TATGCCTCTGG-3',下游引物:5'-CCTTTAGCACGCACTGTAG-3'。反应条件:94℃预变性5 min,94℃变性30 s,60℃退火30 s,72℃延伸1 min,30个循环,72℃持续10 min。β-actin作为内参基因,MMP-9对β-actin的相对表达量用倍数表示,计算公式为 2-ΔΔCt。其中 CT值表示荧光信号强度达到设定阈值的循环数,ΔCT=CT目的基因-CT内参基因,ΔΔCT=ΔCT实验组- ΔCT对照组。
1.6 明胶酶谱检测细胞释放的MMP-9活性将PMN以每毫升5×106个的浓度在RPMI 1640培养液中37℃培养4 h,实验分组分为对照组、IL-6刺激组、STAT3 inhibitor Ⅷ组和IL-6+STAT3 inhibitor Ⅷ组,培养结束后收集培养上清液。将样品进行SDS-聚丙烯酰胺(SDS-PAGE,含0.1%明胶)电泳分离,然后在有二价金属离子存在的缓冲系统中使样品中的MMP-9复性水解明胶,最后用考马斯亮蓝染色、脱色,观察条带情况。
1.7 Western blot检测细胞中STAT3总蛋白及磷酸化蛋白表达提取培养细胞的总蛋白,测定样品蛋白浓度。取各组不同组分蛋白样品60 μg,10%聚丙烯酰胺凝胶电泳后电转移膜,加入稀释后的一抗4℃孵育过夜,特异性二抗及生物素-链霉菌抗生物素蛋白-过氧化酶室温孵育1 h,用质量分数0.05%二氨基联苯胺缓冲液避光显色。灰度扫描半定量各条带灰度值,分别用β-actin校正后计算各组质相对对照组的变化。
1.8 统计学方法所有实验数据均应用SPSS17.0统计学软件处理。P<0.05为差异有统计学意义。
2 结果 2.1 PMN纯度检测流式细胞术结果显示,经过Percoll密度梯度离心法分离的小鼠骨髓PMN的纯度≥95%,见图 1。

|
| 图 1 小鼠骨髓PMN纯度鉴定 Fig. 1 Purity identification of murine bone marrow neutrophils |
RT-PCR结果显示,与空白对照组相比,IL-6刺激组中PMN中MMP-9的mRNA水平明显增加,差异有统计学意义(P=0.0050),当用STAT3特异性抑制剂STAT3 inhibitor Ⅷ抑制其激活后能够较为明显的抑制IL-6的作用,差异有统计学意义(P=0.0067)。上述结果说明,IL-6能够增加骨髓PMN中MMP-9 mRNA的表达,该作用可能是通过STAT3信号途径的激活发挥作用的,见图 2。
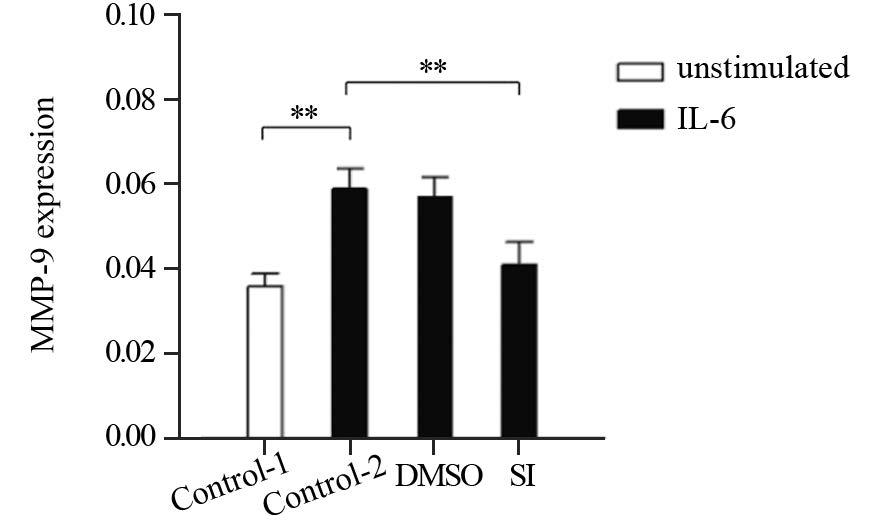
|
| Control-1: blank control; Control-2: 50ng/ml IL-6; DMSO: 50ng/ml IL-6+DMSO; SI: 50ng/ml IL-6+50μmol/L STAT3 inhibitor Ⅷ; **: P<0.01 图 2 IL-6刺激后PMN中MMP-9 mRNA水平 Fig. 2 MMP-9 mRNA level in neutrophils after IL-6 stimulation |
明胶酶谱结果显示,与空白对照组相比,IL-6刺激组上清液中活性MMP-9明显增加(P=0.0087),当用STAT3特异性抑制剂STAT3 inhibitor Ⅷ抑制其激活后能够较为明显的抑制IL-6的作用(P=0.048)。上述结果说明,IL-6能够增加骨髓PMN中MMP-9的释放,该作用可能是通过STAT3信号途径的激活发挥作用的,见图 3。
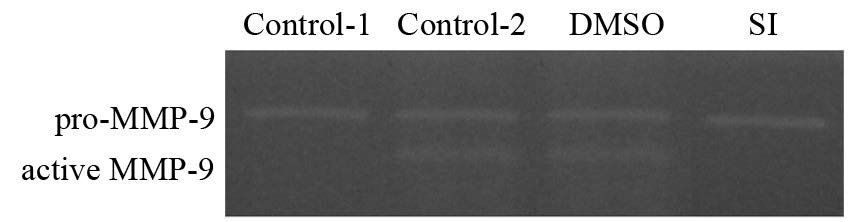
|
| 图 3 IL-6刺激后PMN释放MMP-9活性的检测 Fig. 3 Activity of MMP-9 released from neutrophils after IL-6 stimulation |
Western blot法检测了PMN中STAT3信号通路的激活情况,结果显示与空白对照组相比,IL-6刺激组中PMN中磷酸化的STAT3水平明显增加,差异有统计学意义(P=0.0089),当用STAT3特异性抑制剂STAT3 inhibitor Ⅷ抑制其激活后能够较为明显的抑制IL-6的作用,差异有统计学意义(P=0.0098)。上述结果说明,IL-6能够激活骨髓PMN中的STAT3信号通路,见图 4。
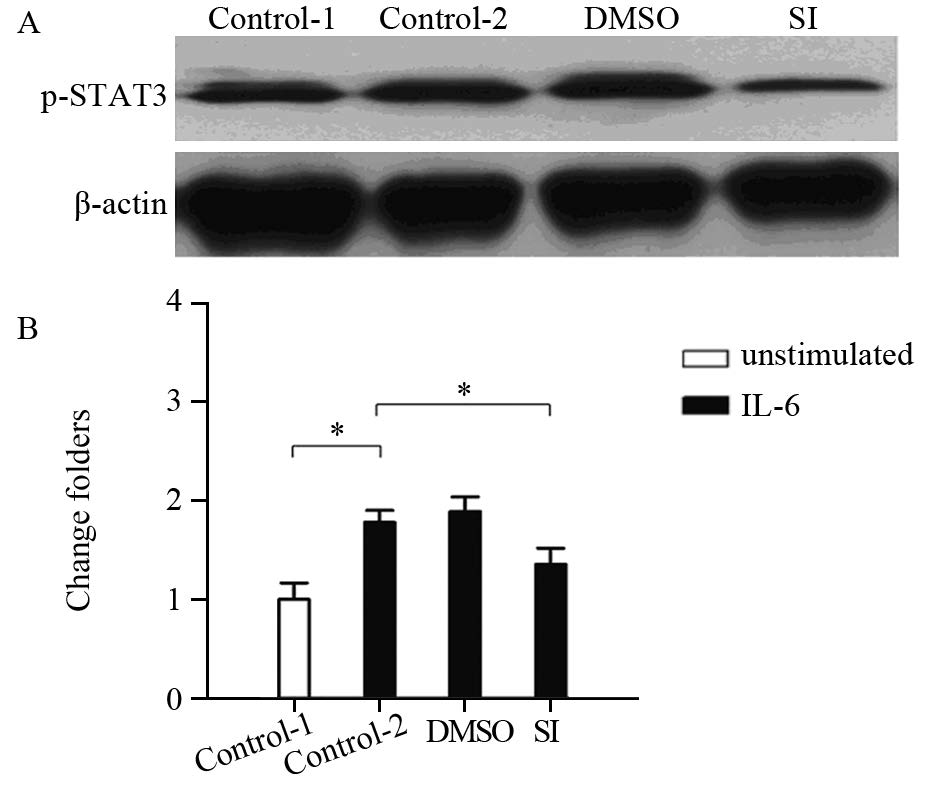
|
| A: Western blot assay; B: the ratios of phospho-STAT3 to β-actin were calculated after densitometric analysis of Western blot; *: P<0.05 图 4 IL-6刺激PMN后STAT3信号通路的激活检测 Fig. 4 Activation of STAT3 pathway in neutrophils after IL-6 stimulation |
肿瘤微环境中除肿瘤细胞外,一半以上的成分为肿瘤相关免疫细胞,免疫细胞的浸润在肿瘤的发生、发展和转移中发挥重要作用。在这些免疫细胞中,多形核中性粒细胞(polymorphonuclear neutrophils,PMN)占有很高的比例,作为肿瘤中浸润的炎性细胞促进肿瘤细胞生长、转移以及启动和加速肿瘤血管生成[1]。
MMP-9是一种Ⅳ型胶原酶,在肿瘤的侵袭、转移中起到独立的关键性作用,MMP-9对细胞外基质的降解和重构可引发血管生成因子如VEGF、FGF2的释放,从而促进肿瘤血管生成[7]。Schröer等报道了骨髓源性细胞释放的MMP-9对肿瘤的促进作用[6]。在小鼠RIP1-Tag2胰腺肿瘤模型中,用特异性抗体耗竭中性粒细胞后,VEGF的活性降低、肿瘤血管生成减少[8]。MMP-9的活性受到基质金属蛋白酶组织抑制因子(tissue inhibitors of metalloproteinases,TIMPs)的抑制[2]。肿瘤微环境中的多种细胞均能表达MMP-9,和其他细胞不同的是,PMN不表达TIMPs,因此能够释放不含有TIMP的活性形式的MMP-9[2],这些活性形式的MMP-9一旦由细胞分泌至胞外,能够立即释放基底膜中的血管生成因子VEGF,重构基底膜从而促进肿瘤的侵袭转移,PMN与其他炎性细胞的该不同点使得PMN释放的MMP-9成为肿瘤侵袭转移的启动因素。
IL-6已知能够促进PMN的生成,且能够诱导PMN的促瘤功能[9]。在多种恶性肿瘤中均能检测到血清中IL-6的水平升高,且其升高与患者的不良预后密切相关[10]。IL-6主要通过激活PMN中的STAT3信号通路发挥其病理生理作用[11],STAT3信号通路在调控PMN功能中起到重要作用[9]。已有研究结果证实了STAT3能够负性调控PMN对肿瘤细胞的细胞毒性作用[12],而当STAT3表达和激活增加时,PMN表现出促进血管生成的作用[13]。本研究结果显示IL-6能够上调PMN中MMP-9 mRNA水平和MMP-9释放,并且该作用是通过STAT3信号通路的激活调控的,用STAT3信号通路抑制剂抑制STAT3的磷酸化后,IL-6的上述作用消失。这表明IL-6引起的PMN中MMP-9的生成及释放增加受STAT3信号通路激活的调控,抑制STAT3通路的激活可显著抑制PMN中MMP-9的活性。
肿瘤的第八大特征为慢性炎症环境,PMN作为机体中数量最多的炎性细胞在肿瘤中的作用日益受到研究者的重视。MMP-9是重构基底膜的重要水解酶,在PMN促进肿瘤侵袭转移中发挥重要作用,抑制其激活可能会延缓肿瘤的进展,本研究为防治PMN参与的肿瘤血管生成提供了新的思路。
| [1] | Houghton AM. The paradox of tumor-associated neutrophils: fueling tumor growth with cytotoxic substances[J]. Cell Cycle, 2010, 9(9): 1732-7. |
| [2] | Bekes EM, Schweighofer B, Kupriyanova TA, et al. Tumor-recruited neutrophils and neutrophil TIMP-free MMP-9 regulate coordinately the levels of tumor angiogenesis and efficiency of malignant cell intravasation[J]. Am J Pathol, 2011, 179(3): 1455-70. |
| [3] | Sun R, Luo J, Li D, et al. Neutrophils with protumor potential could efficiently suppress tumor growth after cytokine priming and in presence of normal NK cells[J]. Oncotarget, 2014, 5(24): 12621-34. |
| [4] | Scherzad A, Steber M, Gehrke T, et al. Human mesenchymal stem cells enhance cancer cell proliferation via IL-6 secretion and activation of ERK1/2[J]. Int J Oncol, 2015, 47(1): 391-7. |
| [5] | Sen M, Pollock NI, Black J, et al. JAK kinase inhibition abrogates STAT3 activation and head and neck squamous cell carcinoma tumor growth[J]. Neoplasia, 2015, 17(3): 256-64. |
| [6] | Schröer N, Pahne J, Walch B, et al. Molecular pathobiology of human cervical high-grade lesions: paracrine STAT3 activation in tumor-instructed myeloid cells drives local MMP-9 expression[J]. Cancer Res, 2011, 71(1): 87-97. |
| [7] | Kessenbrock K, Plaks V, Werb Z. Matrix metalloproteinases: regulators of the tumor microenvironment[J]. Cell, 2010, 141(1): 52-67. |
| [8] | Nozawa H, Chiu C, Hanahan D. Infiltrating neutrophils mediate the initial angiogenic switch in a mouse model of multistage carcinogenesis[J]. Proc Natl Acad Sci U S A, 2006, 103(33): 12493-8. |
| [9] | Wang Y, Wang K, Han GC, et al. Neutrophil infiltration favors colitis-associated tumorigenesis by activating the interleukin-1 (IL-1)/IL-6 axis[J]. Mucosal Immunol, 2014, 7(5): 1106-15. |
| [10] | Nikakhlagh S, Ranjbari N, Khorami E, et al. Association between Serum Levels of Interleukin-6 and Stage of Laryngeal Cancer[J]. Iran J Otorhinolaryngol, 2015, 27(80): 199-205. |
| [11] | Fielding CA, McLoughlin RM, McLeod L, et al. IL-6 regulates neutrophil trafficking during acute inflammation via STAT3[J]. J Immunol, 2008, 181(3): 2189-95. |
| [12] | Tkach M, Coria L, Rosemblit C, et al. Targeting Stat3 induces senescence in tumor cells and elicits prophylactic and therapeutic immune responses against breast cancer growth mediated by NK cells and CD4+ T cells[J]. J Immunol, 2012, 189(3): 1162-72. |
| [13] | Yan B, Wei JJ, Yuan Y, et al. IL-6 cooperates with G-CSF to induce protumor function of neutrophils in bone marrow by enhancing STAT3 activation[J]. J Immunol, 2013, 190(11): 5882-93. |
 2016, Vol. 43
2016, Vol. 43


