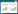文章信息
- 曾治民, 钟琼, 何静, 欧阳玉茗, 肖震宇, 刘安文.
- ZENG Zhimin, ZHONG Qiong, HE Jing, OUYANG Yuming, XIAO Zhenyu, LIU Anwen.
- Toll样受体4的表达及miR-TLR4干扰对HBV相关肝癌细胞生物学活性的影响
- Expression of Toll-like Receptor 4 and Impact of miR-TLR4 Interference on Biological Activity of HBV-related Hepatocellular Carcinoma Cells
- 肿瘤防治研究, 2016, 43(02): 116-122
- Cancer Research on Prevention and Treatment, 2016, 43(02): 116-122
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.02.005
-
文章历史
- 收稿日期: 2015-05-07
- 修回日期: 2015-06-12
2. 330006 南昌,南昌大学第二附属医院肿瘤科
2. Department of Oncology,The Second Affiliated Hospital of Nangchang University,Nanchang 330006,China
70%~85%的原发性肝癌为肝细胞肝癌(hepatocellular carcinoma,HCC),其中我国肝细胞肝癌患者约占全世界的55%[1]。过去几十年,HBV致病机制方面已取得大量研究成果[2]。但HBV相关肝癌发生发展的具体分子机制仍有待进一步研究。
Toll样受体(Toll like receptors,TLRs)属于病原模式识别受体,在机体天然免疫反应及诱发的获得性免疫反应中起重要作用[3]。近年大量研究表明不同组织起源的恶性肿瘤细胞高表达不同种类的TLRs[4, 5]。TLRs下游存在多个与肿瘤相关的重要信号分子[6]。肝细胞及肝癌细胞也表达多种TLRs[7, 8];而HBV感染患者外周血单核细胞TLR1、TLR2、TLR4和TLR6表达下调[9]。以上研究表明TLRs在肝炎及肝细胞肝癌发生过程中起一定作用。动物实验也表明肝细胞可通过TLRs激活Kuffer细胞诱导促炎因子和肝细胞的有丝分裂,促进HCC的发生[10]。肝细胞肝癌与TLRs关系密切,但是有关TLRs在HBV相关肝癌发生及可能的信号途径研究较少。
在前期研究中,我们通过人全基因组cDNA芯片技术以及对400例HCC蜡块标本和四种肝癌细胞研究发现MAP4K4在HCC组织及细胞中均有高表达,且表达水平与血清HBV感染状态、转移及预后密切相关。而MAP4K4基因敲减后下调TLRs及其下游基因的表达,我们推测MAP4K4可能通过反馈调节TLRs及其下游信号转导途径发挥作用而促进肝癌细胞生长[11]。我们假设TLR4可能参与了HBV相关肝癌的发生。本研究检测了TLR4在肝癌细胞系中的表达,构建miR-TLR4质粒干扰肝癌细胞TLR4表达,研究TLR4在体外对HCC细胞生物学行为的影响。
1 材料与方法 1.1 实验细胞株乙肝病毒阳性肝癌Hep3B,HepG2.2.15(分泌HBV DNA)细胞株,乙肝病毒阴性肝癌HepG2、SMMC7721及Huh7细胞株来源于江西省分子重点实验室。
1.2 细胞培养人HepG2、Huh7、SMMC7721用DMEM培养液(北京Solarbio公司)培养,HepG2.2.15用含G418的DMEM培养液培养,Hep3B用MEM培养液(美国Gibco公司)培养,置于37℃、5%CO2培养箱中培养。取对数生长期细胞用于后续实验。
1.3 Western blot法检测TLR4表达收集5组实验细胞,运用蛋白抽提试剂盒(北京普利莱试剂盒)抽提纯化蛋白质,BCA法测定蛋白浓度。配制10%的SDS分离胶(制胶试剂盒,中国碧云天生物技术公司)、上样、电泳、转膜至硝酸纤维膜、室温封闭2 h,兔抗TLR4抗体(Santa Cruz公司)与一抗稀释液以1:250比例稀释4℃过夜,辣根过氧化物羊抗兔IgG(二抗,北京中杉金桥公司)与封闭液按1:5 000比例稀释免疫反应,洗涤后曝光、显影、定影。胶片拍照,用Bander Leader软件分析目的条带。选取TLR4蛋白表达最高的乙肝病毒阳性细胞株行后续实验。
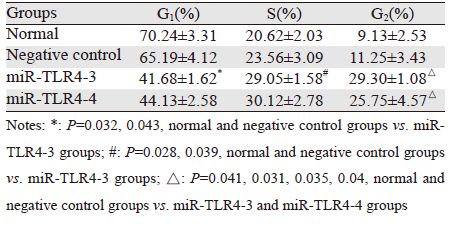
1.4 细胞转染由上海Invitrogen公司设计构建四个miR-TLR4质粒及一个阴性对照质粒,并转化入大肠杆菌,见表 1、图 1。向5个烧瓶中各加入100 ml LB培养液,然后分别加入1、2、3、4号及阴性对照菌液各1 ml,置于水平摇床内37℃恒温、250 r/min恒速摇菌过夜(约12~16 h)。获得大量菌体后运用质粒大提试剂盒(美国TIANGEN公司)纠集纯化质粒。经1.0%琼脂糖胶电泳2 h,验证纯化质粒,从正极往负极分别是闭环形、开环形和线性质粒,以有功能的闭环为主,说明质粒较纯,见图 2。Lipofectamine2000法转染各组细胞,每组加入质粒各8 μg,24~48 h后荧光显微镜下观察转染效率。收集细胞进行生物学指标检测。
|
| 图 1 pcDNA6.2-GW/EmGFP-miR图谱 Fig. 1 pcDNA6.2-GW/EmGFP-miR |

|
| 图 2 miR-TLR4质粒及阴性对照质粒电泳图 Fig. 2 Electropherogram of miR-TLR4 and negative control plasimds |
收集正常组及各转染组细胞,抽提细胞总蛋白,Western blot检测转染后细胞TLR4蛋白表达,方法同前。选取干扰TLR4基因效果明显的质粒进行后续转染及实验。
1.6 MTT法细胞生长线按10 000/孔的密度接种于4块96孔培养板中,分正常组、对照组、及3、4号转染组,每组设5个复孔,同时设置调零孔。转染后0、24、48、72 h分别取出一块96孔板进行MTT实验。调节酶联免疫检测仪,检测490 nm波长时各孔的吸光度值,以各组测得的OD值为纵坐标、时间为横坐标绘制细胞生长曲线,实验重复三次。
1.7 克隆平板形成实验对数期生长的正常组、对照组、及3、4号转染组按1 000/孔接种于六孔培养板中,每组设置3个复孔,然后十字法轻轻晃动使单个细胞分散均匀,放入37℃、5%CO2培养箱中培养14~15 d,每3~5天观察一次。固定后染色,自然晾干并计数10个低倍镜视野,大于50个细胞的克隆数,取平均值。按公式计算克隆形成率(%):克隆形成率=克隆数/接种细胞数×100%。实验重复三次。
1.8 细胞周期检测及细胞凋亡率用不含EDTA的胰酶消化收集正常组及各转染组细胞,PBS洗涤三遍。加入100 μl RNase A溶液重悬细胞,37℃水浴30 min。加入400 μl PI染液,充分混匀,4℃避光孵育30 min后流式细胞仪检测细胞周期(南京凯基公司)。实验重复三次。
用不含EDTA的胰酶消化收集各组细胞,PBS洗三遍。用500 μl Binding Buffer重悬细胞,加入5 μl Annexin V-FITC充分混匀后,再加5 μl PI染液混匀,同时设置调零孔(不加Annexin V和PI染液)。室温下避光孵育15 min。Annexin V-PI法(南京凯基公司)流式细胞仪(美国BD公司)检测。实验重复三次。
1.9 统计学方法用SPSS17.0进行统计学分析。数据均以(x±s)表示,采用方差分析,组间比较用t检验,P<0.05为差异有统计学意义。
2 结果 2.1 肝癌细胞株中TLR4蛋白的表达TLR4蛋白在五种肝癌细胞株(SMM7721、Huh7、Hep3B、HepG2.2.15和HepG2)中均有表达,在Hep3B细胞中表达最高,其次是SMMC7721、HepG2.2.15和HepG2细胞,而在Huh7细胞中表达最低,见图 3。

|
| A: expression of TLR4 and β-actin; B: corresponding histogram of TLR4/β-actin; Hep3B vs. SMMC7721,HepG2.2.15,Huh7,HepG2: P=0.029,0.015,0.017,0.026,respectively 图 3 TLR4蛋白在五种肝癌细胞中的表达 Fig. 3 Expression of TLR4 protein in five hepatocellular carcinoma (HCC) cells |
根据Western blot检测五种肝癌细胞中TLR4蛋白的表达情况,选择表达最高的HBV阳性细胞株Hep3B作为后续实验的研究对象。
2.2.1 转染效率检测
细胞转染后24 h,在荧光显微镜下观察正常组、阴性对照组、干扰质粒3、质粒4组的绿色荧光蛋白的表达情况,正常组因无质粒无荧光,其他三组均显示绿色荧光,表明转染成功,见图 4。为保证转染后干扰效率,每次实验前每组转染效率保证不低于40%。
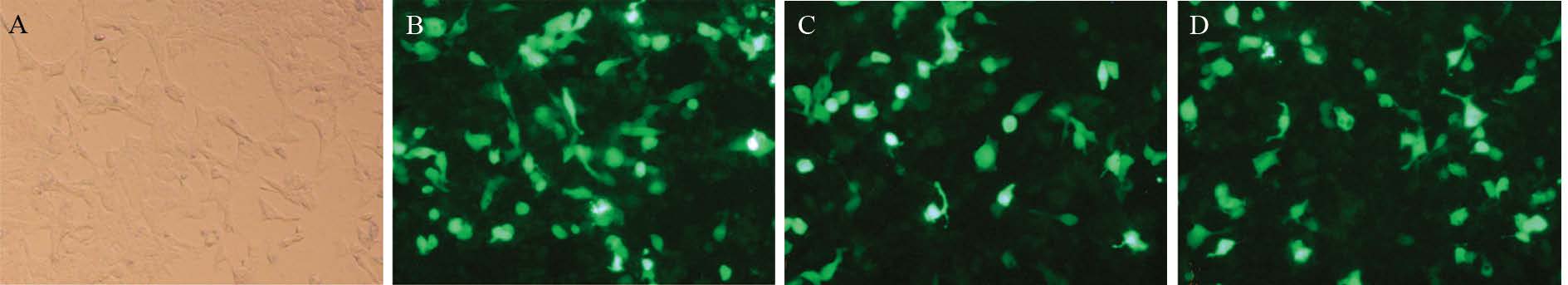
|
| A: normal group; B: negative control group; C: miR-TLR4-3 group; D: miR-TLR4-4 group 图 4 荧光显微镜下观察转染miR-TLR4质粒24h后各组绿色荧光蛋白的表达情况 (×200) Fig. 4 Green fluorescent protein expression of Hep3B cells transfected with miR-TLR4 plasmid after 24h detected by fluorescent microscope (×200) |
blot检测干扰效果
与正常组和阴性对照组相比,转染干扰片段1、2后,Hep3B细胞中TLR4蛋白表达量无明显下降(P>0.05);而转染片段3、4后,TLR4蛋白表达明显下降(分别降低了44%和35%,P<0.05),说明1、2号质粒干扰效果欠佳,3、4号质粒干扰效果良好,见图 5。
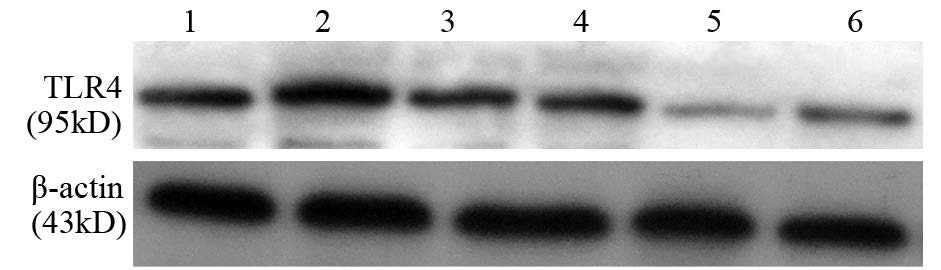
|
| 1: normal; 2: negative control; 3: miR-TLR4-1; 4: miR-TLR4-2; 5: miR-TLR4-3; 6: miR-TLR4-4; miR-TLR4-1 vs. normal and negative control groups: P=0.158,0.353; miR-TLR4-2 vs. normal and negative control groups: P=0.169,0.268; miR-TLR4-3 vs. normal and negative control groups: P=0.025,0.036; miR-TLR4-4 vs. normal and negative control groups: P=0.030,0.042 图 5 不同转染组Hep3B细胞中TLR4蛋白的表达 Fig. 5 TLR4 protein exprossion in Hep3B cells in different transfected groups |
根据4个干扰片段对TLR4表达的干扰效果,选取片段3、4转染Hep3B细胞进行生物学活性的研究。
2.3.1 干扰TLR4表达对Hep3B细胞增殖能力的影响
从生长曲线可以看出,转染干扰片段3、4后,24及48 h段Hep3B细胞的生长增殖能力明显受到抑制,见图 6。同样,克隆平板实验结果显示,转染干扰片段3、4后Hep3B细胞的克隆形成率分别为(20±0.19)%和(25±0.21)%,与正常组(52.1±0.09)%及阴性对照组(51±0.13)%相比差异有统计学意义,正常对照组与阴性对照相比差异无统计学意义(P=0.26),两组转染组之间差异无统计学意义(P=0.18),见图 7。
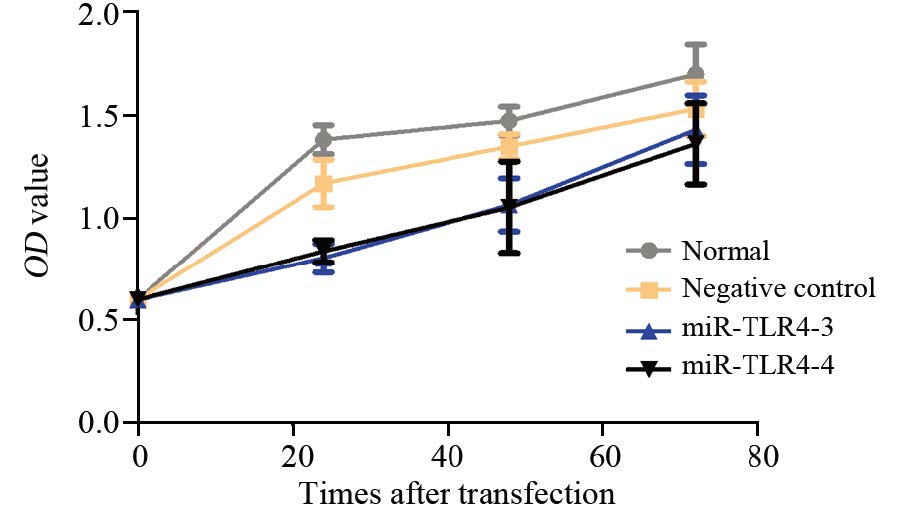
|
| miR-TLR4-3 vs. normal and negative control groups at 24h: P=0.011,0.026; miR-TLR4-4 vs. normal and negative control groups: P=0.025,0.028 图 6 不同转染组细胞的生长曲线 Fig. 6 Cell growth curves of different transfected groups |
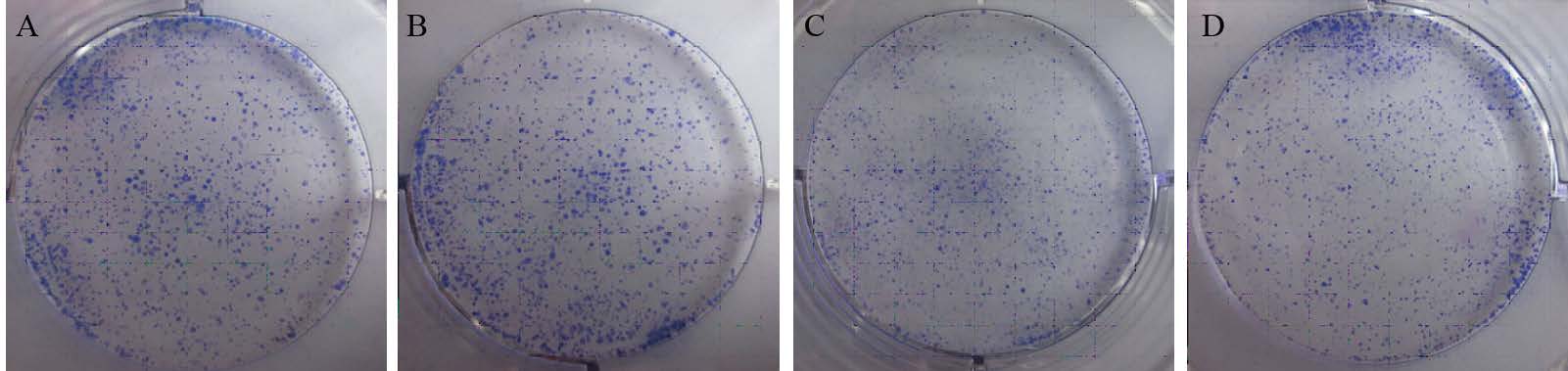
|
| A: normal group; B: negative control group; C: miR-TLR4-3 group; D: miR-TLR4-4 group;miR-TLR4-3 vs. normal and negative control groups: P=0.018,0.010; miR-TLR4-4 vs. normal and negative control groups: P=0.021,0.035 图 7 不同转染组细胞克隆平板形成结果 Fig. 7 Results of flat plate clone formation of different transfected groups |
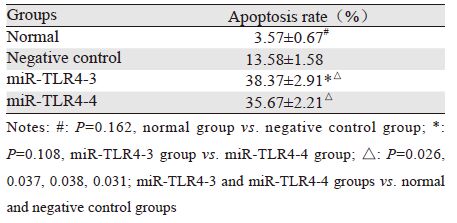
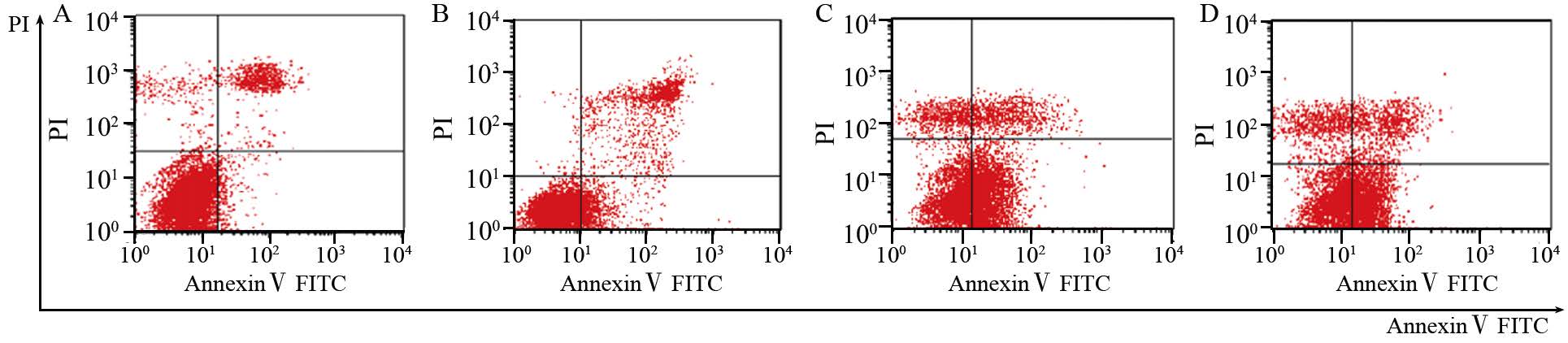
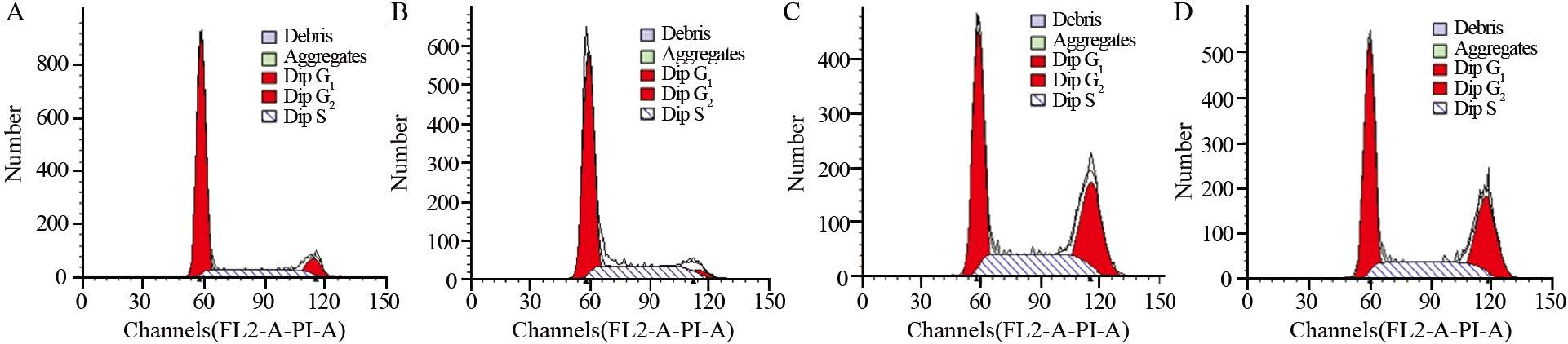
与正常组及阴性对照组相比,转染干扰片段3、4后Hep3B细胞凋亡率明显上升。虽然阴性对照组相比正常对照组凋亡稍增加,干扰组3和4对正常组以及阴性对照组差异均较明显,这就可排除质粒引起凋亡为主要原因这一误差(P<0.05),见表 2、图 8。另外,细胞周期检测结果显示,干扰TLR4表达后S、G2期细胞比列明显增加(P<0.05),G1期细胞比例减少,周期阻滞于G2/M期(P<0.05),见表 3、图 9。
|
| A: normal group; B: negative control group; C: miR-TLR4-3 group; D: miR-TLR4-4 group 图 8 不同TLR4干扰组细胞凋亡结果 Fig. 8 Cell apoptosis in different miR-TLR4 groups |
|
| A: normal group; B: negative control group; C: miR-TLR4-3 group; D: miR-TLR4-4 group 图 9 干扰TLR4后对Hep3B细胞细胞周期的影响 Fig. 9 Flow cytometer graph about influence of TLR4 interferen on Hep3B cell cycle |
基于我国乙型肝炎流行发病率高的现状,肝细胞肝癌大多由HBV感染后慢性肝炎肝硬化发展而来。大量证据表明局部炎症与肿瘤发生有关,如胃癌与HP感染所致的慢性胃炎、肝癌与肝炎(病毒性或非病毒性)、结肠癌与溃疡性结肠炎,因为炎症与肿瘤的发生发展有共同通路[3, 12]。Toll样受体属于病原微生物识别受体,信号激活能引发促炎及抗炎因子的产生而发挥相应生物学作用。TLR4信号通路是较为复杂的一条通路,其下游分子有:MyD88、MAL/TIRAP、TRIF、TRAM和IRF-3,因此激活后既能经MyD88依赖性途径又能经TRIF介导的非MyD88依赖途径介导下游IkB激酶及MAPK等激活多种转录因子,产生IL、IFN-β、TNF-α等因子[13]。本研究对目前HBV相关肝癌及非HBV相关两大类肝癌细胞系进行TLR4表达的检测,并通过siRNA质粒干扰技术研究TLR4受干扰后肝癌细胞系增殖及周期凋亡的影响。
本研究发现HBV相关肝癌细胞系Hep3B在蛋白表达水平较其他肝癌细胞系显著增高,其他依次为SMMC7721、HepG2.2.15、HepG2。根据美国ATCC官网及SMMC7721细胞建系的特征,Hep3B细胞及HepG2.2.15细胞系与HBV相关。本研究的实验发现TLR4在HepG2.2.15表达稍低,我们猜测可能原因是此细胞系是HBV稳定转染的细胞系,相当于细胞急性感染了HBV。HepG2.2.15类似急性肝炎,而Hep3B自身携带,相当于长期的慢性感染,而TLR4的上调也许跟HBV的长期作用有关。来自Wei等[7]研究发现:慢性肝炎患者组织标本TLR4表达较正常肝组织高,且与慢性病理分级正相关;运用qPCR技术发现HepG2.2.15细胞TLR4 mRNA< span class="罗马字体 CharOverride-1">水平表达高于HepG2细胞系,得出慢性肝炎患者及HBV相关肝癌细胞系TLR4表达相对较高。我们的结果与Wei等[7]一致,皆发现HepG2.2.15细胞TLR4表达高于HepG2细胞系,但我们是在蛋白水平研究了多种肝癌细胞系的表达水平。另外,Jing等运用qPCR检测发现SMMC7721,Hep3B细胞TLR4表达稍高,而HepG2及Huh7细胞则相对较弱,与本研究结果基本一致,但其结果显示SMMC7721细胞TLR4表达最高[14]。TLR4配体LPS促进HepG2.2.15等肝癌细胞系的黏附及侵袭[15]。因此TLR4信号势必对肝癌细胞增殖等有一定影响。本研究发现TLR4在HBV相关肝细胞肝癌中表达高于非HBV相关肝癌细胞,我们选取了HBV相关的Hep3B细胞系进行干扰TLR4表达后,对比生长增殖及凋亡周期等方面的实验。
脂质体即时干扰法干扰Hep3B细胞TLR4表达后,MTT法检测细胞生长曲线显示干扰组24~48h细胞生长明显受抑制,干扰组细胞克隆平板实验显示克隆形成率较正常对照或阴性对照组低,进一步的Annexin V-PI检测凋亡结果示:与正常组及阴性对照组相比,转染干扰片段3、4后Hep3B细胞凋亡率明显上升。这些结果表明,TLR4信号通路对Hep3B细胞的生长增殖有促进作用,且可抑制癌细胞凋亡。然而,目前TLR4信号通路对肝癌细胞的具体机制尚不完全明确。Yu等[10]设计的C57BL/6鼠肝炎肝硬化肝癌的动物模型显示:实验模型中运用抗生素减少肠源性LPS产生或基因敲除鼠TLR4基因后可一定程度阻止肿瘤倍增,重建鼠髓源性TLR4表达可再次出现肝细胞炎及促肿瘤增殖。其结果表明LPS-TLR4-TNF-α及IL-6途径协同致癌因子致肝癌[10]。另一动物实验发现,TLR4mut C3H/HeJ鼠成瘤数量及大小均较野生型低,且鼠无菌化后给予LPS注射可促进肝癌生长。进一步的基因芯片实验表明,肝星状细胞经TLR4信号通路调节上皮调节蛋白(Epiregulin)的表达而促肝癌增殖且抗凋亡[12]。近来一体内外实验表明LPS-TLR4-NF-κB信号通路诱导多种肝癌细胞系上皮细胞间质转移,与肝癌转移有关[14]。以上研究都认为肝癌细胞或肝星状细胞表达TLR4与内毒素共同作用产生炎性介质影响肝癌的发生发展。
肝炎病毒(HBV/HCV)增加肝癌发病风险。HCV感染及癌变后TLR4表达增高。Machida等研究了TLR4在HCV相关肝癌间的关系,证实干细胞标志基因Nanog是TLR4信号通路的下游靶点,乙醇饲养鼠所致毒性可协同NS5A - TLR4 -Nanog通路致肝癌发生[16, 17]。有报道TLR4通路也与非酒精性脂肪性肝炎等疾病有关,肠肝循环中来自肠道的毒素可激活TLR4通路,而持续的炎症可致肝癌[18, 19]。以上研究皆可认为炎症相关通路与肿瘤发生有关,但目前TLR4分子通路在肝癌发生发展的确切机制尚不完全明确。TLR4在HBV相关肝癌中的作用机制较少报道。我们的研究发现TLR4在HBV相关肝癌细胞表达增高,并且干扰其表达后肝癌细胞系增殖受限、凋亡率增加。这提示HBV致肝癌的过程中可能由TLR4信号通路参与,且TLR4引发的下游信号有促增殖、抑凋亡的可能,但尚须进一步的实验研究。
多种致癌或促癌基因参与肝癌的发生,其中周期调节基因起重要作用。相对于正常肝组织,多种促癌基因、与增殖凋亡周期有关的信号通路以及血管生成基因于肝癌组织过表达,如cyclins(A2、B1、E1和G1)、周期依赖性激酶CDK1、8、9、10、Epiregulin等在肝癌组织及细胞中过表达,周期负性调节因子p27、p53、Pten表达降低[12]。本研究运用流式法检测细胞周期法结果显示,干扰TLR4表达后S、G2期细胞比列明显增加(P<0.05),G1期细胞比例减少(P<0.05),周期阻滞于G2/M。这表明,TLR4信号通路可能对细胞周期有一定的影响,具体机制可能是TLR4激活下游信号进而影响上述一个或数个基因。
本研究提示TLR4信号通路对HBV相关肝细胞肝癌生长有一定影响。Toll样受体家族中,除与TLR4有关外,有报道TLR3及TLR9引发的信号通路对肝细胞肝癌有一定影响。TLR3识别双链RNA,经TRIF介导细胞激活转录因子NF-κB和IRF3分泌IFN-β,产生抗病毒双键RNA效应。在肝癌Huh7及HepG2细胞系TLR3激活所致的IRF3活性较低[20]。HepG2细胞TLR3激活后促炎效应较轻,而产生Caspase-3促凋亡因子致癌细胞倾向于凋亡[20]。HBV及其融合蛋白HBX在HBV相关肝细胞肝癌的发生发展中起重要作用,其具体分子机制方面已取得重要进展。慢性乙肝患者肝脏组织及多种肝癌细胞系表达TLR9[8]。近来有研究报道发现TLR9参与肝癌的发生,可能机制是细胞表达了癌变相关基因或抑凋亡因子增加,如:DNA甲基转移酶1(DNMT-1)和 BCL-2表达上调[21]。然而TLRs在HBV相关肝癌中的作用,何种Toll样受体起主导作用尚不明确。
综上所述,本研究发现乙肝病毒相关肝癌细胞中TLR4表达上调,干扰Hep3B细胞系TLR4表达后,对细胞生长增殖及凋亡周期有一定影响,TLR4信号通路可能与HBV协同作用影响肝细胞肝癌生长,其具体机制有待进一步研究。随着研究的深入,TLR4及其下游信号分子于肝癌发生发展中的作用机制将更加清晰明了,并将为HBV相关肝细胞癌的临床诊治寻找新靶点。
| [1] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. |
| [2] | Neuveut C, Wei Y, Buendia MA. Mechanisms of HBV-related hepatocarcinogenesis[J]. J Hepatology, 2010, 52(4): 594-604. |
| [3] | Zeng ZM, He J, Liu AW. The relationship between TLRs signaling and inflammation-related-cancers[J]. Zhongguo Ai Zheng Za Zhi, 2011, 21(6): 489-94. [曾治民, 何静, 刘安文. Toll样受体信号传导与炎症相关肿瘤的关系[J]. 中国癌症杂志, 2011, 21(6): 489-94.] |
| [4] | Chen R, Alvero AB, Silasi DA, et al. Cancers take their Toll--the function and regulation of Toll-like receptors in cancer cells[J].Oncogene, 2008, 27(2): 225-33. |
| [5] | Sato Y, Goto Y, Narita N, et al. Cancer cells expressing toll-like receptors and the tumor microenvironment[J].Cancer Microenvironment, 2009, Suppl 1: 205-14. |
| [6] | Maeda S. NF-κB, JNK, and TLR signaling pathways in hepatocarcinogenesis[J]. Gastroenterology Res Practice, 2010, 2010: 367694. |
| [7] | Wei XQ, GuoYW, Liu JJ, et al. The significance of Toll-like receptor 4 (TLR4) expression in patients with chronic hepatitis B[J]. Clin Invest Med, 2008, 31(3): E123-30. |
| [8] | Tanaka J, Sugimoto K, Shiraki K, et al. Functional cell surface expression of toll-like receptor 9 promotes cell proliferation and survival in human hepatocellular carcinomas[J]. Int J Oncol, 2010, 37(4): 805-14. |
| [9] | Chen Z, Cheng Y, Xu Y, et al. Expression profiles and function of Toll-like receptors 2 and 4 in peripheral blood mononuclear cells of chronic hepatitis B patients[J]. Clin Immunol, 2008, 128(3): 400-8. |
| [10] | Yu LX, Yan HX, Liu Q, et al. Endotoxin accumulation prevents carcinogen-induced apoptosis and promotes liver tumorigenesis in rodents[J]. Hepatology, 2010, 52(4): 1322-33. |
| [11] | Liu AW, Cai J, Zhao XL, et al. ShRNA-targeted MAP4K4 inhibits hepatocellular carcinoma growth[J]. Clin Cancer Res, 2011, 17(4): 710-20. |
| [12] | Dapito DH, Mencin A, Gwak GY, et al. Promotion of hepatocellular carcinoma by the intestinal microbiota and TLR4[J]. Cancer Cell, 2012, 21(4): 504-16. |
| [13] | Krishnan J, Selvarajoo K, Tsuchiya M, et al. Toll-like receptor signal transduction[J]. Exp Mol Med, 2007, 39(4): 421-38. |
| [14] | Jing YY, Han ZP, Sun K, et al. Toll-like receptor 4 signaling promotes epithelial-mesenchymal transition in human hepatocellular carcinoma induced by lipopolysaccharide[J]. BMC Med, 2012, 10: 98. |
| [15] | Liu X, Liang J, Li G. Lipopolysaccharide promotes adhesion and invasion of hepatoma cell lines HepG2 and HepG2.2.15[J]. Mol Biol Rep, 2010, 37(5): 2235-9. |
| [16] | Machida K, Tsukamoto H, Mkrtchyan H, et al. Toll-like receptor 4 mediates synergism between alcohol and HCV in hepatic oncogenesis involving stem cell marker Nanog[J]. Proc Natl Acad Sci USA, 2009, 106(5): 1548-53. |
| [17] | French SW, Oliva J, French BA, et al. Alcohol, nutrition and liver cancer: role of Toll-like receptor signaling[J]. World J Gastroenterology, 2010, 16(11): 1344-8. |
| [18] | Alisi A, Panera N, Nobili V. Toll-like receptor 4: a starting point for proinflammatory signals in fatty liver disease[J]. Hepatology, 2010, 51(2): 714-5. |
| [19] | Starley BQ, Calcagno CJ, Harrison SA. Nonalcoholic fatty liver disease and hepatocellular carcinoma: a weighty connection[J].Hepatology, 2010, 51(5): 1820-32. |
| [20] | Khvalevsky E, Rivkin L, Rachmilewitz J, et al. TLR3 signaling in a hepatoma cell line is skewed towards apoptosis[J]. J Cell Biochem, 2007, 100(5): 1301-12. |
| [21] | Liu X, Xu Q, Chen W, et al. Hepatitis B virus DNA-induced carcinogenesis of human normal liver cells by virtue of nonmethylated CpG DNA[J]. Oncol Rep, 2009, 21(4): 941-7. |
 2016, Vol. 43
2016, Vol. 43