文章信息
- 陶泽璋, 喻迪, 王鹏举, 陈晨, 李芬.
- TAO Zezhang, YU Di, WANG Pengju, CHEN Chen, LI Fen.
- 缩氨基硫脲类化合物DpC抗头颈肿瘤活性的体外研究
- In vitro Investigation of Antitumor Efficacy of DpC on Head and Neck Cancer
- 肿瘤防治研究, 2016, 43(02): 106-111
- Cancer Research on Prevention and Treatment, 2016, 43(02): 106-111
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.02.003
-
文章历史
- 收稿日期: 2015-09-08
- 修回日期: 2015-12-24
头颈肿瘤(HNC)是发生在上呼吸道及上消化道最常见的肿瘤,包括唇部、口腔、口咽、喉部、下咽部、唾液腺、鼻部、头面部软组织、甲状腺等部位肿瘤[1]。头颈肿瘤是全球发病率最高的恶性肿瘤之一,并且近年来呈增长趋势[2]。随着基础与临床研究的深入,头颈肿瘤的治疗手段多种多样,包括手术、放疗、化疗、生物治疗、中医等,但是头颈肿瘤的五年生存率并无明显的升高,并且手术、放化疗等主要的治疗手段严重降低了患者的生存质量[3]。
快速生长的癌细胞,较正常细胞而言对铁有着更高的需求[4, 5],并且癌细胞转铁蛋白受体1(TfR1)表达增高,以利于其从转铁蛋白中以更高的速率吸收铁[6],选择性地增加对铁的螯合[7]。目前已有研究表明,铁螯合剂通过隔离金属离子,可有效地起到抗肿瘤作用[2, 8]。
铁螯合剂di-2-pyridylketone thiosemicarbazone (DpT)被认为具有良好的抗肿瘤活性和选择性[9]。而di-2-pyridylketone-4,4,-dimethyl-3-thiosemicarbazone(Dp44mT)作为DpT中最有效的螯合剂之一,对小鼠的移植瘤表现出显著的选择性抑制作用[10, 11]。Di-2-pyridylketone-4-cyclohexyl-4-methyl-3-thiosemicarbazone(DpC)作为第二代铁螯合剂对小鼠的肺癌移植瘤的化疗表现出协同作用及潜在的抗肿瘤活性[12],并且相比第一代铁鳌合剂Dp44mT在对肿瘤的治疗中表现出更明显的优势[13]。目前还没有DpC和Dp44mT对头颈肿瘤的抗肿瘤活性研究,本研究采用了CCK-8、流式细胞术、蛋白印迹实验等方法,观察DpC与Dp44mT在头颈肿瘤中的抑制率及其作用通路,旨在阐明DpC对头颈肿瘤细胞系的体外抗肿瘤作用,并且进一步研究DpC的作用机制。
1 材料与方法 1.1 主要化学试剂DpC(Sigma-Aldrich,美国);Dp44mT(Sigma-Aldrich,美国);DMSO(Sigma-Aldrich,美国)(DpC和Dp44mT分别用DMSO溶解成浓度为20 mM的原液,保存在-20℃冰箱中);Cell Counting kit-8试剂盒(Dongji,日本);Annexin V-PI凋亡双染检测试剂盒(UNOCI,中国);抗体GAPDH、p-ATM、p-Chk-1、p-ATR、p-Chk-2、PARP、P-Histone H2AX、BRCA1、p-P53(Cell Signaling Technology,美国)
1.2 细胞培养头颈部鳞癌细胞系FaDu,Cal-27,SCC-9培养于添加了10%胎牛血清的培养液DMEM中,置于5%C2、37℃培养箱中培养。将处在对数生长期的细胞用于实验。
1.3 细胞毒性实验为了评估DpC和Dp44mT对HNC细胞系体外增殖的影响,应用CCK-8法进行了细胞活性实验。用特定浓度DpC(0、1、5、10、50 μmol/L)和Dp44MT(0、1、5、10、50 μmol/L)处理FaDu、Cal-27、SCC-9头颈部鳞癌细胞系24 h。将处在对数生长期的HNC细胞系FaDu、Cal-27、SCC-9分别以每孔1×103个细胞接种到96孔板中,用不同浓度的DpC(0、1、5、10、50 μmol/L)和Dp44mT(0、1、5、10、50 μmol/L)处理24 h后,将每孔10 μl的CCK-8加到96孔板中,37℃着色1 h后,使用酶标仪在450 nm波长下测定光密度值(OD值),并记录数据。DpC和Dp44MT对细胞活性抑制率=(OD处理组细胞/OD对照组细胞)×100%,并计算其IC50。
1.4 流式细胞术实验为了进一步测定DpC和Dp44mT对头颈肿瘤细胞体外凋亡的影响,我们进行了流式细胞术实验,将处于对数生长期的细胞FaDu、Cal-27、SCC-9分别用特定浓度的 DpC(0、2.5、5、7.5 μmol/L)和Dp44mT(0、2.5、5、7.5 μmol/L)处理24 h后,收集细胞,包括上清和贴壁的细胞,用PBS清洗两次后固定细胞,分别加入5 μl的FITC和10 μl的PI染色,流式细胞仪检测细胞凋亡,可被FITC/PI染上的为凋亡细胞。
1.5 蛋白质印迹实验与第一代铁鳌合剂Dp44mT相比,DpC对HNC细胞系的增殖、凋亡起到了更为重要的调节作用,并且在Cal-27细胞系中表现得更加明显。因此,通过蛋白印迹实验观察DpC对Cal-27细胞系的抑制作用中与增殖、凋亡相关的DNA损伤通路中几个重要蛋白表达发生的相应变化。用DpC(0、2.5、5、7.5 μmol/L)处理Cal-27细胞24 h后,分别收集各个浓度处理过的所有细胞,提取各个浓度的总蛋白后进行蛋白印迹实验,将蛋白样品通过电泳和电转到PVDF膜上,封闭液封闭2 h后敷上特定的一抗,如GAPDH、p-ATM、p-Chk-1、p-ATR、p-Chk-2、PARP、 P-Histone H2A.X、BRCA1、p-P53,在4℃冰箱过夜,TBST清洗三遍后将膜敷二抗1 h,最后用Odyssey的增强化学荧光扫描膜上的蛋白,Odyssey软件分析其谱带强度。所有展示的蛋白印迹均是3次独立试验中最有代表性的一组。
1.6 统计学方法用SPSS17.0软件进行统计学分析,计量资料两组间比较采用t检验,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 DpC和Dp44mT对头颈肿瘤细胞增殖的影响结果表明DpC和Dp44mT对人头颈肿瘤细胞均有抗增殖作用,且呈浓度依赖性,其中24 h时,DpC和Dp44mT的IC50分别为:FaDu细胞3.93 μmol/L和24.37 μmol/L,Cal-27细胞为2.79 μmol/L和15.15 μmol/L,SCC-9细胞为15.61 μmol/L和95.36 μmol/L,可见DpC对头颈肿瘤细胞的抗增殖作用较Dp44mT更强,差异均具有统计学意义(P均=0.000),且Cal-27细胞的半数抑制率均为最低,即舌鳞癌细胞系Cal-27对DpC和Dp44mT是最敏感的,见图 1。
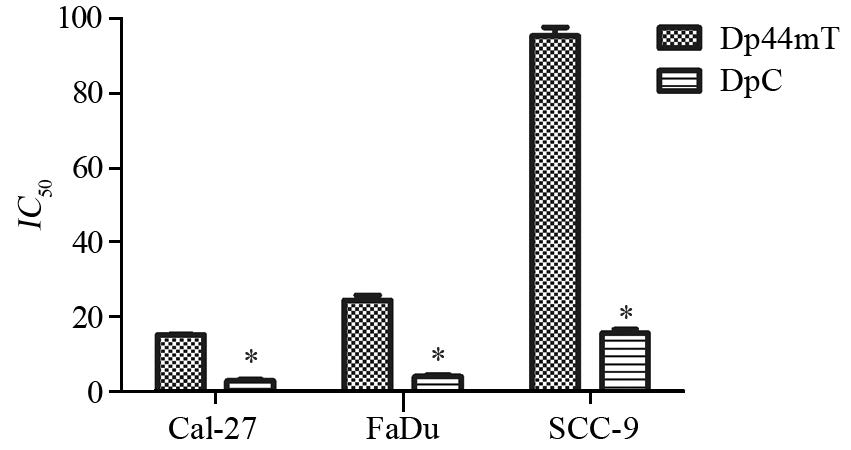
|
| *: P=0.000,DpC compared with Dp44mT 图 1 Dp44mT与DpC抑制Cal-27、FaDu、SCC-9细胞增殖的对比 Fig. 1 Inhibitory effect of Dp44mT and DpC on proliferation of Cal-27,FaDu and SCC-9 cells |
如上细胞毒性实验结果可知,DpC对于FaDu、Cal-27、SCC-9等细胞的IC50在(2、16 μmol/L)区间中,本文为了比较在相同浓度条件下DpC对于Dp44mT抗肿瘤的优越性,因此依照DpC的细胞毒性结果选择相对适中的浓度进行细胞凋亡的监测。即用特定浓度DpC(0、2.5、5、7.5 μmol/L)和Dp44mT(0、2.5、5、7.5 μmol/L)处理FaDu、Cal-27、SCC-9头颈肿瘤细胞24 h,用流式细胞仪检测其凋亡率,其中包括早期凋亡和晚期凋亡。结果表明细胞的凋亡率随着DpC和Dp44mT用药浓度的升高而升高,呈浓度依赖性,见表 1。可见DpC和Dp44mT对人头颈肿瘤细胞均有促进凋亡作用。DpC对头颈肿瘤细胞的促凋亡作用较Dp44mT更强,差异具有统计学意义(P=0.000),且舌鳞癌细胞系Cal-27对DpC和Dp44mT是最敏感的,见图 2。
 |
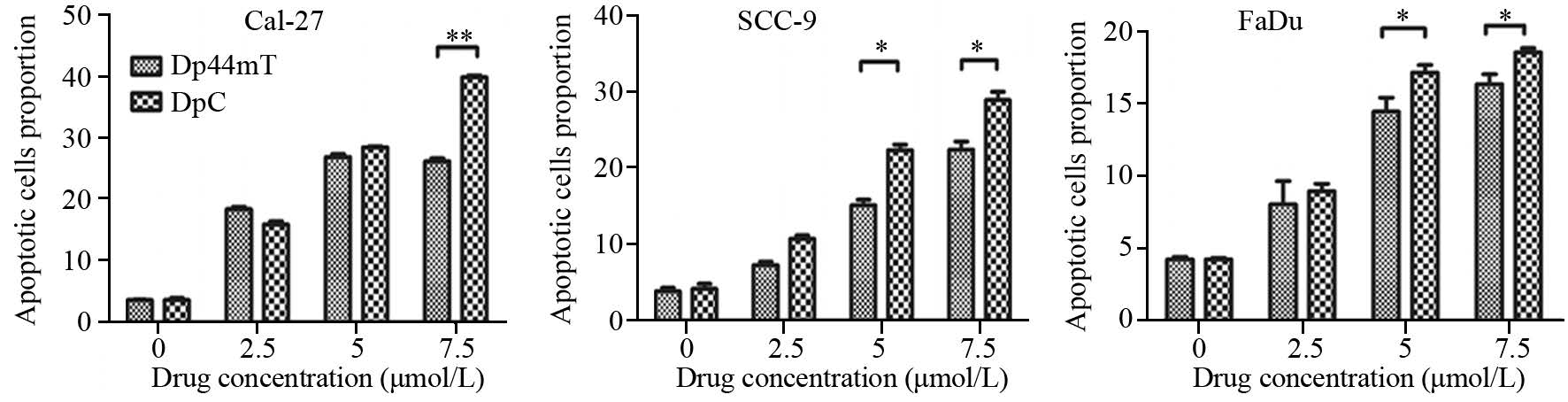
|
| *: P<0.001; **: P<0.0001 图 2 Dp44mT与DpC促进Cal-27、FaDu、SCC-9细胞凋亡的差异对比 Fig. 2 Apoptotic cells proportion of Cal-27,FaDu and SCC-9 treated by Dp44mT and DpC |
经Odyssey定量分析,随着DpC用药浓度的升高,蛋白p-ATM、p-Chk-1、p-ATR、p-Chk-2、PARP、P-Histone H2A.X、BRCA1、p-P53的表达呈现上调趋势,见图 3。
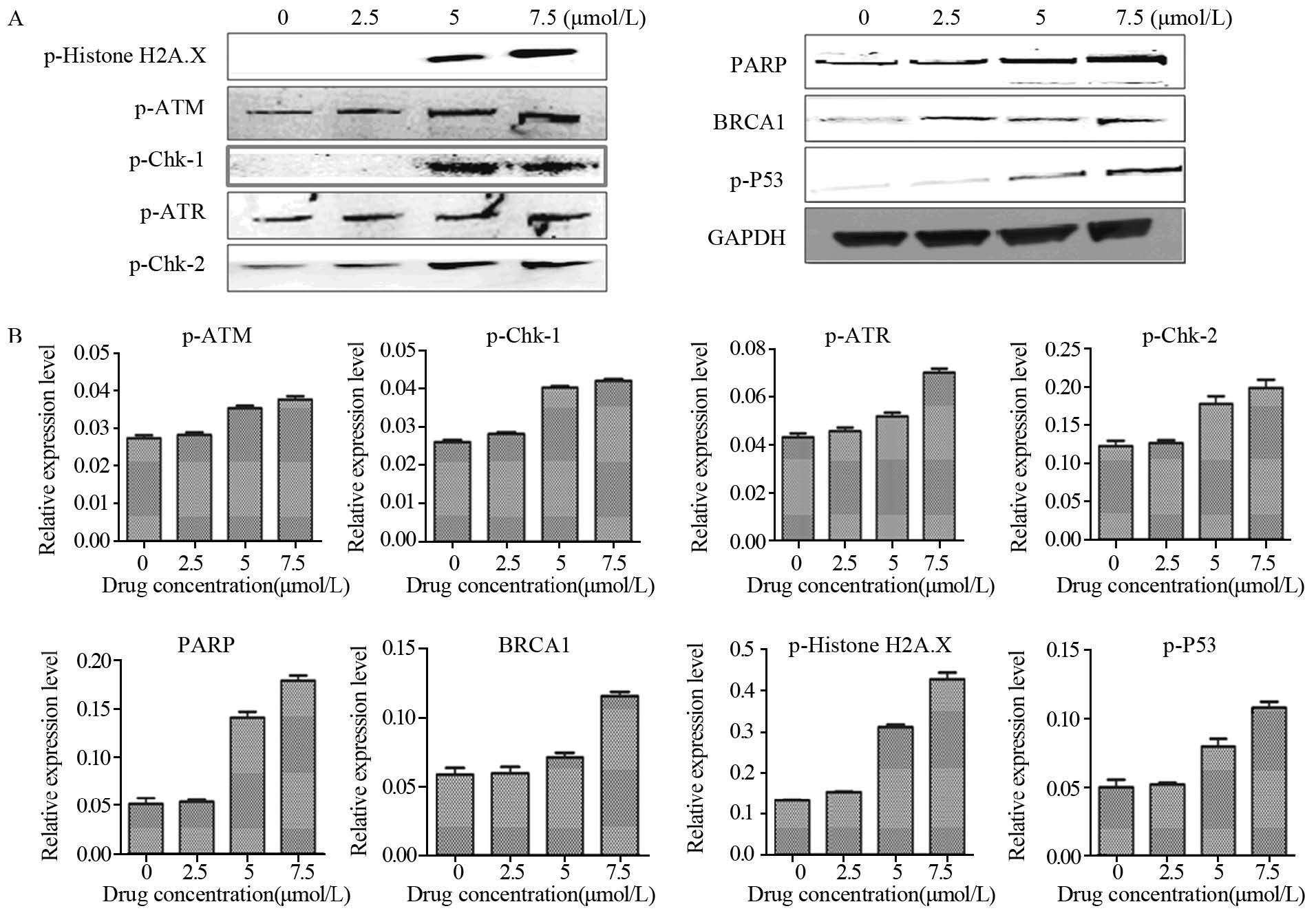
|
| A: Western blot result; B: histogram of related protein expression 图 3 DpC处理Cal-27细胞之后的DNA损伤相关通路蛋白表达变化 Fig. 3 Expression of DNA damage related proteins treated with increased DpC concentration in Cal-27 cells |
Hamre小组于1950年最早发现缩氨基硫脲类化合物具有抗肿瘤活性,此后,其具有抗病毒、抗菌、抗肿瘤、抗麻风病、抗结核和抗疟疾等多种生物活性在诸多研究中被发现[14, 15]。而其基本活性单元即完整的=N1NH(CS)N4H-结构是缩氨基硫脲化合物具有生物活性的根本所在。缩氨基硫脲类化合物因含有N、S等杂原子和C=N基团很容易与多种金属离子形成稳定的配体,且形成配合物后生物活性明显得到增强,特别是具有更好的抗癌和抗HIV活性[16]。其中双甲酮缩氨基硫脲类化合物(DpT)是一种较好的铁离子螯合剂,通过螯合在肿瘤的生长中需要的铁,从而抑制肿瘤的发生发展[17],相比临床常用的铁鳌合剂3-aminopyridine-2-carboxaldehyde thiosemicarbazone(3-AP),具有显著的抗肿瘤活性和选择性。且DpT克服了3-AP易引起高铁血红蛋白血症和低氧的副作用[18]。Dp44mT为DpT的第一代药物,Lovejoy等[19]研究发现其可有效抑制乳腺癌和肺癌。而DpC作为DpT的第二代药物,Kovacevic等[20]研究表明,DpC较Dp44mT在对小鼠胰腺癌移植瘤的治疗中表现出更好的抗肿瘤活性,并且引起严重高铁血红蛋白血症的毒性更小。
本研究通过体外实验发现,DpC和Dp44mT均可抑制头颈肿瘤细胞系的增殖及诱导其凋亡,且DpC作为新一代的DpT,比第一代DpT——Dp44mT抑制HNC细胞系增殖及诱导凋亡的作用更显著。这些变化主要是通过调节DNA损伤信号通路相关蛋白的表达来实现的,如p-ATM、p- Chk-1、p-ATR、p-Chk-2、PARP、p-Histone H2A.X、BRCA1、p-P53。DNA损伤信号通路与头颈肿瘤的发生发展有着密切的联系。
异常的细胞都存在着或多或少、种类繁多的DNA损伤,从基因层面影响着疾病的发生发展,并且会启动一系列的基因修复。DNA损伤统称能够启动细胞凋亡的DNA修饰,包括DNA双链断裂(DNA double-strand breaks,DSBs)和DNA复制阻滞(DNA复制阻滞可引起DSBs)[21],当细胞检测到DNA损伤后,进而启动一个蛋白级联反应,启动和调节DSBs修复、激活细胞周期检测位点和细胞凋亡信号。其中DSBs主要启动ATM,而DNA复制阻滞则主要启动ATR。当细胞发生DNA双键断裂时,MRN复合物(NBS1,MREL1和RAD50)形成,PARP-1则催化形成聚ADP-核糖链,以利于MRN复合物与DNA损伤部位的对接,进而募集ATM到DSBs-MRN位点(Ser1981),使Ser1981位点发生自身磷酸化,从而使非活性的ATM磷酸化;p-ATM上调后,介导组蛋白2AX(Histon H2AX)磷酸化,使MRN复合物,Ⅰ型乳腺癌易感蛋白(BRCA1)募集到DSBs末端,而p-ATM又通过NBN和BRCA1被募集到DSBs上[22]。当细胞发生DNA复制阻滞时,修复结合蛋白(RPA)、ATR-ATR关联蛋白(ATRIP)复合物、DNA拓扑异构酶2-结合蛋白(1TopBP1)和9-1-1复合物(Rad9、Husl和Rad1)参与DNA损伤的检测,从而使ATR磷酸化,进而p-ATR使H2AX磷酸化[23]。p-ATM可在DSBs形成时使Chk-1磷酸化,p-ATR则在发生DNA阻滞时使Chk-2磷酸化,进而p-Chk-1和p-Chk-2使P53磷酸化,从而稳定P53防止其被水解;p-ATM和p-ATR也能直接磷酸化P53。P53进而转录调节促凋亡和抗凋亡的基因。在P53等促细胞凋亡和促细胞存活双重作用下,低水平DNA损伤能够触发DNA修复,而高水平则促发细胞凋亡[24]。Chen等[25]研究发现,铁介导产生活性氧,从而导致了DNA氧化损伤。所以铁螯合剂通过螯合正常细胞中过多的铁,可修复细胞中的DNA氧化损伤[26]。而另一方面,铁作为细胞代谢不可或缺的元素,当肿瘤细胞生长需要的铁被螯合掉后,也可能会启动肿瘤细胞的DNA氧化损伤。因此,我们可推测DpC通过调节与头颈肿瘤发生发展关系密切的DNA损伤信号通路,来抑制HNC细胞系的增殖及诱导其凋亡。
为了进一步阐明DNA损伤信号通路与DpC抑制头颈肿瘤细胞增殖及促进其凋亡之间的联系,我们用DpC处理了舌鳞癌细胞系Cal-27之后,分析了DNA损伤信号通路中特定信号蛋白表达水平的变化。我们观察到,随着DpC用药浓度的升高,DNA损伤中的参与监测的蛋白PARP发生明显上调,DNA损伤发生后启动了ATM和ATR,因此p-ATM和p-ATR蛋白水平上调,进而分别导致p-Chk-1和p-Chk-2表达上调,进而导致蛋白p-Histone H2A.X、BRCA1表达增加,以及最后共同上调了转录调节因子p-P53[27],而P53不仅在DNA 损伤修复中可以招募其他蛋白到损伤部位,并且还是一种抑癌基因,可引起细胞生长阻滞,诱导细胞凋亡[28]。这些结果证明了DNA损伤信号通路与头颈肿瘤的发生发展之间有着密不可分的联系,并且DpC可同时诱导肿瘤细胞DNA双链断裂和DNA复制阻滞。
在肿瘤的治疗中,传统的放疗和化疗会对正常组织和器官造成不可避免的损害,近年来,虽然放疗取得了很大进步,也引进了新的化疗药物,这些治疗手段的副作用虽然减少了,但是仍然存在[29]。本研究证实,DpC可有效抑制头颈肿瘤细胞的增殖以及诱导HNC的凋亡,是一种有效的体外抗头颈肿瘤药物,是否能在未来应用在头颈肿瘤的临床治疗当中,仍需要大量的体内试验和体外实验来进一步验证。
| [1] | D’cruz A, Lin T, Anand AK, et al. Consensus recommendations for management of head and neck cancer in Asian countries: a review of international guidelines[J]. Oral Oncol, 2013, 49(9): 872-7. |
| [2] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. |
| [3] | Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359-86. |
| [4] | Padmanabhan H, Brookes MJ, Iqbal T. Iron and colorectal cancer: evidence from in vitro and animal studies[J]. Nutr Rev, 2015, 73(5): 308-17. |
| [5] | Gibbons JA, Kanwar JR, Kanwar RK. Iron-free and iron-saturated bovine lactoferrin inhibit survivin expression and differentially modulate apoptosis in breast cancer[J]. BMC Cancer, 2015, 15: 425. |
| [6] | Miljuš G, Malenković V, Ðukanović B, et al. IGFBP-3/transferrin/transferrin receptor 1 complexes as principal mediators of IGFBP-3 delivery to colon cells in non-cancer and cancer tissues[J]. Exp Mol Pathol, 2015, 98(3): 431-8. |
| [7] | Dragset MS, Poce G, Alfonso S, et al. A novel antimycobacterial compound acts as an intracellular iron chelator[J]. Antimicrob Agents Chemother, 2015, 59(4): 2256-64. |
| [8] | Fang BA, Kovačević Ž, Park KC, et al. Molecular functions of the iron-regulated metastasis suppressor, NDRG1, and its potential as a molecular target for cancer therapy[J]. Biochim Biophys Acta, 2014, 1845(1): 1-19. |
| [9] | Quach P, Gutierrez E, Basha MT, et al. Methemoglobin formation by triapine, di-2-pyridylketone-4,4-dimethyl-3-thiosemicarbazone (Dp44mT), and other anticancer thiosemicarbazones: identification of novel thiosemicarbazones and therapeutics that prevent this effect[J]. Mol Pharmacol, 2012, 82(1): 105-14. |
| [10] | Merlot AM, Sahni S, Lane DJ, et al. Potentiating the cellular targeting and anti-tumor activity of Dp44mT via binding to human serum albumin: two saturable mechanisms of Dp44mT uptake by cells[J]. Oncotarget, 2015, 6(12): 10374-98. |
| [11] | Gutierrez E, Richardson DR, Jansson PJ. The anticancer agent di-2-pyridylketone 4,4-dimethyl-3-thiosemicarbazone (Dp44mT) overcomes prosurvival autophagy by two mechanisms: persistent induction of autophagosome synthesis and impairment of lysosomal integrity[J]. J Biol Chem, 2014, 289(48): 33568-89. |
| [12] | Lovejoy DB, Sharp DM, Seebacher N, et al. Novel second-generation di-2-pyridylketone thiosemicarbazones show synergism with standard chemotherapeutics and demonstrate potent activity against lung cancer xenografts after oral and intravenous administration in vivo[J]. J Med Chem, 2012, 55(16): 7230-44. |
| [13] | Quach P, Gutierrez E, Basha MT, et al. Methemoglobin formation by triapine, di-2-pyridylketone-4,4-dimethyl-3-thiosemicarbazone (Dp44mT), and other anticancer thiosemicarbazones: identification of novel thiosemicarbazones and therapeutics that prevent this effect[J]. Mol Pharmacol, 2012, 82(1): 105-14. |
| [14] | Pahontu E, Julea F, Rosu T, et al. Antibacterial, antifungal and in vitro antileukaemia activity of metal complexes with thiosemicarbazones[J]. J Cell Mol Med, 2015, 19(4): 865-78. |
| [15] | Zhu TH, Cao SW, Yu YY. Synthesis, characterization and biological evaluation of paeonol thiosemicarbazone analogues as mushroom tyrosinase inhibitors[J]. Int J Biol Macromol, 2013, 62: 589-95. |
| [16] | Zhang N, Tai Y, Li M, et al. Main group bismuth(Ⅲ), gallium(Ⅲ) and diorganotin(Ⅳ) complexes derived from bis(2-acetylpyrazine)thiocarbonohydrazone: synthesis, crystal structures and biological evaluation[J]. Dalton Trans, 2014, 43(13): 5182-9. |
| [17] | Richardson DR, Sharpe PC, Lovejoy DB, et al. Dipyridyl thiosemicarbazone chelators with potent and selective antitumor activity form iron complexes with redox activity[J]. J Med Chem, 2006, 49(22): 6510-21. |
| [18] | Ma B, Goh BC, Tan EH, et al. A multicenter phaseⅡtrial of 3-aminopyridine-2-carboxaldehyde thiosemicarbazone (3-AP, Triapine) and gemcitabine in advanced non-small-cell lung cancer with pharmacokinetic evaluation using peripheral blood mononuclear cells[J]. Invest New Drugs, 2008, 26(2): 169-73. |
| [19] | Lovejoy DB, Jansson PJ, Brunk UT, et al. Antitumor activity of metal-chelating compound Dp44mT is mediated by formation of a redox-active copper complex that accumulates in lysosomes[J]. Cancer Res, 2011, 71(17): 5871-80. |
| [20] | Kovacevic Z, Chikhani S, Lovejoy DB, et al. Novel thiosemicarbazone iron chelators induce up-regulation and phosphorylation of the metastasis suppressor N-myc down-stream regulated gene 1: a new strategy for the treatment of pancreatic cancer[J]. Mol Pharmacol, 2011, 80(4): 598-609. |
| [21] | Han Y, Chen DX, Guo HL. Advances in DNA damage response[J]. Zhonghau Zhong Liu Fang Zhi Za Zhi, 2013, 20(22): 1775-8. [韩悦, 陈德喜, 郭洪亮. DNA损伤应答通路研究现状[J]. 中华肿瘤防治杂志, 2013, 20(22): 1775-8. ] |
| [22] | Mohni KN, Thompson PS, Luzwick JW, et al. A Synthetic Lethal Screen Identifies DNA Repair Pathways that Sensitize Cancer Cells to Combined ATR Inhibition and Cisplatin Treatments[J]. PLoS One, 2015, 10(5): e0125482. |
| [23] | Park JS, Na HJ, Jeon JH, et al. Requirement of ATR for maintenance of intestinal stem cells in aging Drosophila[J]. Aging (Albany NY), 2015, 7(5): 307-18. |
| [24] | Demoulin B, Hermant M, Castrogiovanni C, et al. Resveratrol induces DNA damage in colon cancer cells by poisoning topoisomeraseⅡand activates the ATM kinase to trigger p53-dependent apoptosis[J]. Toxicol In Vitro, 2015, 29(5): 1156-65. |
| [25] | Chen Z, Zhou Q, Zou D, et al. Chloro-benzoquinones cause oxidative DNA damage through iron-mediated ROS production in Escherichia coli[J]. Chemosphere, 2015, 135: 379-86. |
| [26] | Melis JP, van Steeg H, Luijten M. Oxidative DNA damage and nucleotide excision repair[J]. Antioxid Redox Signal, 2013, 18(18): 2409-19. |
| [27] | Tang S, Hou Y, Zhang H, et al. Oxidized ATM promotes abnormal proliferation of breast CAFs through maintaining intracellular redox homeostasis and activating the PI3K-AKT, MEK-ERK, and Wnt-beta-catenin signaling pathways[J]. Cell Cycle, 2015, 14(12): 1908-24. |
| [28] | Inobe T, Nozaki M, Nukina N. Artificial regulation of p53 function by modulating its assembly[J]. Biochem Biophys Res Commun, 2015, 467(2): 322-7. |
| [29] | Wong FC, Ng AW, Lee VH, et al. Whole-field simultaneous integrated-boost intensity-modulated radiotherapy for patients with nasopharyngeal carcinoma[J]. Int J Radiat Oncol Biol Phys, 2010, 76(1): 138-45. |
 2016, Vol. 43
2016, Vol. 43


