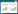文章信息
- 杨冬谊, 步星耀, 闫兆月, 屈鸣麒, 马春晓, 张慧.
- YANG Dongyi, BU Xingyao, YAN Zhaoyue, QU Mingqi, MA Chunxiao, ZHANG Hui.
- GM-CSF在替莫唑胺抗高级别胶质瘤中的作用
- GM-CSF Enhances Effect of TMZ on High-grade Glioma Cells
- 肿瘤防治研究, 2016, 43(02): 100-105
- Cancer Research on Prevention and Treatment, 2016, 43(02): 100-105
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.02.002
-
文章历史
- 收稿日期: 2015-02-25
- 修回日期: 2015-07-09
2. 450003 郑州,河南中医学院基础医学院
2. College of Basic Medicine, He’nan University of Traditional Chinese Medicine, Zhengzhou 450003, China
替莫唑胺(temozolomide,TMZ)是目前被广泛接受并可有效地治疗高级别胶质瘤的化疗药物之一,六氧甲基鸟嘌呤DNA甲基转移酶(O6-methylguanine-DNA methyltransferase,MGMT)启动子甲基化的高级别胶质瘤对其敏感度较好,而对MGMT非甲基化的肿瘤敏感度差,以及肿瘤耐药现象仍是目前治疗高级别胶质瘤的难题之一[1, 2, 3],与TMZ化疗相关的血液系统不良反应不容忽视,主要表现为骨髓增生异常综合征(myelodysplastic syndromes,MDS)、白血病以及严重骨髓抑制[4, 5]。粒-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)是临床上预防和治疗因放化疗引起骨髓抑制的常用药物之一,可兴奋骨髓的造血功能,提高机体抗肿瘤及抗感染免疫力。近年研究证实,GM-CSF及其受体(GM-CSF.R)的表达主要存在于恶性肿瘤[6],GM-CSF可诱导急性髓性白血病干细胞由G0/G1期进入G2/M期,提高其对放化疗的敏感度,增强对肿瘤细胞的杀伤作用,从而改善预后[7]。而有关GM-CSF与TMZ联合应用抗高级别胶质瘤的实验研究尚未见报道。本实验拟应用GM-CSF对高级别胶质瘤细胞周期进行干预,从而探讨TMZ在GM-CSF干预后对胶质瘤细胞的杀伤性。
1 材料和方法 1.1 实验材料6例高级别胶质瘤细胞来源于人脑胶质瘤组织的培养,见表 1。GM-CSF购自美国Propretech公司,TMZ粉剂来源于默沙东公司,DMEM高糖培养液购自Hyclone公司,胎牛血清购自美国Gibco公司,胰蛋白酶和双抗(青霉素、链霉素)购自北京索莱宝科技有限公司,MGMT抗体购自美国Santa Cruz公司,甲基化特异性PCR试剂盒购自美国Abcam公司,MTT粉剂购自上海碧云天生物技术公司,流式凋亡试剂盒购自美国艾美捷Biovision公司,PI和 RnaseA购自武汉博士德生物公司。
 |
实验中高级别胶质瘤细胞均来源于接受手术患者的脑胶质瘤组织。用添加100 u/ml青霉素和100 ng/ml链霉素的D-Hank's液将肿瘤组织冲洗干净,眼科剪剪成1 mm3大小组织块,适量0.25%胰蛋白酶消化,用含10%血清的DMEM(HG)培养液终止消化,移液枪反复吹打后获得细胞悬液,移入离心管以1 000 r/min离心5 min后弃上清液,取5 ml细胞悬液接种于25 mm2细胞培养瓶,于37℃、5%CO2饱和湿度的细胞培养箱中静置培养,每2~3天换液一次,至细胞长满瓶底进行传代,传至第4~6代细胞稳定后开始进行实验。
1.3 免疫组织化学染色检测MGMT表达MGMT是一种DNA修复蛋白,能够移除DNA上鸟嘌呤O(6)位点的可致突变毒性和细胞毒性的烷基化加合物,使损伤的鸟嘌呤恢复,从而保护细胞对抗烷化基团的损害,是肿瘤耐受烷化剂药物的主要原因。肿瘤组织采用免疫组织化学染色法检测MGMT)的表达水平,MGMT抗体(Santa Cruz Biotech,SPM287: sc-56432)为鼠抗人单克隆抗体,按说明书操作步骤进行。MGMT抗体为细胞核和细胞质着色,呈棕黄色颗粒或棕褐色颗粒为阳性细胞。在显微镜高倍视野(40×10倍)下观察:阳性细胞 >30%为强阳性(+++);阳性细胞≥10%~30%为阳性(++);5%~10%为弱阳性(+);<5%为阴性(-)。
1.4 甲基化特异性PCR(MSP)MGMT蛋白表达受其基因启动子CpG岛甲基化调控,MGMT基因启动子的甲基化可作为药物敏感度的评估指标。用DNA甲基化修饰试剂盒(EZ DNA Methylation-GoldTM Kit)对抽提的基因组DNA进行亚硫酸氢盐修饰(按试剂盒操作说明进行)。进行修饰后,甲基化的胞嘧啶(C)保持不变,而未甲基化的胞嘧啶转变为尿嘧啶(U)。经过修饰的DNA样品分别以甲基化和未甲基化引物进行扩增,O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)基因甲基化引物:正义链:5′-TTTCGACGTTCGTAGGTTTTCGC-3′;反义链:5′-GCACTCTTCCGAAAACGAAACG-3′MGMT。基因未甲基化引物:正义链:5′-TTTGTGTTTTGATGTTTGTAGGTTTTTGT-3′;反义链:5′-AACTCCACACTCTTCCAAAAACAAAACA-3′。
1.5 MTT法检测细胞活性设置对照组、TMZ组、GM-CSF组、TMZ+GM-CSF组,将细胞接种于96孔板,每组5个复孔,每孔细胞数约为5 000个,培养液150 μl。先加入GM-CSF进行干预,12 h后加入TMZ,使其终浓度分别为20 ng/ml和100 μmol/L。培养48 h后加入5 mg/ml浓度MTT溶液10 μl,孵育4 h,终止培养。在酶联免疫监测仪上选择570 nm波长测定各孔光吸收度值,计算各个时段的细胞存活率。
1.6 流式细胞仪检测细胞凋亡率将细胞悬液以5×105接种于25 cm2培养板,设置对照组、GM-CSF组、TMZ组、GM-CSF联合TMZ组,在对应的分组先加入GM-CSF使其终浓度为20 ng/ml,12 h后加入TMZ使其终浓度为100 μmol/L。48 h后胰酶消化并收集细胞,凋亡试剂盒(PE Annexin V Apoptosis Detection Kit 1)染色处理后上机检测。
1.7 流式细胞仪检测细胞周期将胶质瘤细胞以5×105接种于25 cm2培养瓶,设置对照组、GM-CSF处理组。6 h后加入GM-CSF使其终浓度为20 ng/ml; 48 h后用胰酶消化并收集细胞,制备细胞悬液,然后加入2 ml 70%预冷乙醇中,4℃固定12 h以上。PBS洗涤去乙醇,离心后0.5 ml PBS重悬细胞,加入PI和RNaseA至终浓度分别为50 μg/ml,37℃温浴30 min,流式细胞仪检测周期。
1.8 统计学方法用SPSS17.0统计软件进行数据处理。实验数据采用方差分析,所有实验重复三次。P<0.05为差异有统计学意义。
2 结果 2.1 高级别胶质瘤细胞培养结果剪碎的肿瘤组织块于37℃、5%CO2饱和湿度的细胞培养箱中培养3天后,细碎的肿瘤组织块已贴壁,并从四周放射状长出梭形胶质瘤细胞,均呈贴壁生长,生长范围逐渐扩大并与其他组织块细胞汇合,见图 1A。待贴壁细胞汇合度达80%左右时进行细胞传代,按标准换液和传代,传至第4代后细胞生长状态稳定,见图 1B。

|
| 图 1 来源于高级别胶质瘤患者原代细胞传代前(A)传代后(B)培养图 Fig. 1 Culture of primary cells from patients with high-grade gliomas before(A) and after(B) passage |
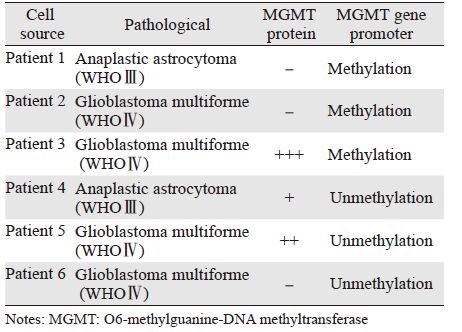
根据免疫组织化学染色显示的棕色颗粒细胞数,患者1的组织片几乎看不到棕色颗粒染色,MGMT表达呈阴性;患者3的细胞棕色颗粒数约超过半数,呈强阳性;患者4的肿瘤标本片可见少量棕色颗粒染色细胞,呈弱阳性;患者5可见棕色颗粒细胞数在20%左右,在阳性表达范围内,见图 2。
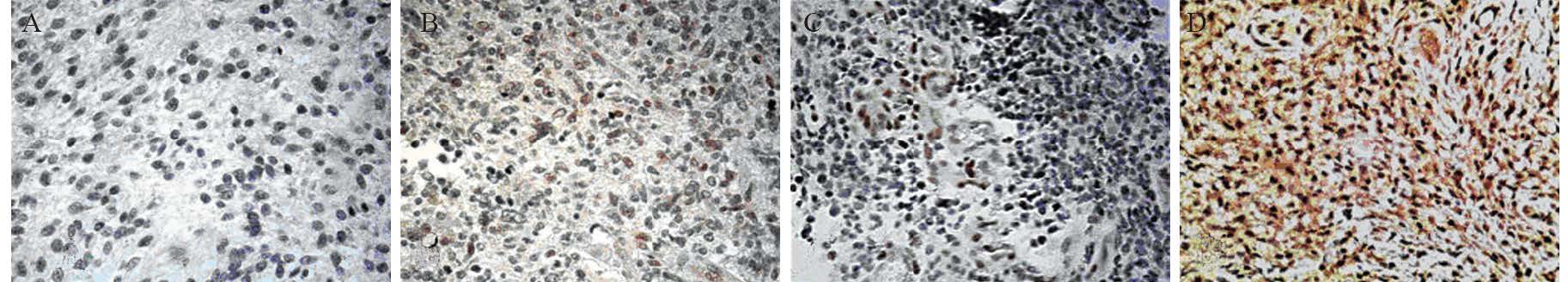
|
| A: patient 1: anaplastic astrocytoma,WHOⅢ. MGMT (-); B: patient 4: anaplastic astrocytoma ,WHOⅢ. MGMT (+); C: patient 5:glioblastoma multiforme,WHOⅣ. MGMT (++); D: patient 3:glioblastoma multiforme,WHOⅣ. MGMT (+++) 图 2 高级别胶质瘤免疫组织化学染色法检测MGMT的表达 Fig. 2 MGMT expression in high-grade glioma cells detected by immunohistochemical staining |
MGMT基因启动子的甲基化可作为药物敏感度的评估指标,根据甲基化特异性PCR检测结果,患者1、2、3的MGMT基因启动子呈甲基化状态,提示其对化疗药TMZ敏感,患者4、5、6的MGMT基因启动子非甲基化,提示对TMZ敏感度差,见图 3。
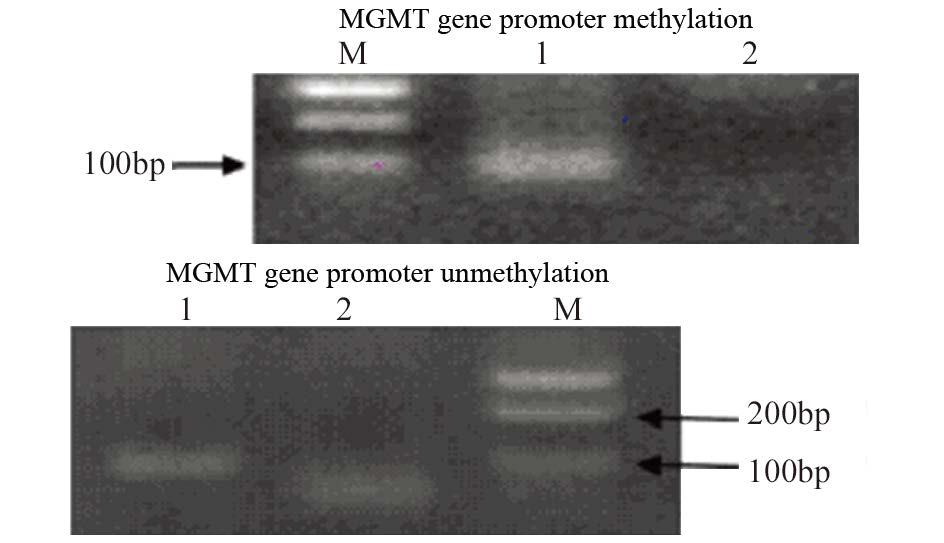
|
| M: Marker; 1: treated sample DNA,unmethylated primers; 2: treated sample DNA,methylated primers 图 3 甲基化特异性PCR法检测MGMT基因启动子甲基化状态 Fig. 3 MGMT promoter methylation status detected by MSP |
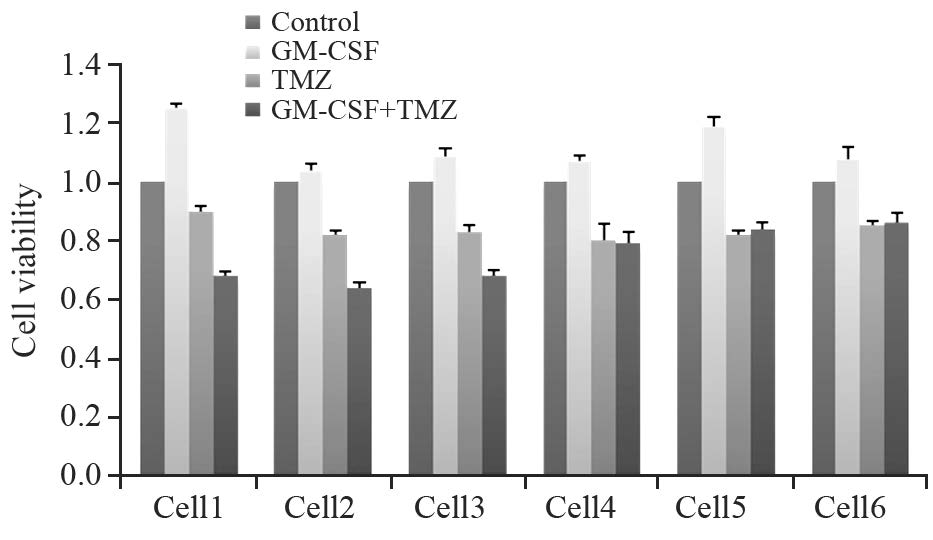
与对照组相比,所有细胞GM-CSF处理组的细胞存活率均有不同程度的增加,TMZ组与GM-CSF+TMZ组的细胞存活率均明显下降。与单药TMZ组相比,细胞1、细胞2、细胞3的GM-CSF+TMZ组细胞存活率显著降低,其差异有统计学意义(P=0.000、P=0.000、P=0.001);而细胞4、细胞5、细胞6的单药TMZ组与GM-CSF+TMZ组细胞存活率差异无统计学意义(P=0.305、 P=0.557、P=0.783),见图 4。
|
| Cell viabilities were higher in GM-CSF treated group than those in control group. The survival rate of the former three cases of cells (MGMT promoter methylation) in GM-CSF+TMZ group were significantly lower than those in TMZ group(P=0.000); however,the other three cases (MGMT promoter unmethylation) had no significant difference in survival rate between two groups(P>0.05) 图 4 不同组高级别胶质瘤细胞的存活率比较 Fig. 4 Comparison of high-grade glioma cell viabilities among different groups |
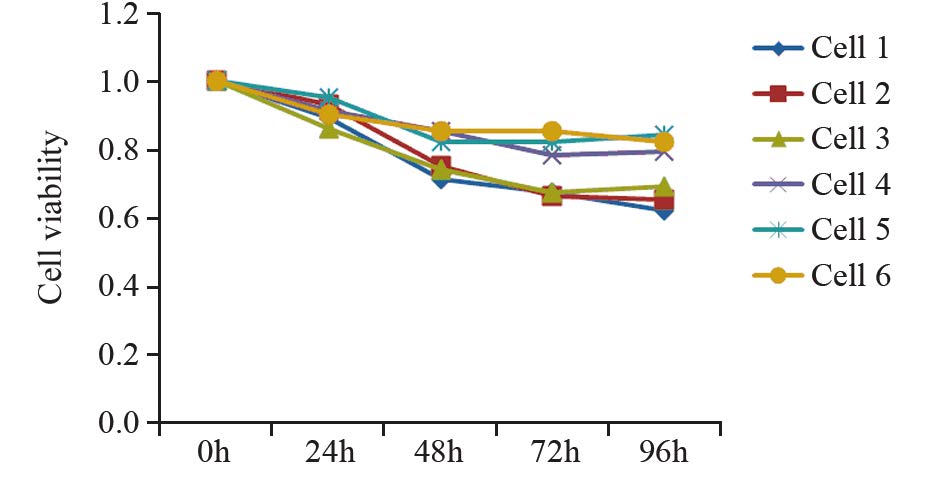
MTT法检测结果显示6例胶质瘤细胞应用GM-CSF联合TMZ处理后,其存活率随着时间变化均逐渐降低,72~96 h后细胞的存活率降至最低,对胶质瘤细胞的抑制率最大,见图 5。
|
| The inhibition rate of TMZ on tumor cells reached to the maximum after 72h and the survival rate decreased to the minimum 图 5 高级别胶质瘤细胞时间—存活率曲线 Fig. 5 Time-survival curves of high-grade glioma cells |
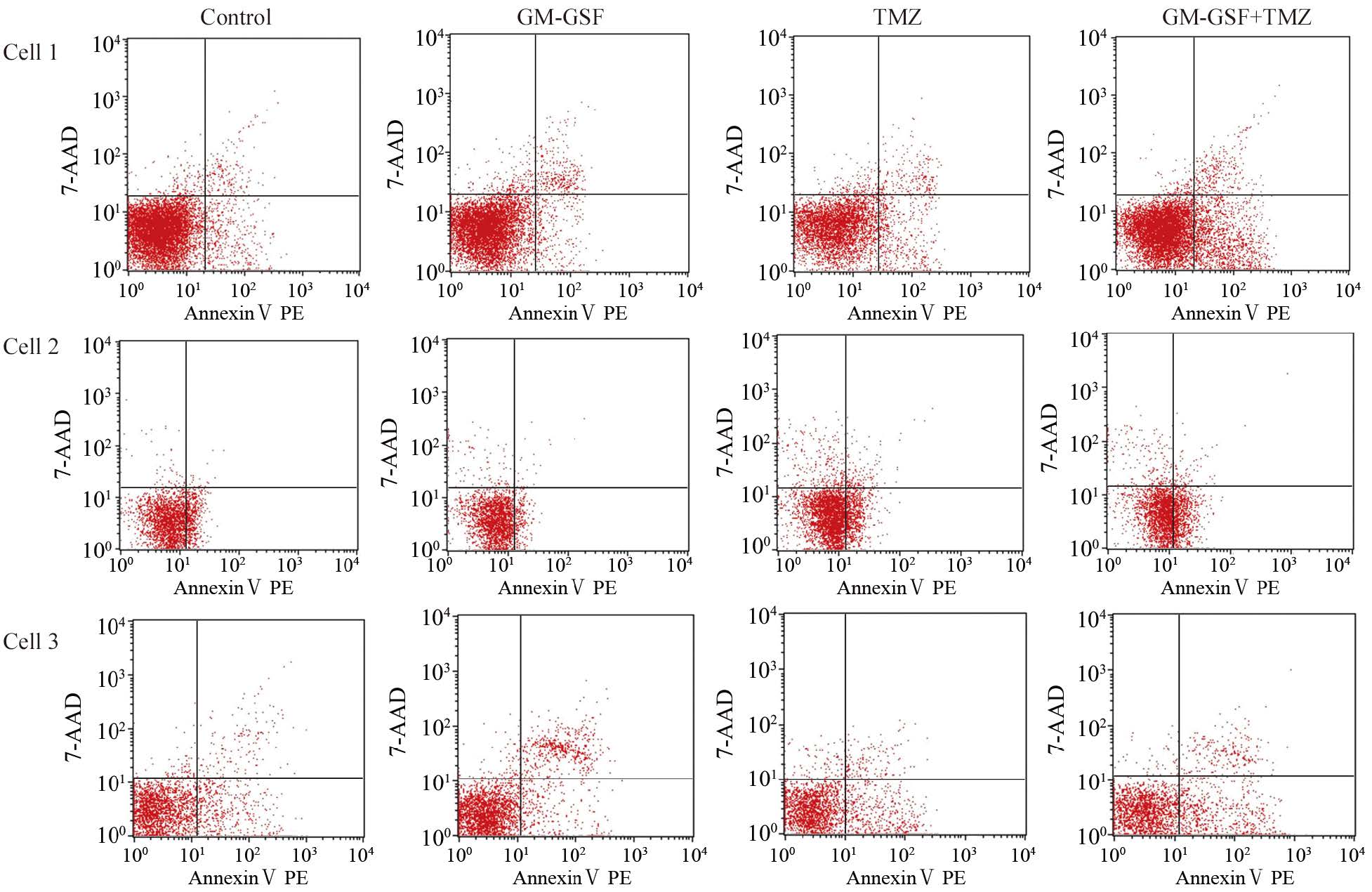
结果显示,GM-CSF组与对照组相比,6例细胞均表现出一致性,即GM-CSF组细胞凋亡率降低。细胞1、细胞2和细胞3的GM-CSF+TMZ组凋亡率[(19.91±1.93)、(25.33±2.57)、(32.15±2.85)]与单药TMZ组凋亡率[(10.79±0.60)、(15.15±1.74)、(22.27±1.89)]相比均显著增加,其差异具有统计学意义(P=0.000、P=0.000、P=0.007)。而细胞4、细胞5、细胞6的GM-CSF联合TMZ用药组与单药TMZ组相比,细胞凋亡率无明显变化(P>0.05),见图 6。
|
| Compared with the control group,the apoptosis rate of GM-CSF group was decreased,however those of TMZ group and the combination group were improved significantly; The apoptosis rate of GM-CSF+TMZ group for the three cases (MGMT promoter methylation) were significantly higher than those in TMZ monotherapy group (P<0.05) 图 6 流式细胞仪检测细胞凋亡率 Fig. 6 Apoptosis rate of glioma cells detected by flow cytometry |
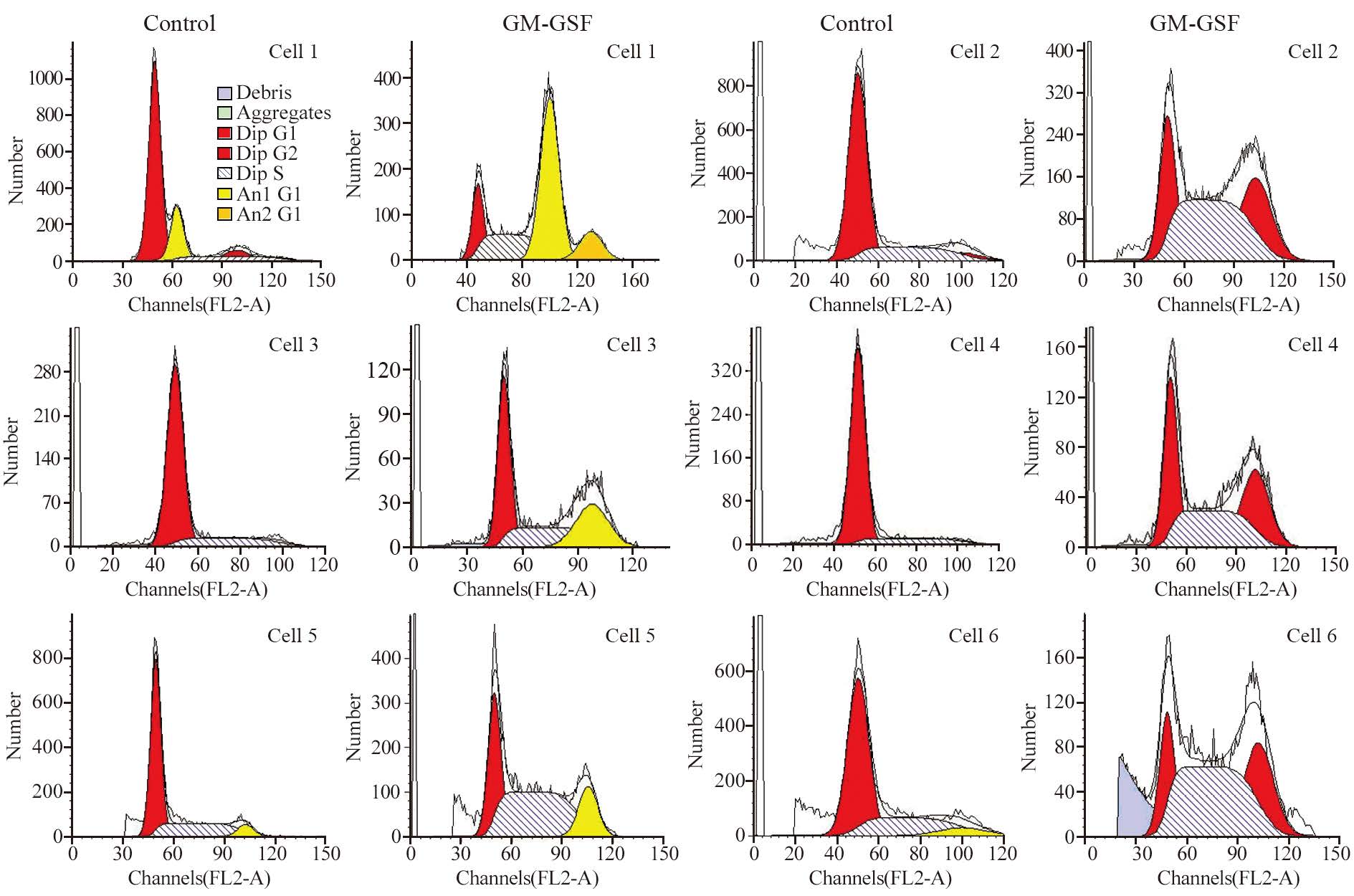
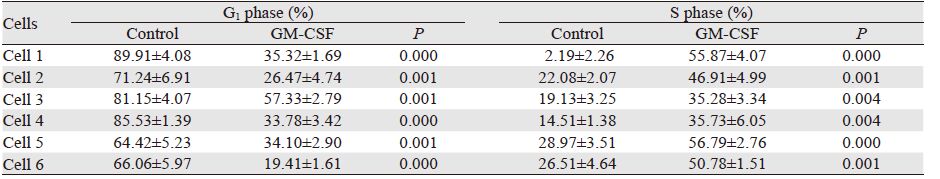
结果显示,与对照组G1期细胞比例相比,48 h后GM-CSF处理组G1期细胞所占比例大幅降低,而GM-CSF处理组S期细胞所占比例较对照组显著增加,6例细胞表现出一致性,并且其差异具有统计学意义(P<0.05),见图 7、表 2。
|
| After GM-CSF (20ng/ml) was added to the cells for 48h,compared with the corresponding control groups,the cells proportion in G1 phase was significantly reduced,while the cells proportion in S phase was significantly increased (P<0.05) 图 7 对照组与GM-CSF处理组的细胞周期图 Fig. 7 Cell cycle of control group and GM-CSF group |
 |
据研究发现,GM-CSF和GM-CSF.R在不同恶性级别的脑胶质瘤均有表达,这些基因的表达主要存在于恶性肿瘤、良性肿瘤不表达或GM-CSF及其受体表达较低,且体外研究发现,加入抗GM-CSF抗体通过阻断内源性产生的GM-CSF、GM-CSF敏感细胞可凋亡[6]。Saito等[7]研究发现GM-CSF可有效诱导分裂静止的白血病肿瘤干细胞进入细胞周期,从而增强其对化疗药物的敏感度,提高对肿瘤干细胞的清除率。
MGMT作为DNA修复蛋白,其高表达导致肿瘤细胞对烷化类药物耐药,MGMT基因启动区甲基化的测定已作为高级别脑胶质瘤术后化疗方案选择的重要参考指标[8],因此,本研究探讨GM-CSF对TMZ抗MGMT基因甲基化不同状态的高级别胶质瘤细胞作用。
本实验所选细胞来源均为WHOⅢ~Ⅳ的高级别肿瘤,传代建系后进行免疫组织化学染色及甲基化特异性PCR检测显示MGMT表达水平及其甲基化状态不同。MTT法细胞增殖毒性实验及流式细胞仪检测细胞凋亡率的结果呈一致性,6例细胞GM-CSF处理组的存活率与对照组相比均有不同程度的增加,即单用GM-CSF可促进高级别胶质瘤细胞增殖,这与国内外公认的研究结果相符合[9]。然而,联合用药组与单药TMZ组对肿瘤细胞的杀伤性效果对比中,6例细胞并未表现出一致的作用,MGMT表达阴性且基因甲基化的3例细胞,GM-CSF与TMZ联合用药可增强对该肿瘤细胞的杀伤性,与单药TMZ组相比细胞凋亡率升高,表现出GM-CSF对TMZ的增敏作用,而另外3例MGMT表达阳性且基因非甲基化的细胞,联合用药组与单药TMZ组相比,对高级别胶质瘤细胞的杀伤作用无明显增强。
流式检测细胞周期显示,与对照组相比GM-CSF处理组在48 h后G1期细胞比例大幅降低,而S期细胞所占比例显著提高,6例细胞均表现出一致的反应性及结果,与MGMT表达与否及基因甲基化状态不相关,表明GM-CSF可诱导部分高级别胶质瘤细胞快速进入细胞周期。本研究选用替莫唑胺的浓度为100 μmol/L,是基于100 μmol/L TMZ在无毒性作用的安全浓度范围内,并且根据国外文献提供的TMZ作用于胶质瘤细胞的实验剂量为100 μmol/L[10]。在实验中所选用的GM-CSF浓度20 ng/ml,是基于临床常用的安全计量和相关研究文献推荐选用量[6, 11]进行筛选,最终根据该试验的预试验结果而选择的,实验结果提示增加GM-CSF的剂量并不能进一步提高替莫唑胺对胶质瘤细胞杀伤性,因此选用剂量为20 ng/ml。
基于上述研究结果,表明GM-CSF可以通过诱导部分高级别胶质瘤细胞快速进入细胞周期,促进细胞增殖,与化疗药TMZ联合应用后能够增强TMZ对MGMT基因启动子甲基化的高级别胶质瘤细胞的杀伤作用,而对MGMT基因启动子非甲基化高级别胶质瘤细胞的杀伤作用无明显提高。在临床高级别脑胶质瘤治疗过程中合理应用GM-CSF,既可有效治疗、降低患者白细胞和血小板减少的状况,又可增强TMZ抗高级别胶质瘤作用,提高对胶质瘤细胞的清除率,显著改善患者预后,这将具有重要的临床应用价值。
| [1] | Khasraw M, Lassman AB. Advances in the treatment of malignant gliomas[J]. Curr Oncol Rep, 2010, 12(1): 26-33. |
| [2] | See SJ, Gilbert MR. Chemotherapy in adults with gliomas[J]. Ann Acad Med Singapore, 2007, 36(5): 364-6. |
| [3] | Weller M. Novel diagnostic and therapeutic approaches to malignant glioma[J]. Swiss Med Wkly, 2011, 141: w13210. |
| [4] | Chamberlain MC, Raizer J. Extended exposure to alkylator chemotherapy: delayed appearance of myelodysplasia[J]. J Neurooncol, 2009, 93(2): 229-32. |
| [5] | George BJ, Eichinger JB, Richard TJ. A rare case of aplastic anemia caused by temozolomide[J]. South Med J, 2009, 102: 974-6. |
| [6] | Revoltella RP, Menicagli M, Campani D. Granulocyte-macrophage colony-stimulating factor as an autocrine survival-growthfactor in human gliomas[J]. Cytokine, 2012, 57(3): 347-59. |
| [7] | Saito Y, Uchida N, Tanaka S, et al. Induction of cell cycle entry eliminates human leukemia stem cells in a mouse model of AML[J]. Nat Biotechnol, 2010, 28(3): 275-80. |
| [8] | Natsurae A, Wakabayashi T, Ishii D, et al. A combination of IFN-beta and temozolomide in human glioma xenograft models:implication of p53 mediated MGMT downregulation[J]. Cancer Chemother Pharmacol, 2008, 61(4): 653-9. |
| [9] | Sielska M, Przanowski P, Wylot B, et al. Distinct roles of CSF family cytokines in macrophage infiltration and activation in glioma progression and injury response[J]. J Pathol, 2013, 230(3): 310-21. |
| [10] | Ugur HC, Taspinar M, Llgaz S, et al. Chemotherapeutic resistance in anaplastic astrocytoma cell lines treated with a temozolomide–lomeguatrib combination[J]. Mol Biol Rep, 2014, 41(2): 697-703. |
| [11] | Kohanbash G, McKaveney K, Sakaki M, et al. GM-CSF promotes the immunosuppressive activity of glioma-infiltrating myeloid cells through interleukin-4 receptor-α[J]. Cancer Res, 2013, 73(21): 6413-23. |
 2016, Vol. 43
2016, Vol. 43