文章信息
- 张弛,邓文英,李宁,许勇飞,张燕平,魏辰,申威,罗素霞.
- ZHANG Chi, DENG Wenying, LI Ning, XU Yongfei, ZHANG Yanping, WEI Chen, SHEN Wei, LUO Suxia.
- 恩度不同给药途径联合TP方案治疗进展期卵巢癌的临床观察
- Different Administration Ways of Endostar Combined with TP Regimen on Advanced Ovarian Cancer Patients
- 肿瘤防治研究, 2016, 43(01): 54-57
- Cancer Research on Prevention and Treatment, 2016, 43(01): 54-57
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.01.012
-
文章历史
- 收稿日期: 2015-10-19
- 修回日期: 2015-11-10
卵巢癌是女性生殖器官常见肿瘤之一,也是严重威胁妇女健康的主要恶性肿瘤之一,由于起病隐匿,进展较快,死亡率居妇科恶性肿瘤之首,5年生存率不足30%[1]。卵巢组织中血管生成是卵巢癌发生发展(浸润、转移等)的基础。肿瘤只有在新生血管形成以后,才能迅速生长,并进一步向周围浸润和进入血液循环向远处转移[2]。有研究[3]显示,血管内皮抑素(endostain)是一种重要的内源性抑血管生成因子,可抑制血管内皮的增殖,诱导其凋亡。重组人血管内皮抑素恩度(endostar)是基于内皮抑素的人工合成抗血管生成类新型靶向药物[4],恩度与化疗药物联合使用具有协同抗肿瘤作用。恩度传统的给药方式为静脉滴注,本试验通过观察并分析恩度持续静脉泵入联合化疗对比恩度静脉滴注联合化疗对晚期卵巢癌患者的疗效,为恩度的临床应用摸索一条新的临床途径,现报告如下。
1 资料与方法 1.1 病例选择入组标准:经病理组织学和(或)细胞学明确诊断为卵巢癌的患者;有客观可测量的1个及以上的病灶;治疗前按国标妇产科联盟(FIGO 2006)的标准分期为Ⅳ期;东部肿瘤协会(ECOG)的身体状况评分(PS)0~2分;KPS评分≥60分;预计生存期≥3月;各项检查指标符合化疗适应证;无主要器官功能障碍;既往使用过其他化疗药物者需停药4周以上;患者愿意接受本方案治疗,签署化疗协议书,并且依从性好。排除标准:无可观察测量的肿瘤病灶;肝、肾功能异常或血常规异常患者;妊娠或哺乳期妇女;颅脑转移病情未得到有效控制者;没有完成化疗疗程,治疗后未行CT检查。
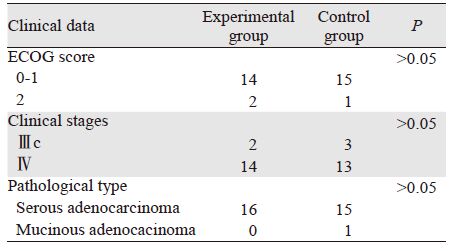
1.2 一般资料2012年6月—2014年3月共入组患者32例,年龄范围为41~68岁,平均年龄53岁,采用前瞻性、随机、对照的临床研究方法,将符合入组条件的病例以随机法分为试验组和对照组,每组各16例。两组患者的年龄、体力状况、临床分期、病理类型等影响因素具有较好的均衡性和可比性(P>0.05),见表 1。
 |
试验组方案采用恩度持续静脉泵+TP方案:紫杉醇,175 mg/m2,第1天,静脉滴注;顺铂,75 mg/m2,第1至4天,静脉滴注;恩度加入0.9%氯化钠溶液200~220 ml中,使用便携式输液泵,持续均匀静脉泵入。对照组采用恩度静脉滴注+TP方案:化疗方案同试验组,同时给予恩度7.5 mg/m2,加入0.9%氯化钠溶液500 ml中缓慢滴注,每天滴注3~4 h,每21天一个疗程。上述方案至少完成4周期。
1.4 VEGF检测患者均于治疗前后分别抽取静脉血10 ml,应用酶联免疫吸附实验检测血清中VEGF的含量,严格按照说明书操作,操作均由主管技师完成,严格质控。
1.5 观察指标观察两组近期疗效,分别于治疗前、治疗2周期后、治疗4周期后测定血清VEGF水平,并进行常规CT检查,测定肿瘤大小,比较治疗前后肿瘤大小及VEGF的变化。
1.6 疗效及不良反应评价标准根据RECIST标准进行评价,包括完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD),以CR+PR计算有效率(RR),以CR+PR+SD计算疾病控制率(DCR)。药物不良反应按照NCI-CTC3.0分级标准评价,分为0~4级。治疗结束后进行影像学复查及肿瘤病灶测量,达CR或PR的患者于1月后再次复查,如仍符合CR或PR条件者,则计为CR或者PR。根据CTCAE4.0标准,治疗期间每周查血常规1~2次,每个周期监测肝肾功能、心电图1次,并详细记录治疗期间检查结果及出现的各种不良反应,及时处理。
1.7 统计学方法数据采用SPSS17.0软件进行处理,治疗前后组间近期疗效及不良反应率比较采用χ2检验,治疗前后差别采用配对t检验。P<0.05为差异有统计学意义。
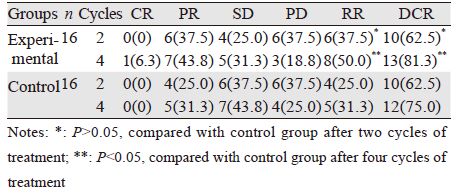
2 结果 2.1 两组近期疗效比较治疗2周期后两组均无CR患者,试验组缓解率为37.5%(6/16),总稳定率为62.5%(10/16);对照组缓解率为25.0%(4/16),总稳定率为62.5%(10/16)。治疗4周期后试验组缓解率为50.0%(8/16),总稳定率为81.3%(13/16);对照组缓解率为31.3%(5/16),总稳定率为75.0%(12/16)。无论是2周期还是4周期后,试验组缓解率及总稳定率均高于对照组,但差异均无统计学意义(P>0.05),见表 2。
32例患者全部可评价不良反应,主要不良反应为脱发、肌肉关节酸痛和胃肠道反应,两组比较差异无统计学意义(P>0.05)。试验组发生骨髓抑制2例,对照组9例,主要为Ⅰ度骨髓抑制,其中1例Ⅳ度骨髓抑制发生在对照组,发生心电图改变5例,主要表现为T波改变,轻度ST段压低及窦性心动过速。经对症治疗或停药后均可恢复正常。在骨髓抑制及心血管毒性方面两组比较,差异有统计学意义(P<0.05),见表 3。
 |
两组血清VEGF水平治疗前比较差异无统计学意义(P>0.05)。两组治疗后VEGF水平均较治疗前显著降低(P<0.01)。其中,治疗2周期后两组比较差异具有统计学意义(P<0.05),治疗4周期后试验组较对照组下降更为显著(P<0.01),见表 4。
 |
大多数卵巢癌发病隐匿,约75%患者发现时已属于晚期。对于晚期卵巢癌,肿瘤细胞减灭术加铂类/紫杉醇联合化疗,可暂时缓解病情,然而复发率却高达85%以上[5]。因此,探索特异性强、不良反应小且患者更容易耐受的新疗法显得尤为重要,近年来国内外关于分子靶向治疗的飞速发展为晚期卵巢癌的治疗开辟了新的时代。
血管生成是指活体组织在已存在的微血管床上芽生出以毛细血管为主的血管系统的过程。正常生理条件下,血管生成仅出现于胚胎发育期和组织损伤修复期,而异常的血管生成是肿瘤病理改变之一[2]。血管生成受多种血管生成因子和血管生成抑制物的严密调控,其中,血管内皮生长因子(VEGF)及其受体(VEGFR)被认为是作用最强、特异性最高的关键调控因子。Li等[6]证实肿瘤中VEGF的表达在恶性肿瘤、交界性肿瘤、良性肿瘤中依次下降,有淋巴转移者较无转移者显著增高。卵巢恶性肿瘤中VEGF的表达显著高于正常卵巢组织和卵巢良性肿瘤,提示VEGF在卵巢癌的发生和发展中起关键性作用[7]。这些研究结果为通过阻断VEGF的表达来治疗卵巢癌提供了依据。要使抗肿瘤新生血管治疗取得疗效,其前提是必须经过有效的化疗使肿瘤负荷下降,肿瘤活性明显下降,在此基础上加用抗肿瘤新生血管治疗,切断肿瘤的生长体系,同时协同加强化疗疗效,延长疗效时间[3]。近年来,贝伐单抗作为一种新型抑制肿瘤血管生成的分子靶向药物,在Ⅱ及Ⅲ期临床试验[8, 9]中,在治疗难治性及复发性卵巢癌及卵巢癌伴恶性腹水中,均取得了明确的治疗效果。
恩度是我国自行研制的一种多靶点的血管内皮抑制剂,其作用机制是通过抑制形成血管的内皮细胞迁移来达到抑制肿瘤新生血管生成,通过作用于肿瘤细胞的微环境来阻断肿瘤细胞营养供给,抑制肿瘤增殖或转移[10],从而延缓或者阻断肿瘤的进展,这可能与恩度对VEGF的抑制作用有关。恩度半衰期为8~12 h,恩度传统给药途径为7.5 mg/m2,每天静脉滴注3~4 h,连续14天,但静脉滴注的传统用法造成了药物浓度波动较大,且限制了恩度长周期给药患者的依从性。有研究显示,恩度的抑瘤作用具有时间及浓度依赖性,且随着用药时间的延长及一定范围内血药浓度的提高,其抗肿瘤作用也会随之增强。Kisker等[11]研究发现,给小鼠单次腹腔注射恩度,2 h内肿瘤组织内的恩度很快被清除;而通过微型渗透泵持续给药能使血药浓度长时间保持稳定,而且以单次注射的1/8剂量就可以获得同样的抗肿瘤效果。这可能由于恩度持续的静脉泵入给药,使药液持续均匀输入,延长了输注时间且能够维持稳定的血药浓度,使药物能够持续作用于新生血管的内皮细胞,从而取得更好的抑瘤效果。
本研究采用恩度静脉泵入联合化疗与静脉滴注联合化疗进行对比,试验组与对照组进行比较,有效率及总稳定率虽有提高,但差异无统计学意义(P>0.05),一方面这可能与本研究观察病例数较少,另一方面可能由于恩度作用靶点为肿瘤血管,并无细胞毒性,所以起效较慢。另有研究[12]证实恩度可以抑制卵巢癌细胞及移植瘤的生长,但目前恩度静脉泵对卵巢癌治疗疗效的相关研究并不多。
同时,本研究也针对患者血清VEGF水平进行测定,两组治疗后血清VEGF水平较治疗前均降低,差异有统计学意义(P<0.05),与一些研究结论[13, 14]一致,反映了化疗降低肿瘤负荷从而使VEGF水平降低。本研究发现治疗4周期后,试验组血清VEGF水平较对照组降低更为明显。这从一个侧面反映了恩度的抗血管生成及抑制VEGF表达的作用。这可能由于恩度的抗肿瘤作用具有明显的效应-时间依赖性,随着用药时间的延长,其抗肿瘤效果显著提高,从回顾性分析来看,恩度长周期和维持使用,将带来更大的获益[15]。Kubota[16]表示抗血管生成药物的治疗剂量不足会导致血管快速生长、限制抑制肿瘤的效果。因此,恩度长周期的应用和后续的维持治疗可能给患者带来更大的获益。
两组治疗后的主要不良反应为骨髓抑制、脱发及胃肠道反应,心血管毒性及神经毒性发生较少,而恩度常见的不良反应包括心脏不良反应、骨髓抑制、消化道不良反应及周围组织的过敏反应等。心脏不良反应主要表现为用药后2~7天内,心电图表现为I度心肌缺血,临床表现为胸闷、心悸、气短、乏力。本研究发现,实验组心脏不良反应及骨髓抑制的发生率明显低于对照组,差异具有统计学意义(P<0.05)。这可能是由于持续的静脉泵注给药,使单位时间进入体内的药量少,血药浓度波动小,对心脏、骨髓造血系统影响小。这说明,恩度静脉泵的使用可以进一步提高疗效,同时降低不良反应。
综上所述,晚期卵巢癌患者经恩度静脉泵联合TP方案化疗治疗后可有效下调晚期卵巢癌血清中VEGF的表达,近期疗效较好且不良反应轻微,还需要长时间随访、扩大样本量及采用新的临床疗效评判标准来进行更深入的探索。
| [1] | Gubbels, JA, Claussen, Kapur AK, et al. The detection, treatment, and biology of epithelial ovarian cancer[J]. J Ovarian Res, 2010, 3: 8. |
| [2] | Folkman J. Angiogenesis: an organizing principle for drug discovery?[J]. Nat Rev Drug discov, 2007, 6(4): 273-86. |
| [3] | Ohlund D, Ardnor B, Oman M, et al. Expression pattern and circulating levels of endostatin in patients with pancreas cancer[J]. Int J Cancer, 2008, 122(12): 2805-10. |
| [4] | Cao DD, Ge W, Wang HM, et al. Efficacy and safety of rh-endostain combined with chemotherapy versus chemotherapy alone for advanced NSCLC: a Meta-analysis review[J]. Zhongguo Fei Ai Za Zhi, 2011, 14(5): 404-13. [曹德东, 戈伟, 王慧敏, 等. 重组人血管内皮抑素联合化疗与单纯化疗在晚期非小细胞肺癌中疗效比较的系统评价[J]. 中国肺癌杂志, 2011, 14(5): 404-13.] |
| [5] | Liu AJ, Wei LX, Li YL. The research progess of ovarian cancer molecular targeted therapy[J/CD]. Zhonghua Lin Chuang Yi Shi Za Zhi (Dian Zi Ban), 2011, 5(7): 2008-11. [刘爱军, 韦立新, 李亚里. 卵巢癌分子靶向治疗的研究进展[J/CD]. 中华临床医师杂志(电子版), 2011, 5(7): 2008-11. |
| [6] | Li X, Liu B , Xiao J, et al. Roles of VEGF-C and Smad4 in the lymphangiogenesis, lymphatic metastasis and prognosis in colon cancer[J]. J Gastrointest Surg, 2011, 15(11): 2001-10. |
| [7] | Li L, Wang L, Zhang W, et al. Correlation of serum VEGF levels with clinical stage, therapy efficacy, tumor metastasis and patient survival in ovarian cancer[J]. Anticancer Res, 2004, 24(3b): 1973-9. |
| [8] | Penson RT, Dizon DS, Cannistra SA, et al. PhaseⅡstudy of carboplatin, paclitaxel, and bevacizumab with maintenance bevacizumab as first-line chemotherapy for advanced mullerian tumors[J]. J Clin Oncol, 2010, 28(1): 154-9. |
| [9] | Aghajanian C. The role of bevacizumab in ovarian cancer-an evolving story[J]. Gynecol Oncol, 2006, 102(2): 131-3. |
| [10] | Han B, Xiu Q, Wang H, et al. A multicenter, randomized, double-blind, placebo-controlled study to evaluate the efficacy of paclitaxel-carboplatin alone or with endostar for advanced non-small cell lung cancer[J]. J Thoracic Oncol, 2011, 6(6): 1104-9. |
| [11] | Kisker O, Becker CM, Prox D, et al. Continuous administration of endotatin by intraperitoneally implanted osmotic pump improves the efficacy and potency of therapy in a mouse xenograft tumor model[J]. Cancer Res, 2001, 61(20): 7669-74. |
| [12] | Xin G, Du J, Zhu L, et al. Differential anti-tumor effects for various regimens of endostar plus cisplatin in ovarian cancer[J]. Zhonghua Yi Xue Za Zhi, 2011, 91(47): 3367-70. [辛刚, 杜鹃, 朱琳, 等. 顺铂与重组人内皮抑素不同联合用药方案对裸鼠卵巢癌的疗效[J]. 中华医学杂志, 2011, 91(47): 3367-70.] |
| [13] | Teoh DG, Secord AA. Antiangiogenic therapies in epithelial ovarian cancer[J]. Cancer Control, 2011, 18(1): 31-43. |
| [14] | Jazaeri AA, Slack-Davis JK. The promise of antiangiogenic therapy for ovarian cancer[J]. Cancer Biol Ther, 2009, 8(23): 2273-4. |
| [15] | Jiang XD, Dai P, Wu J, et al. The recombinant human endostatin improves the blood perfusion and hypoxia in non-small cell lung cancer[J]. Zhonghua Lao Nian Yi Xue Za Zhi, 2011, 30(9): 737-41. [蒋晓东, 戴鹏, 吴瑾, 等. 重组人血管内皮抑素对非小细胞肺癌患者血流灌注和乏氧改善作用的观察[J]. 中华老年医学杂志, 2011, 30(9): 737-41.] |
| [16] | Kubota Y. Tumor angiogenesis and anti-angiogenic therapy[J]. Keio J Med, 2012, 61(2): 47-56. |
 2016, Vol. 43
2016, Vol. 43