文章信息
- 陈法,何保昌,黄江峰,刘芳萍,林李嵩,郑晓燕,蔡琳.
- HUANG Haibo,, LIU Kai, ZHAO Yan, GUO Yongjun, LIU Yanyan, YANG Shujun .
- 酸性富含半胱氨酸分泌型蛋白表达与
- Relationship of Secreted Protein Acidic and Rich in Cysteine Protein Expression with Prognosis of Postoperative Patients with Esophageal Squamous Cell Carcinoma
- 肿瘤防治研究, 2016, 43(01): 35-38
- Cancer Research on Prevention and Treatment, 2016, 43(01): 35-38
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.01.008
-
文章历史
- 收稿日期: 2015-03-02
- 修回日期: 2015-09-16
2. 453100 卫辉,新乡医学院第一附属医院肿瘤科
2. Department of Oncology, The First Affiliated of Xinxiang Medical University, Weihui 453100, China
食管癌是常见的消化系统肿瘤,发病特征有明显的地域性,我国尤其是河南省为高发区。食管癌中最常见的病理类型是食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)、食管腺癌(esophageal adenocarcinoma,EA)和食管小细胞癌。我国以食管鳞状细胞癌高发,显著不同于以食管腺癌为主的欧美国家。手术切除是早期食管癌患者首选的治疗方法,但多数患者术后仍发生复发或转移,因此探索影响术后生存预后的相关因素具有重要意义。
酸性富含半胱氨酸分泌型蛋白(secreted protein acidic and rich in cysteine,SPARC)是一种富含半胱氨酸的小分子糖蛋白,又被称作骨连接蛋白。SPARC作为一种非结构性基质糖蛋白,其功能非常复杂,参与机体多种生理、病理过程[1],同时也在改变肿瘤细胞活性及肿瘤的微环境中发挥显著作用[2]。研究发现其高表达于组织修复和侵袭性恶性肿瘤相关的纤维细胞和内皮细胞中,与肿瘤的发生、发展及预后密切相关[3]。本研究探讨SPARC蛋白与食管鳞癌患者术后临床特征及预后的相关性。
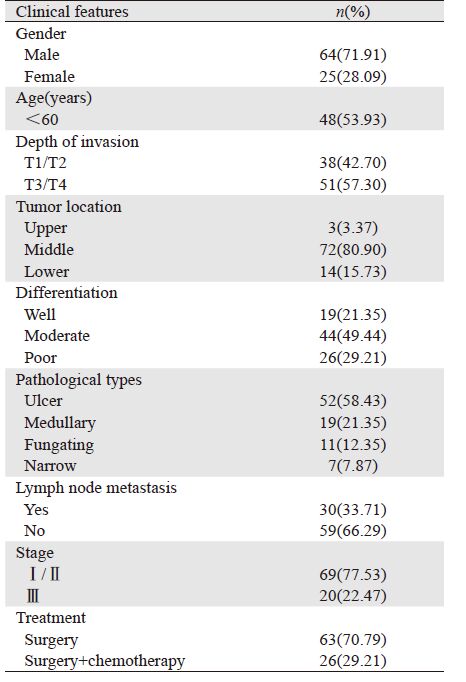
1 资料与方法 1.1 临床资料89例食管鳞癌组织标本、50例癌旁正常组织标本均来自郑州大学附属肿瘤医院2008年1月至2009年1月间住院患者的手术切除标本。所有患者术前均未行放疗、化疗或其他针对肿瘤的治疗,术后病理切缘均为阴性。患者的详细资料见表 1。本研究在实施前已得到我院伦理委员会的批准。
 |
肿瘤组织与癌旁正常组织,常规进行组织石蜡切片2~3 μm,放入烤箱过夜;二甲苯脱蜡30 min,梯度酒精80%、95%、100%乙醇各5 min彻底洗脱二甲苯;水化(流水冲洗10 min),高温高压柠檬酸修复液(pH6.0)加热30 s,室温下自然冷却,PBS液冲洗3次,每次3 min,滴加一抗SPARC鼠抗单克隆抗体4℃冰箱过夜;滴加二抗(室温40 min);PBS液冲洗3次,每次3 min,DAB显色,镜下观察;PBS液冲洗3次,每次3 min,流水冲洗,苏木精染色,2%盐酸分化液分化,碳酸锂饱和液返蓝,自来水冲洗,梯度酒精脱水80%、95%、100%乙醇各分2~3 min彻底脱水,二甲苯透明,封片,读片。
1.3 主要试剂SPARC鼠抗单克隆抗体(MOUSE ANTI-OSTEONECTIN/SPARC,货号335500)、SuperPictureTM聚合物检测试剂盒(SUPERPICTURE POLYMER BS KIT,878973)购于Life Technologies公司,DAB(二氨基联苯胺)显色剂、多聚赖氨酸、柠檬酸组织抗原修复液pH6.0(×100)、 0.01 mol/L PBS磷酸盐缓冲液购于福州迈新生物技术开发有限公司。
1.4 结果判定标准免疫组织化学的结果由两位病理科医师进行判定,对食管癌组织及癌旁正常组织中细胞染色的阳性颗粒进行观察。染色评分标准如下:根据阳性细胞百分率分为4个等级,0级:0~15%为0分;1级:>15%~30%为1分;2级:>30%~45%为2分;3级:>45%为3分;依据染色强度进行半定量判定,无色为0分,淡黄色即弱阳性为1分,棕黄色即中等染色强度为2分,棕褐色即强阳性为3分。该样本的最终染色分数为阳性细胞的百分率得分与染色强度得分的乘积,其中染色评分<2分为阴性(-);2~4分为弱阳性(+);≥4~6分为阳性(++);≥6分为强阳性(+++)。为了数据统计分析的方便,将(-)组定义为阴性表达组(-),将(+)、(++)和(+++)组定义为阳性表达组(+)。
1.5 统计学方法总生存期(overall survival,OS)定义为患者从手术至死亡的时间。所有数据采用SPSS17.0软件进行统计学分析,计数资料采用χ2检验及Logistic回归分析,生存分析采用Kaplan-Meier生存曲线及Log rank检验,全部统计方法均采用双侧检验,P<0.05为差异有统计学意义。
2 结果 2.1 SPARC蛋白在食管鳞癌及癌旁正常组织中的表达食管鳞癌组织中SPARC蛋白阳性表达率为65.17%(58/89);癌旁正常组织中的阳性率为8.00%(4/50);食管鳞癌组织中SPARC蛋白表达显著高于癌旁正常组织(χ2=12.230,P=0.000)。91.38%的患者(53/58)SPARC蛋白表达定位于癌细胞间质,8.62%的患者(5/58)SPARC蛋白表达定位于鳞癌细胞的胞质中,见图 1。

|
| A: SPARC expressed positively in esophageal squamous carcinoma stroma; B: SPARC expressed negatively in esophageal squamous carcinoma stroma; C: SPARC expressed negatively in adjacent tissues; SPARC: secreted protein acidic and rich in cysteine 图 1 SPARC蛋白在食管鳞癌及癌旁组织中的表达 (HE×200) Figure 1 SPARC expression in esophageal squamous carcinoma and adjacent tissues (HE×200) |
89例食管鳞癌患者根据病理形态分为溃疡型52例、髓质型19例、蕈伞型11例和缩窄型7例。SPARC蛋白在各型阳性表达率分别为溃疡型61.54%(32/52)、髓质型68.42%(13/19)、蕈伞型90.91%(10/11)和缩窄型42.86%(3/7),尽管结果显示蕈伞型阳性率最高,但差异无统计学意义(χ2=12.230,P=0.150)。
89例食管鳞癌患者根据肿瘤分化程度分为高分化19例、中分化44例和低分化26例,SPARC蛋白阳性表达率在各分化类型间差异也无统计学意义(χ2=0.640,P=0.730),分别为高分化57.89%(11/19例)、中分化65.91%(29/44例)和低分化69.23%(18/26例)。
2.3 SPARC蛋白表达与食管鳞癌淋巴结转移呈负相关单因素分析显示肿瘤分期(χ2=4.620,P=0.030)、淋巴结转移(χ2=4.590,P=0.030)与SPARC蛋白表达相关,肿瘤分期早和淋巴结无转移的患者SPARC蛋白表达多,其他临床特征与SPARC蛋白表达无相关性。多因素分析提示只有淋巴结转移与SPARC蛋白表达呈负相关[比值比OR=0.369,P=0.038]。
2.4 SPARC蛋白表达与食管鳞癌患者术后总生存的关系中位随访61.5月(6.1月~77.3月),SPARC阳性患者的总生存期为(60.92±3.45)月,SPARC蛋白阴性患者的总生存期为(55.68±5.65)月,Kaplan-Meier生存分析显示两者差异无统计学意义(χ2=0.99,P=0.32)。多因素Cox生存分期显示肿瘤部位(上、中、下段)、肿瘤分化程度(高、中、低)和肿瘤分期(Ⅰ/Ⅱ、Ⅲ期)是影响患者术后总生存的独立因素,而辅助治疗、性别、年龄、大体形态、肿瘤浸润深度和淋巴结转移不是影响患者术后总生存期的独立因素,见图 2。

|
| 图 2 食管鳞癌患者术后生存因素分析 Figure 2 Postoperative survival analysis of ESCC patients |
有研究报道食管鳞癌组织高表达SPARC蛋白,部分提示其定位于肿瘤组织细胞质和细胞核[4],也有研究报道其优势表达于肿瘤细胞间质[5, 6]。本研究证实SPARC蛋白优势定位于肿瘤间质,这与SPARC蛋白在组织修复和侵袭性恶性肿瘤相关的纤维细胞和内皮细胞中高表达[3]的结果一致。Xue等[7]研究发现食管浸润癌组织中SPARC蛋白表达显著高于食管不典型增生和原位癌,结果提示肿瘤间质中SPARC蛋白的表达有助于食管鳞癌的局部发展。
SPARC蛋白作为参与食管癌局部进展的重要分子,其与食管癌临床侵袭性和预后的关系尚不明确。车轶群等[4]研究了36例食管鳞癌的手术标本,发现SPARC蛋白表达与肿瘤分化程度无关,而与淋巴结转移呈正相关。杨锡贵等[5, 6]研究发现SPARC蛋白表达与肿瘤分化程度和浸润深度无关,与淋巴结转移呈正相关,且与不良生存预后相关。Porte等[8]研究揭示SPARC蛋白与肿瘤大小、淋巴结状态、癌旁组织浸润、疾病复发和总体生存均无关。本研究发现SPARC蛋白表达与食管鳞癌分化程度和浸润深度无关,与肿瘤部位、大体形态、性别和年龄也无关。与其他研究不同,本研究发现SPARC蛋白与食管鳞癌患者的淋巴结转移和肿瘤分期有关,但都呈负相关,即SPARC蛋白高表达的患者肿瘤分期早,且不易发生淋巴结转移。这种不一致的结果不仅反映食管鳞癌患者的异质性,也提示SPARC蛋白在肿瘤发生发展中的复杂作用。研究发现高表达的SPARC蛋白在黑色素瘤、前列腺癌中能够促进肿瘤的生长和转移;而在胰腺癌、结直肠癌中,作为抗肿瘤因子可以抗血管生成、促凋亡、抑制细胞增殖、阻止细胞周期,抑制肿瘤生长[9, 10, 11]。本研究未发现食管鳞癌术后患者SPARC蛋白表达与生存预后相关,而肿瘤的临床特征如部位、分化程度和分期显示与生存显著相关。有研究[12]发现虽然单一SPARC蛋白表达与食管癌的预后无关,但是联合Laminine-5 γ2的表达显示与不良预后相关。
SPARC蛋白作为一种非结构性基质糖蛋白,在食管鳞癌肿瘤微环境中的作用值得深入探讨。有研究表明,新型化疗药物白蛋白结合型紫杉醇可以利用与肿瘤组织间SPARC蛋白高亲和力的优势进入肿瘤微环境,增高肿瘤部位的药物浓度,达到靶向杀灭肿瘤的作用。此结果已在胰腺癌的相关研究[13]中证实,因此,SPARC蛋白表达对晚期食管鳞癌化疗疗效的影响也值得研究。
| [1] | Chlenski A, Cohn SL. Modulation of matrix remodeling by SPARC in neoplastic progression[J]. Semin Cell Dev Biol, 2010, 21(1): 55-65. |
| [2] | Nagaraju GP, Dontula R, El-Rayes BF, et al. Molecular mechanisms underlying the divergent roles of SPARC in human carcinogenesis[J]. Carcinogenesis, 2014, 35(5): 967-73. |
| [3] | Nagaraju GP, Sharma D. Anti-cancer role of SPARC, an inhibitor of adipogenesis[J]. Cancer Treat Rev, 2011, 37(7): 559-66. |
| [4] | Che YQ, Wang H, Qi J, et al. The analysis of the SPARC protein expression and clinical significance in esophageal squamous cell carcinoma[J]. Zhongguo Zhong Liu Lin Chuang, 2006, 33(2): 61-3. [车轶群, 王海, 齐军, 等. 食管鳞癌组织中SPARC蛋白表达的临床意义[J]. 中国肿瘤临床, 2006, 33(2): 61-3.] |
| [5] | Yang XG, Jiang C, Liu F, et al. SPARC protein expression and clinical significance in esophageal squamous cell carcinoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2012, 39(10): 1240-2. [杨锡贵, 姜超, 刘封, 等. SPARC 蛋白在食管鳞癌组织中的表达及临床意义[J]. 肿瘤防治研究, 2012, 39(10): 1240-2.] |
| [6] | Yang XG, Giang C, Liu F, et al. The relationship between SPARC protein expression and the survival in esophageal squamous cell carcinoma[J]. Zhonghua Xiao Hua Za Zhi, 2013, 33(3): 197-8. [杨锡贵, 姜超, 刘封, 等. 食管鳞状细胞癌组织中酸性富含半胱氨酸分泌型蛋白的表达与生存的相关性[J]. 中华消化杂志, 2013, 33(3): 197-8.] |
| [7] | Xue LY, Hu N, Song YM, et al. Tissue microarray analysis reveals a tight correlation between protein expression pattern and progression of esophageal squamous cell carcinoma[J]. BMC Cancer, 2006, 6: 296. |
| [8] | Porte H, Triboulet JP, Kotelevets L, et al. Overexpression of stromelysin-3, BM-40/SPARC, and MET genes in human esophageal carcinoma: implications for prognosis[J]. Clin Cancer Res, 1998, 4(6): 1375-82. |
| [9] | Tang L, Feng J. SPARC in tumor pathophysiology and as a potential therapeutic target[J]. Curr Pharm Des, 2014, 20(39): 6182-90. |
| [10] | Derosa CA, Furusato B, Shaheduzzaman S, et al. Elevated osteonectin/SPARC expression in primary prostate cancer predicts metastatic progression[J]. Prostate Cancer Prostatic Dis, 2012, 15(2): 150-6. |
| [11] | Miyoshi K, Sato N, Ohuchida K, et al. SPARC mRNA expression as a prognostic marker for pancreatic adenocarcinoma patients[J]. Anticancer Res, 2010, 30(3): 867-71. |
| [12] | Xue LY, Zou SM, Zheng S, et al. Expressions of the γ2 chain of laminin-5 and secreted protein acidic and rich in cysteine in esophageal squamous cell carcinoma and their relation to prognosis[J]. Chin J Cancer, 2011, 30(1): 69-78. |
| [13] | Thota R, Pauff JM, Berlin JD. Treatment of metastatic pancreatic adenocarcinoma: a review[J]. Oncology (Williston Park), 2014, 28(1): 70-4 |
 2016, Vol. 43
2016, Vol. 43