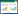文章信息
- 迪力亚尔·吐尔洪,哈木拉提·吐送,阿斯木江·阿不拉,王玉杰. 2015.
- Diliyaer·Tuerhong, Hamulati·Tusong, Asimujiang ·Abula, WANG Yujie. 2015.
- 经直肠超声、超声造影与磁共振动态增强成像在前列腺癌诊断中临床价值比较
- Comparison of Clinical Value of Transrectal Ultrasound, Contrast-enhanced Ultrasonography and Dynamic Contrast Material-enhanced Magnetic Resonance Imaging for Detecting Prostate Carcinoma
- 肿瘤防治研究, 2015, 42(09):915-919
- Cancer Research on Prevention and Treatment, 2015, 42(09):915-919
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.09.012
-
文章历史
- 收稿日期:2014-09-26
- 修回日期:2015-03-20
前列腺癌是欧美老年男性最常见的恶性肿瘤[1]。 我国前列腺癌的发病率及死亡率逐年上升[2]。早期发现前列腺癌,预防局部进展或转移是降低前列腺癌病死率并提高生活质量的关键,目前各类影像学技术的迅速发展进一步提高了前列腺癌的诊断水平。本研究旨在比较研究经直肠超声、超声造影与磁共振动态增强成像诊断前列腺癌的临床价值。
1 资料与方法 1.1 研究对象回顾性分析新疆医科大学第一附属医院泌尿外科2010年1月1日至2014年1月1日收治的疑诊为前列腺癌的患者资料,从中筛选出入院均行TRUS、CEUS、DCE-MRI后统一行经典系统穿刺活检术的患者,共有63例。年龄45~79岁,平均年龄69.85岁,PSA 4.03~90.62 ng/ml,平均值21.03。通过病理学证实,前列腺癌20例、前列腺良性病变43例。
1.2 检查仪器与方法 1.2.1 检查仪器(1)TRUS与CEUS:选用Philips IU-22彩色超声诊断仪,频率5.0~10 MHz,端扫式腔内探头,配有实时造影成像软件。造影剂使用Broaccl公司的SonoVue。(2)MRI:选用GEl.5T磁共振仪,腹部包裹线圈,增强剂使用钆喷替酸葡甲胺(Gd-DTPA)。
1.2.2 方法(1)TRUS及CEUS检查:所有患者检查前清洁灌肠,患者左侧膝胸卧位,首先对每位患者行经直肠常规超声检查,探查前列腺的大小,形态,有无结节,边界及血流情况。测出可疑病灶区域最大切面后切换为实时腔内超声造影成像模式,使用5 ml 0.9%氯化钠溶液溶解造影剂,振荡混匀后抽取2.4 ml,经肘静脉团注,随即快速注入5 ml 0.9%氯化钠溶液。团注造影剂同时开始计时,实时观察增强过程,记录动态图像,利用软件分析。采用双盲法由两名具5年以上超声造影工作经验医生对双侧前列腺进行对称观察、判断是否异常灌注。(2)DCE-MRI检查:患者取仰卧位,首先进行磁共振常规扫描,扫描顺序:失状位、轴位T2WI及T1WI,脂肪抑制冠状位、轴位T2WI。增强扫描时用钆喷替酸葡甲胺,剂量0.1 ml/kg。注药后马上进行冠状位、失状位、轴位T1WI ,其中轴位T1WI扫描10~15 min后进行。平扫与增强扫描参数相同,快速自旋回波(TSE)序列T2WI(TR:4 000 ms,TE:85 ms)、T1WI(TR:500 ms,TE:14 ms),采集次数1~2次,层厚:5.0 mm;层间隔:1.0 mm。对图像进行多平面重建处理。采用双盲法由两名具5年以上磁共振工作经验医生观察处理后的图像,判断是否异常灌注。
1.2.3 病理检查穿刺标本用10%福尔马林分别固定后送病理检查。
1.3 统计学方法数据均采用SPSS19.0统计软件进行分析,以病理学检查结果为诊断金标准,分别计算TRUS、CEUS、DCE-MRI诊断前列腺癌的特异性、敏感度、准确率,组间率的比较采用卡方检验,P﹤0.05为差异有统计学意义。绘制ROC曲线(receiver operating characteristic,ROC)并比较曲线面积。
2 结果本研究63例患者均行前列腺穿刺活检术,其中病理结果证实为前列腺癌共20例,其余43例为前列腺良性增生,其中前列腺增生伴前列腺炎14例、单纯增生29例。TRUS、CEUS及DCE-MRI诊断结果,三者对前列腺癌的敏感度、特异性及准确率见表 1。
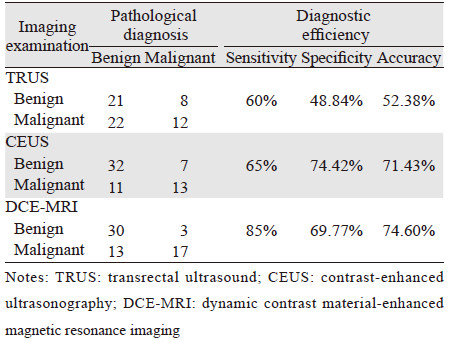 |
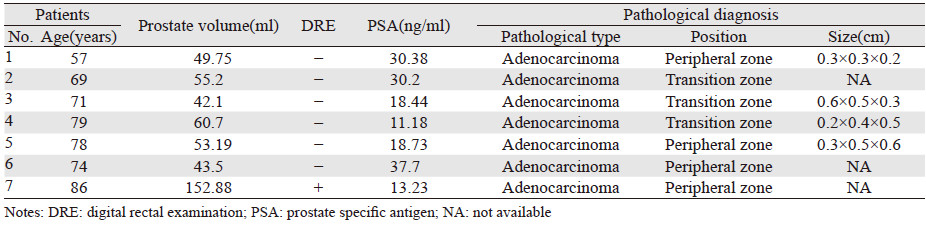
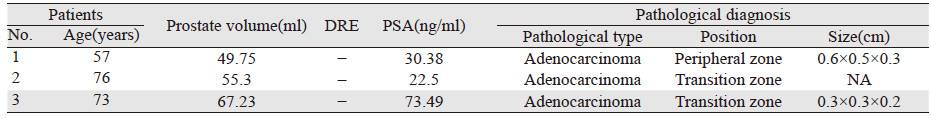
TRUS、CEUS、DCE-MRI三种影像学检查方法对前列腺癌的诊断价值差异无统计学意义(P=0.199)。以病理诊断证实为前列腺癌的患者分别在CEUS及DCE-MRI中漏报情况见表 2~3。前列腺癌病灶在TRUS和CEUS的声像图中的典型表现见图 1~2,在DCE-MRI中的典型表现见图 3~4。TRUS、CEUS及DCE-MRI诊断前列腺癌的ROC曲线见表 4、图 5。
 |
 |
 |
|
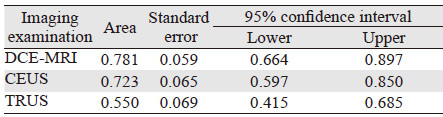
| 图 1 经直肠超声图可见右侧外腺界线模糊局限性低回声区 Figure 1 TRUS image showed right outer gland with fuzzy boundary and limited low echo area |
|
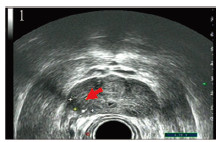
| 图 2 超声造影图可见右侧外腺病灶区较周围前列腺实质明显强化 Figure 2 CEUS image showed right outer gland lesion area was significantly enhanced |
|
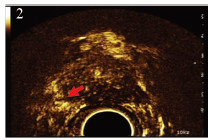
| 图 3 磁共振T2抑脂图像,右侧外腺病灶明显低信号 Figure 3 T2WI showed right outer gland lesion with significantly low signal |
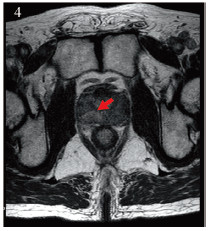
|
| 图 4 磁共振T1增强图像,右侧外腺病灶明显强化 Figure 4 T1WI showed right outer gland lesion was significantly enhanced |
随着我国老年化水平的提高,前列腺癌发病率逐年升高,前列腺癌的确诊日益显得更为重要。目前前列腺穿刺活检是前列腺癌的确诊依据,但穿刺术给患者带来一定程度的创伤及痛苦,操作较复杂,价格也不低,存在术后并发症发生可能,故在前列腺癌诊断并了解侵润范围及转移等相关情况时影像学仍然具有无法代替的作用。目前TRUS、CEUS及MRI等检查已成为前列腺癌诊断最常用的检查手段,但因检查原理及设备不同,其在前列腺癌的诊断中各有其特点。
TRUS检查痛苦小、简单易行且费用低廉,是目前应用最为广泛的前列腺检查方法,但其特异性仅为40%~50%[3]。前列腺癌在超声检查中通常描述为低回声病灶[4]。但约40%恶性病变为等回声病灶,1%可能表现强回声病灶[5]。此外,尸检研究显示超声引导下经直肠前列腺穿刺敏感度差,只有30%的前列腺癌检测率[6]。因此TRUS在前列腺癌诊断、分期以及制定诊疗计划中价值有限。
CEUS静脉注射微泡造影剂时造影剂足够小能穿过微血管,当微泡造影剂灌注血管时多普勒信号明显增加,特别是在血管密度增加区,如前列腺肿瘤[7, 8]。因此可用于加强前列腺癌微血管的可视化[9, 10]。Xie等[11]研究发现,超声造影引导下靶向活检敏感度和准确率分别为50.9%(P<0.001)和78.8%(P<0.001),有助于提高前列腺癌的检测率。Seitz等[12]概述经直肠超声造影与经直肠超声之间的检出率和预测值的差异。每个患者中经直肠超声造影检查的敏感度、特异性、阳性预测值(PPV)、阴性预测值(NPV)分别为71.0%、50.0%、91.7%、18.2%与经直肠超声对比(敏感度45.2%、特异性75%、PPV 93.3%、NPV 18%),CEUS明显优越(P=0.004)。
MRI具有高分辨率常规扫描和功能成像等技术特点,使其在前列腺癌的诊断中价值更为突出。Buckley等[13]研究报道DCE-MRI有助于前列腺癌病灶的定位和检出。国内研究表明TRUS联合MRI优于单独应用TRUS及MRI,各项统计学指标均有上升[14, 15]。赵丽霞等[16]研究表明CEUS、DCE-MRI及两者联合对前列腺癌诊断的敏感度分别为73.91%、82.61%和91.30%,特异性分别为76.92%、71.15%和57.69%,诊断准确率分别为76.92%、74.67%和68%,得出CEUS、DCE-MRI对前列腺癌的检出各具优势,两者的联合应用可有效提高诊断灵敏度,为前列腺癌的检出提供有力支持。但DCE-MRI存在检查步骤繁琐、价格昂贵、禁忌证多等缺陷。
本研究结果显示,前列腺癌在TRUS声像图上多样表现,且同一种特点的声像图又可以与多种病变相对应,导致TRUS前列腺癌检出率降低。 CEUS、DCE-MRI两种检查方法比TRUS可提高前列腺癌的检出率。分析各检查漏诊原因,经病理证实前列腺癌患者共20例,CEUS假阳性为11例,其中5例患者为前列腺增生伴慢性炎性反应,6例为单纯生增生。前列癌病灶为了满足生长和营养需求,促进局部范围内的新生微血管来维持及增加病灶内的血流灌注,从而获得更多的氧分和营养成分。CEUS通过造影剂增加新生微血管的显影,从而显示与正常前列腺组织的差异。由于前列腺的主要血供来自小的前列腺动脉,CEUS声像图中正常情况下表现为少血供,总体前列腺弱增强,外腺的增强晚于内腺。大多数前列腺癌病灶的增强速度,灌注强度高于正常前列腺组织,表现为形态不规则的强回声。当出现前列腺良性增生等病变时大多数可表现为周围正常组织同步灌注及增强,当前列腺增生、前列腺炎、上皮内瘤变等疾病进展的情况下细胞的增殖已超过细胞死亡引起微血管的密度增加或前列腺结石时由于外形不规则、体积较大、边界不清楚等表现,也可表现为强回声。因此临床当中单独通过声像图来诊断病灶的定性诊断,易致假阳性结果。CEUS假阴性为7例,直肠指检很难触及异常结节,其中4例病灶位于外周带,3例病灶位于移行区。由于病灶位于前列腺深部并且体积较小不侵犯包膜,前列腺炎、上皮内瘤变等疾病的影响,易致假阴性结果。MRI假阳性为13例,其中6例为前列腺增生伴慢性炎性反应,7例为单纯生增生。当前列腺增生、前列腺炎等疾病出现时前列腺的体积增大或出现结节压迫外周带使其变薄,导致图像上出现异常信号,假包膜和(或) 前列腺包膜显示不清,易致假阳性结果。MRI假阴性为3例,直肠指检未触及异常结节。其中1例病灶位于外周带,2例病灶位于移行区。MRI对体积较小、微血管密度低、缺乏血供的前列腺癌有一定困难,易致假阴性诊断。另外,前列腺系统性穿刺活检也会有大约35%漏诊率[17]。可见出现假阳性及假阴性是多因素综合作用的结果。因此当使用CEUS及DCE-MRI检查时通过增加有经验的技术人员、软件分析各项增强数据、结合患者的其他辅助检查结果和病史可以降低假阳性和假阴性率。
综上所述,TRUS、CEUS、DCE-MRI三种影像学检查方法在临床上常用于前列腺癌的检出,虽然前列腺癌通常很难单独通过影像学检查确诊,但随着影像学技术的进步可以提高前列腺癌检出率,并合理指导临床决策,尽可能降低不必要的穿刺活检,使穿刺活检术更具针对性。
| [1] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90. |
| [2] | Center MM, Jemal A, Lortet-Tieulent J, et al. Variation in prostate cancer incidence and mortality rates[J]. Eur Urol, 2012, 61(6): 1079-92. |
| [3] | Beerlage HP, Aarnink RG, Ruijter ET, et al. Correlation of transrectal ultrasound, computer analysis of transrectal ultrasound and histopathology of radical prostatectomy specimen[J]. Prostate Cancer Prostatic Dis, 2001, 4(1): 56-62. |
| [4] | Rifkin MD, Dahnert W, Kurtz AB. State of the art: endorectal sonography of the prostate gland[J]. AJR Am J Roentgenol, 1990, 154(4): 691-700. |
| [5] | Shinohara K, Wheeler TM, Scardino PT. The appearance of prostate cancer on transrectal ultrasonography: correlation of imaging and pathological examinations[J]. J Urol, 1989, 142(1): 76-82. |
| [6] | Delongchamps NB, de la Roza G, Jones R, et al. Saturation biopsies on autopsied prostates for detecting and characterizing prostate cancer[J]. BJU Int, 2009, 103(1): 49-54. |
| [7] | Sedelaar JP, van Leenders GJ, Hulsbergen-van de Kaa CA, et al. Microvessel density: correlation between contrast ultrasonography and histology of prostate cancer[J]. Eur Urol, 2001, 40(3): 285-93. |
| [8] | Strohmeyer D, Frauscher F, Klauser A, et al. Contrast-enhanced transrectal color doppler ultrasonography (TRCDUS) for assessment of angiogenesis in prostate cancer[J]. Anticancer Res, 2001, 21(4B): 2907-13. |
| [9] | Goldberg BB, Liu JB, Forsberg F. Ultrasound contrast agents: a review[J]. Ultrasound Med Biol, 1994, 20(4): 319-33. |
| [10] | Goldberg BB, Raichlen JS, Forsberg F. Ultrasound contrast agents: basic principles and clinical applications[M]. 2nd edition. London: Martin Dunitz, 2001. |
| [11] | Xie SW, Li HL, Du J, et al. Contrast-enhanced ultrasonography with contrast-tuned imaging technology for the detection of prostate cancer: comparisonwith conventional ultrasonography[J]. BJU Int, 2012, 109(11): 1620-6. |
| [12] | Seitz M, Gratzke C, Schlenker B, et al. Contrast-enhanced transrectal ultrasound (CE-TRUS) with cadence-contrast pulse sequence (CPS) technology for the identification of prostate cancer[J]. Urol Oncol, 2011, 29(3): 295-301. |
| [13] | Buckley DL, Roberts C, Parker GJ, et al. Prostate cancer: Evaluation of vascular characteristics with dynamic contrast-enhanced Tl-weighted MR imaging, initial experience[J]. Radiology, 2004, 233(3): 709-15. |
| [14] | Qiao FL, Yuan JJ, Liu Y, et al. Appliaction value of transrectal ultrasound combined with magnetic resonance imaging in prostate disease[J]. Zhongguo Lao Nian Yi Xue Za Zhi, 2010, 30(9): 1198-9.[乔峰利, 袁建军, 刘烨, 等. 经直肠超声联合核磁共振成像在前列腺疾病诊断中的应用价值[J]. 中国老年医学杂志, 2010, 30(9): 1198 -9.] |
| [15] | Wang XY, Liao MZ, Nong MF, et al. Characteristic of ultrasonography of transrectal and color doppler for diagnosing prostate carcimoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2010, 37(6): 696-8.[王小燕, 廖明珠, 农美芬, 等. 前列腺癌径直肠超声及彩色多普勒特征探讨[J]. 肿瘤防治研究, 2010, 37(6): 696-8.] |
| [16] | Zhao LX, Wu R, Xu G, et al. Comparison of contrast-enhanced ulturasonography with dynamic contrast material-enhanced magnetic resonance imaging for prostate cancer detection[J].Zhonghua Lin Chuang Yi Shi Za Zhi(Dian Zi Ban), 2013, 7(21): 9453-7.[赵丽霞, 吴蓉, 徐光, 等. 超声造影与磁共振动态增强成像对前列腺癌的诊断价值比较[J]. 中华临床医师杂志(电子版), 2013, 7(21): 9453-7.] |
| [17] | Aigner F, Pallwein L, Schocke M, et al. Comparison of real-time sonoelastography with T2-weighted endorectal magnetic resonance imaging for prostate cancer detection[J]. J Ultrasound Med, 2011, 30(5): 643-9. |
 2014, Vol. 42
2014, Vol. 42