文章信息
- 贾存东,李晓波,李艳红,梁莉萍,白靖平. 2015.
- JIA Cundong, LI Xiaobo, LI Yanhong, LIANG Liping, BAI Jingping. 2015.
- 弥漫性大B细胞淋巴瘤中mTOR与MRP1的表达及相关性分析
- Correlation of mTOR and MRP1 Expression in Patients with Diffuse Large B-cell Lymphoma
- 肿瘤防治研究, 2015, 42(09): 900-904
- Cancer Research on Prevention and Treatment, 2015, 42(09): 900-904
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.09.009
-
文章历史
- 收稿日期:2014-09-19
- 修回日期:2015-01-23
2. 830011 乌鲁木齐,中国科学院新疆理化技术研究所;
3. 830011 乌鲁木齐,新疆医科大学附属肿瘤医院病理科;
4. 830011 乌鲁木齐,新疆医科大学附属肿瘤医院骨肿瘤科
2. Xinjiang Technical Institute of Physics&Chemistry, Chinese Academy of Sciences, Urumqi 830011, China;
3. Department of Pathology, Affiliated Tumor Hospital,Xinjiang Medical University, Urumqi 830011, China;
4. Department of Bone Oncology, Affiliated Tumor Hospital, Xinjiang Medical University, Urumqi 830011, China
弥漫性大B细胞淋巴瘤(Diffuse large B-cell lymphoma,DLBCL)是非霍奇金淋巴瘤(Non- Hodgkin's lymphoma,NHL)最常见的病理亚型之一。虽然多数DLBCL患者可获得治愈,但仍有30%~40%患者死于疾病进展与复发,研究提示多药耐药(multi-drug resistance,MDR)相关蛋白1(multidrug resistance protein 1,MRP1)在DLBCL的进展与复发过程中起着重要作用[1, 2],但其调控机制目前尚不清楚。最近研究表明,雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)在DLBCL中存在着异常表达[2, 3],并可能与其耐药机制相关,但尚不明了mTOR与MRP1在DLBCL中的相关性,为此本研究检测了109例DLBCL患者mTOR与MRP1 mRNA的表达,结果报道如下。
1 资料与方法 1.1 研究对象收集2010年1月—2013年6月间确诊的新疆汉族及维吾尔族DLBCL患者共109例。按WHO(2008年)淋巴瘤分类标准,所有病例均经组织形态学和免疫组织化学分析明确诊断为DLBCL。109例患者中,汉族49例、维吾尔族60例;男67例、女42例,男女比例为1.6:1;确诊时中位年龄52岁(17~83岁);按Ann Arbor分期标准,Ⅰ期5例、Ⅱ期51例、Ⅲ期24例、Ⅳ期29例;确诊时病变累及淋巴结及受侵≤1个结外淋巴结患者63例(57.8%)、病变累及≥2个结外部位患者46例(42.2%);确诊时按美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)判定体力状态(performance status)评分,0~1分患者103例(94.5%)、2分者6例(5.5%);18.3%(20/109)的患者血浆乳酸脱氢酶(lactate dehydrogenase,LDH)高于正常水平;16.5%(18/109)患者伴有B症状;大肿块患者7例(6.4%)。大肿块定义为:胸部X线片肿块最大径>胸腔最大内经的1/3,或在胸椎5~6水平纵隔肿块>胸腔最大内经的35%,或行CT检查显示任何部位的肿块直径≥10 cm,符合上述三者之一者即为大肿块;根据国际预后指数(international prognostic index,IPI):低危组(IPI 0~1)85例、低中危组(IPI 2)12例、中高危组(IPI 3)6例、高危组(IPI 4~5)6例。根据Choi免疫学分型法则[4],生发中心样B细胞(germinal center B-cell like,GCB)型DLBCL与non-GCB 型DLBCL的例数分别为35例与74例。
1.2 试剂TRIzol试剂购自上海Invitrogen公司,RT-PCR试剂盒、TBST、二抗为辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔多克隆抗体、内参磷酸甘油醛脱氢(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为单克隆小鼠抗人GAPDH抗体、二抗为HRP标记的山羊抗小鼠多克隆抗体、ECL发光液、BCA蛋白浓度测定试剂盒均购自美国CWbio公司。
1.3 方法 1.3.1 Western blot法检测p-mTOR的表达将冻存的组织标本蛋白裂解液,置匀浆器中研磨,使之充分匀浆化。冰浴60 min后,以12 000 r/min低温离心15 min,取上清液,用BCA法测上清蛋白浓度,取100 μg蛋白进行聚丙烯酰胺凝胶电泳,聚偏氟乙烯膜电转移,含5%脱脂奶粉的TBST溶液封闭非特异性抗原,然后分别加入山羊抗兔IgG(1:10 000)及GAPDH小鼠抗人单克隆抗体(1:1 000),4℃孵育过夜,次日用TBST液洗膜3次,每次10 min,加入HRP标记的山羊抗小鼠抗体(1:10 000)37℃孵育1 h,TBST洗膜3次,每次10 min,ECL化学发光试剂自显影。
1.3.2 RT-PCR法检测MRP1 mRNA的表达新鲜组织研磨,加入TRIzol溶液,提取RNA,反转录;反转录所得cDNA进行PCR,反应总体积为20 μl,反应体系为cDNA 3 μl、1 mmol/L MRP引物各1 μl(正义:5'- AACCTGGACCCATTCAGCC-3',反义:5'-GACTGGATGAGGTCGTCCGT-3'),1 mmol/L GAPDH引物各1 μl(正义:5'-TGACGTGGACATCCGCAAAG-3',反义:5'- CTGGAAGGTGGACAGCGAGG-3')作为内对照,反应条件为94℃预变性2 min,然后94℃ 45 s、55℃ 60 s、65℃ 60 s,循环35次,65℃ 10 min终止反应。PCR产物10 μl进行1%的琼脂糖凝胶电泳。
1.4 随访采用门诊随访和电话随访。随访截止日期为2013年12月31日。疾病无进展生存(progression free survival,PFS)时间指治疗之日至病情进展、死亡的时间,以月为单位。
1.5 统计学方法采用SPSS16.0统计软件进行分析。计数资料用χ2检验;Kaplan-Meier法进行生存分析,Log rank法比较组间生存率。P<0.05为差异有统计学意义。
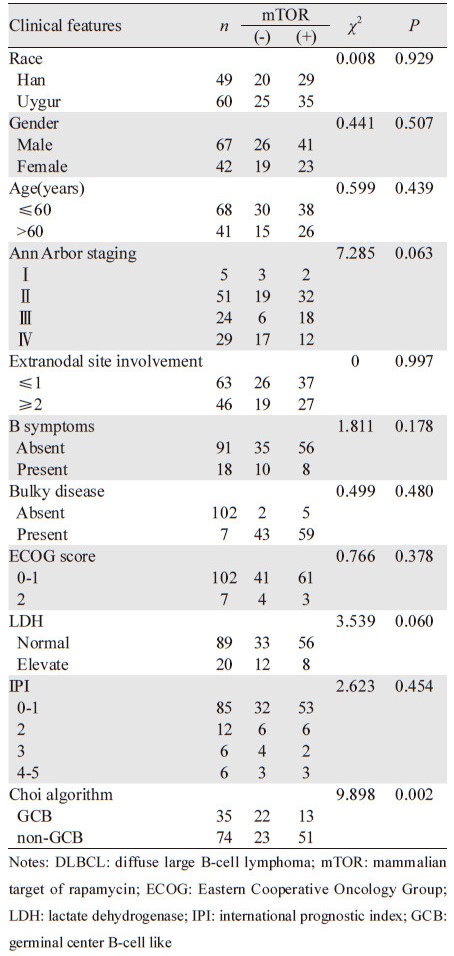
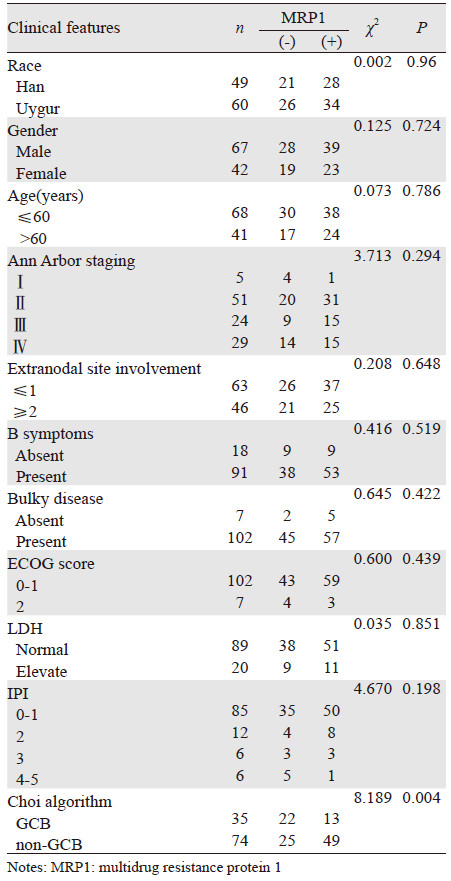
2 结果 2.1 p-mTOR、MRP1 mRNA在DLBCL中的表达p-mTOR在DLBCL中的阳性率为58.7%(64/109),p-mTOR的表达在GCB组与non-GCB组DLBCL患者中的阳性率分别为37.1%和68.9%,差异具有统计学意义(P=0.002);但p-mTOR与DLBCL患者的族别、性别、年龄、Ann Arbor分期、B症状、结外病变、LDH水平及IPI无相关性,见表 1、图 1。MRP1 mRNA在全组DLBCL患者中的阳性率为56.9%(62/109),MRP1 mRNA在GCB组与non-GCB组DLBCL患者中的阳性率分别为37.1%和66.2%,两组差异有统计学意义(P=0.004),但MRP1 mRNA与DLBCL患者的族别、性别、年龄、Ann Arbor分期、B症状、结外病变、LDH水平及IPI无相关性(P>0.05),见表 2、图 2。
 |
|
| 1: negative control group; 2, 3, 5: germinal center B-cell like GCB group; 4: non-GCB group 图 1 Western blot检测p-mTOR在DLBCL中的表达 Figure 1 The expression of p-mTOR in DLBCL specimen detected by Western blot |
 |
|
| 1: marker; 2: control group; 3: non-GCB group; 4: GCB group 图 2 RT-PCR检测MRP1在DLBCL中的表达 Figure 2 The expression of MRP1 gene in DLBCL specimen assayed by RT-PCR |
在109例DLBCL患者中,p-mTOR蛋白表达与MRP1基因扩增显著相关(P=0.003),见表 3。
 |
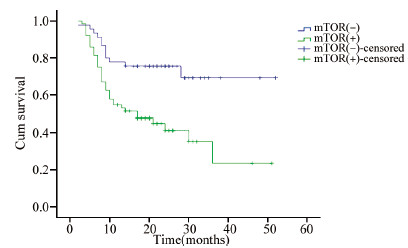
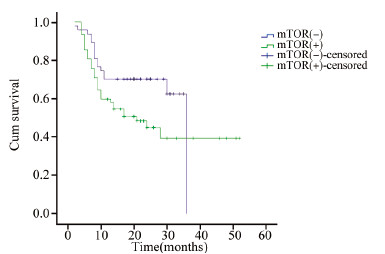
截至随访日期,中位随访时间为18月(2~52月),疾病进展或死亡患者49例,无复发生存患者60例。p-mTOR表达阳性组、阴性组患者PFS比较具有统计学意义(P=0.001),生存曲线见图 3;MRP1 mRNA扩增阳性组、阴性组患者PFS比较具有统计学意义(P=0.048),生存曲线见图 4。
|
| 图 3 p-mTOR表达阴性DLBCL患者与p-mTOR表达阳性DLBCL患者的生存曲线 Figure 3 Survival curves of DLBCL positive and negative p-mTOR expression |
|
| 图 4 MRP1表达阴性DLBCL患者与MRP1表达阳性DLBCL患者的生存曲线 Figure 4 Survival curves of DLBCL in patients with positive and negative MRP1 expression |
DLBCL虽已进入利妥昔单抗治疗时代,但仍有30%~40%患者死于疾病进展与复发,MDR是DLBCL患者疾病进展与复发的重要因素之一[1, 5]。研究表明MDR的发生与MRP1的产生有关[6, 7],MRP1是1992年由Cole等在耐阿霉素的小细胞肺癌细胞株H69/AR的研究中率先发现,随后在多种耐药的肿瘤细胞中均有表达。Ohsawa等[8]对原发于结内的41例DLBCL患者研究发现,MRP1的阳性表达率为63%,而且MRP1阳性DLBCL患者组中疗效达完全缓解的比例显著低于MRP1阴性DLBCL患者组疗效达完全缓解的比例(32% vs. 69%,P < 0.001),本研究认为MRP1是DLBCL患者疗效及预后评价的重要预测因子。本研究结果显示,MRP1 mRNA在全组DLBCL患者的阳性率为56.9%,MRP1在non-GCB组中的表达高于其在GCB组中的表达,而有研究提示DLBCL患者中non-GCB组与GCB组相比有较高的复发率及较差的预后[9, 10],推测non-GCB组具有较高的复发率可能与non-GCB组中存在较高的MRP1表达有关。本研究进一步分析表明MRP1的表达与DLBCL患者的PFS相关,MRP1表达阳性的患者较易复发,提示MRP1参与了DLBCL的复发与耐药,因此阐明MRP1的调控对于克服DLBCL的复发与耐药具有重要意义。
目前MRP1在DLBCL患者中的调控机制目前知之甚少。最近研究提示,PI3K/Akt/mTOR信号转导通路与肿瘤的增殖、凋亡、异常血管生成、细胞周期及多药耐药等重要的生物学行为密切相关,其详细机制仍有待深入研究。本研究结果显示,p-mTOR在DLBCL患者中的表达率为58.7%,国内于宝华等[11]用免疫组织化学法检测100例DLBCL患者新鲜组织中p-mTOR的表达,结果显示p-mTOR在DLBCL患者中的阳性率为75.0%(75/100),本研究p-mTOR的表达率低于于宝华等研究结果原因可能与样本的选择、检测方法不同有关。越来越多的研究表明不同细胞起源的DLBCL其信号转导机制不同,Zang等[12]进一步研究发现,使用同时抑制PI3K与mTOR活性的NVP-BEZ235可显著诱导GCB型DLBCL肿瘤细胞的死亡,而在non-GCB型DLBCL肿瘤细胞系中,由于受到NF-κB或Pim激酶介导的信号补偿作用,NVP-BEZ235的作用并不显著,表明PI3K/Akt/mTOR在DLBCL不同免疫学亚型中的作用并不完全一致。于宝华等进一步分析显示,non-GCB型DLBCL中p-mTOR的阳性率为84.2%(48/57),高于GCB型中的阳性比8/18和8/18(P < 0.01),本研究认为,AKt/mTOR信号转导通路活化在DLBCL的发生中起重要作用,并有望成为部分DLBCL治疗的新靶点。本研究结果与于宝华等研究结果基本一致,提示mTOR信号转导通路参与了DLBCL不同免疫学亚型的发病。前已述及MRP1表达阳性的DLBCL患者具有较差的PFS,进一步的相关分析显示,mTOR的表达与MRP1的表达存在相关性,提示mTOR可能参与了MRP1 mRNA的调控。江雪杰等[13]研究发现,通过采用mTOR抑制剂RAD001对急性髓细胞白血病HL60/ADM细胞株研究发现,RAD001能够通过抑制PI3K/Akt/mTOR信号转导活性来抑制P53依赖的MRP1表达从而逆转白血病HL60/ADM细胞株的耐药。因此通过抑制PI3K/Akt/mTOR信号转导来逆转DLBCL肿瘤细胞的耐药、增强肿瘤细胞对化疗药物的敏感度可能是一个有效的措施。
综上所述,mTOR与MRP1参与了DLBCL不同免疫学亚型的发病及其复发,mTOR信号转导通路可能参与了MRP1的调控,但需进一步的研究证实。
| [1] | Yagi K, Yamamoto K, Umeda S, et al. Expression of multidrug resistance1 gene in B-cell lymphomas: association with follicular dendritic cells[J]. Histopathology, 2013, 62(3): 414-20. |
| [2] | Maxwell SA, Cherry EM, Bayless KJ. Akt, 14-3-3ζ, and vimentin mediate a drug-resistant invasive phenotype in diffuse large B-cell lymphoma[J]. Leuk Lymphoma, 2011, 52(5): 849-64. |
| [3] | Witzens-Harig M, Memmer ML, Dreyling M, et al. A phase Ⅰ/Ⅱ trial to evaluate the safety, feasibility and activity of salvage therapy consisting of the mTOR inhibitor Temsirolimus added to standard therapy of Rituximab and DHAP for the treatment of patients with relapsed or refractory diffuse large cell B-Cell lymphoma-the STORM trial[J]. BMC Cancer, 2013, 13: 308. |
| [4] | Choi WW, Weisenburger DD, Greiner TC, et al. A new immunostain algorithm classifies diffuse large B-cell lymphoma into molecular subtypes with high accuracy[J]. Clin Cancer Res, 2009, 15(17): 5494-502. |
| [5] | Raut LS, Chakrabarti PP. Management of relapsed-refractory diffuse large B cell lymphoma[J]. South Asian J Cancer, 2014, 3(1): 66-70. |
| [6] | Rocha Gda G, Oliveira RR, Kaplan MA, et al. 3β-Acetyl tormentic acid reverts MRP1/ABCC1 mediated cancer resistance through modulation of intracellular levels of GSH and inhibition of GST activity[J]. Eur J Pharmacol, 2014, 741: 140-9. |
| [7] | Cai B, Miao Y, Liu Y, et al. Nuclear multidrug-resistance related protein 1 contributes to multidrug-resistance of mucoepidermoid carcinoma mainly via regulating multidrug-resistance protein 1: a human mucoepidermoid carcinoma cells model and Spearman's rank correlation analysis[J]. PLoS One, 2013, 8(8): e69611. |
| [8] | Ohsawa M, Ikura Y, Fukushima H, et al. Immunohistochemical expression of multidrug resistance proteins as a predictor of poor response to chemotherapy and prognosis in patients with nodal diffuse large B-cell lymphoma[J]. Oncology, 2005, 68(4-6): 422-31. |
| [9] | Fang C, Xu W, Li JY. A systematic review and meta-analysis of rituximab-based immunochemotherapy for subtypes of diffuse large B cell lymphoma[J]. Ann Hematol, 2010, 89(11): 1107-13. |
| [10] | Thieblemont C, Briere J, Mounier N, et al. The germinal center/activated B-cell subclassification has a prognostic impact for response to salvage therapy in relapsed/refractory diffuse large B-cell lymphoma: a bio-CORAL study[J]. J Clin Oncol, 2011, 29(31): 4079-87. |
| [11] | Yu BH, Zhou XY, Xiao XY, et al. Activation and clinicopathologic significance of AKT/mTOR signaling pathway in diffuse large B-cell lymphoma[J]. Zhonghua Bing Li Xue Za Zhi, 2009, 38(1): 35-41.[于宝华, 周晓燕, 肖秀英, 等. AKT/mTOR通路在弥漫性大B细胞淋巴瘤中的活化及其与临床病理相关性的研究[J]. 中华病理学杂志, 2009, 38(1): 35-41.] |
| [12] | Zang C, Eucker J, Liu H, et al. Concurrent inhibition of PI3-kinase and mTOR induces cell death in diffuse large B cell lymphomas, a mechanism involving down regulation of Mcl-1[J]. Cancer Lett, 2013, 339(2): 288-97. |
| [13] | Jiang XJ, Meng FY, Huang KK, et al. Effect of RAD001 or plus LBH589 on the proliferation, apoptosis and drug resistance in chemoresistant acute myeloid leukemic cells[J]. Zhonghua Yi Xue Za Zhi, 2011, 91(32): 2287-92.[江雪杰, 孟凡义, 黄凯凯, 等. 依维莫司和LBH589对耐药急性髓系白血病细胞增殖、凋亡及多药耐药相关蛋白表达的影响[J]. 中华医学杂志, 2011, 91(32):?2287-92.] |
 2014, Vol. 42
2014, Vol. 42


