文章信息
- 崔永,常栋,吴炳群,段新春,侍管,龚民,王天佑.2015.
- CUI Yong, CHANG Dong, WU Bingqun, DUAN Xinchun, SHI Guan, GONG Min, WANG Tianyou.2015.
- 食管鳞癌中上皮细胞黏附分子蛋白高表达与临床病理特征的关系
- Relationship Between High Expression of Ep-CAM Protein and Clinicopathological Features of Esophageal Squamous Cell Carcinoma Tissues
- 肿瘤防治研究, 2015, 42(09): 897-899
- Cancer Research on Prevention and Treatment, 2015, 42(09): 897-899
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.09.008
-
文章历史
- 收稿日期:2014-09-28
- 修回日期:2015-04-28
食管癌死亡率居恶性肿瘤死亡的第六位,全球每年大约有460 000例的新增病例。我国食管癌病例总数居世界首位,且与欧美国家不同,食管鳞癌占绝大多数[1, 2]。食管癌预后很差,总的5年生存率仅为10%~13%[3]。上皮细胞黏附分子(epithelial cellular adhesion molecule,Ep-CAM)在绝大部分的上皮来源的肿瘤组织中都有表达。其表达强度可以作为一些上皮来源肿瘤预后及分化程度的标志[4, 5]。本研究拟检测Ep-CAM在手术切除的食管鳞癌标本中的表达规律,并探讨其与食管鳞癌发生、发展的关系。
1 资料与方法 1.1 临床资料选用首都医科大学附属北京友谊医院胸外科2005—2010年间手术切除的食管鳞癌标本140例。患者年龄38~75岁,平均61.5 岁。所有病例均有完整的临床病理资料,见表 1。按UICC 2009年食管癌分期标准进行分期。食管正常组织标本20例取自食管鳞癌手术切除标本距肿瘤边缘3 cm以上的切缘。
 |
一抗兔抗人Ep-CAM单克隆抗体(工作浓度 1∶100),PV-9000试剂盒,DAB显色液试剂盒和部分DAB试剂购自北京中杉生物制品公司。
1.3 免疫组织化学检测术后所有组织均经10%福尔马林固定,常规石蜡包埋。4 μm连续切片3张,分别行HE和免疫组织化学染色。采用PV-9000二步法免疫组织化学检测。
63℃烤箱烤片1 h。脱蜡二甲苯(Ⅰ、Ⅱ、Ⅲ)3×15 min,无水乙醇Ⅰ,无水乙醇Ⅱ,95%酒精Ⅰ,95%酒精Ⅱ,各2 min。蒸馏水水洗,至3%过氧化氢10 min(阻断内源性过氧化物酶)。蒸馏水水洗,抗原修复,乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)(pH=9)。高压锅修复,喷气后2 min。自然冷却,TBS液(pH7.4)冲洗3次,每次3 min。滴加一抗,90 min。TBS冲洗3次,每次3 min。滴加试剂1,20 min。TBS冲洗3次,每次3 min。滴加试剂2,30 min。TBS冲洗3次,每次3 min。DAB液显色4 min,显微镜下观察控制显色时间。苏木精对比染色,淡染细胞核60 s。脱水,透明,封片。
1.4 结果判定显微镜下随机观察5个高倍镜视野。按细胞着色程度分为:不着色为0分,淡黄色为1分,棕黄色为2分,褐色为3分。按染色肿瘤细胞所占比例分为:≤10%为0分,10%~30%为1分,>30%~60%为2分,>60%为3分。两项计分之和≥3分为免疫组织化学阳性。
1.5 统计学方法采用SPSS13.0软件对数据进行统计分析。Ep-CAM的表达与临床病理变量之间的关系采用χ2检验及Fisher精确检验分析。采用Kaplan-Meier法进行生存分析。P < 0.05为差异有统计学意义。
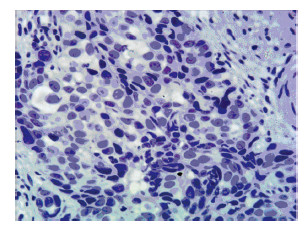
2 结果 2.1 Ep-CAM蛋白在食管鳞癌中的表达免疫组织化学结果显示,在140例ESCC患者中,Ep-CAM阴性55例,阳性表达85例,阳性率为60.7%。Ep-CAM阳性着色主要定位在肿瘤细胞的细胞质。癌旁正常组织中不表达。Ep-CAM阴性见图 1,Ep-CAM阳性见图 2。
|
| 图 1 食管鳞癌组织中Ep-CAM蛋白阴性表达 (免疫组织化学 ×400) Figure 1 Negative expression of Ep-CAM protein in esophageal squamous cell carcinoma (ESCC) tissues (IHC × 400) |

|
| A: low expression(IHC ×200); B: moderate expression(IHC ×200); C: high expression(IHC ×400) 图 2 食管鳞癌组织中Ep-CAM蛋白阳性表达 Figure 2 Positive expression of Ep-CAM in ESCC tissues |
食管鳞癌组织中Ep-CAM蛋白表达与患者临床病理特征关系见表 1。Ep-CAM蛋白阳性表达率与患者性别无关(P=0.142);与肿瘤的长度、分化程度、TNM分期、肿瘤浸润深度和有无淋巴结转移均相关(P < 0.05)。
3 讨论Ep-CAM是一种Ⅰ型跨膜糖蛋白,属Ca2+非依赖性黏附分子,该蛋白及其相关家族的蛋白几乎仅存在于上皮组织中,在非增生的鳞状上皮中表达非常低,通过免疫组织化学的方法通常检测不到[6]。Ep-CAM在多种恶性肿瘤,如鳞状细胞癌(除皮肤癌之外)、乳腺癌、膀胱癌等多种肿瘤中过表达[7, 8]。而且Ep-CAM阳性细胞无论从数量还是阳性程度上都与肿瘤发展程度密切相关[9]。甚至有研究认为在绝大部分的上皮来源的肿瘤组织中都有Ep-CAM的表达,其中胃和结直肠消化道肿瘤、乳腺癌、卵巢癌、胰腺癌、肺癌、前列腺癌等的Ep-CAM阳性率都达到或接近100%[10]。本研究中,Ep-CAM在60.7%的食管鳞癌中过表达,在癌旁正常食管黏膜中不表达,提示Ep-CAM可以作为食管鳞癌的标志物。
研究表明,Ep-CAM可以通过钙黏蛋白(E-cadherin)调节细胞间的黏附作用,从而参与肿瘤的浸润和迁徙过程。在实验中,通过转染诱导Ep-CAM cDNA的合成来增加钙黏蛋白阳性细胞中Ep-CAM的表达,可以在不减少细胞钙黏蛋白总量的情况下降低黏附作用[11]。既往的临床研究中,Ep-CAM与肿瘤进展和预后的关系并不明确。在很多肿瘤中,Ep-CAM过表达是预后不良的指标[12, 13] 。如在舌鳞癌和肺鳞癌中,Ep-CAM过表达与淋巴结转移相关[14, 15],而在另外一些肿瘤中,Ep-CAM表现出相反的作用。如在正常胃黏膜中Ep-CAM低表达,在肠上皮化生的黏膜中表达增高,而Ep-CAM表达缺失是胃癌预后不佳的指标[16]。在肾癌中,Ep-CAM表达缺失与肿瘤的大小和转移正相关,Ep-CAM过表达是预后好的独立预测因子[17]。这些研究表明Ep-CAM蛋白在不同的肿瘤中的作用复杂,可能受到不同的上游分子通路的调节。在本研究中,Ep-CAM高表达率与肿瘤长度、浸润深度和淋巴结转移呈正相关,而且与临床TNM分期相关。表明Ep-CAM高表达是食管鳞癌浸润和转移的标志物,并可能是预后不良的指标。另外,在结肠癌靶向治疗的研究中,以Ep-CAM为靶点的IgG1抗体在术后辅助治疗中减少了复发、改善了预后[18]。提示Ep-CAM有可能成为食管鳞癌治疗的靶点。
| [1] | Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2009[J]. CA Cancer J Clin, 2009, 59(4): 225-49. |
| [2] | Kamangar F, Dores GM, Anderson WF. Patterns of cancer incidence, mortality, and prevalence across five continents: defining priorities to reduce cancer disparities in different geographic regions of the world[J]. J Clin Oncol, 2006, 24(14): 2137-50. |
| [3] | Hagymasi K, Tulassay Z. Epidemiology and pathogenesis of esophageal cancer, and the possibilities of its prevention[J]. Orv Hetil, 2009, 150 (9): 407-13. |
| [4] | Romeu C, Farré X, Cardesa A, et al. Expression of Ep-CAM, but not of E48, associates with nodal involvement in advanced squamous cell carcinomas of the larynx[J]. Histopathology, 2013, 62(6): 954-61. |
| [5] | Saadatmand S, de Kruijf EM, Sajet A, et al. Expression of cell adhesion molecules and prognosis in breast cancer[J]. Br J Surg, 2013, 100(2): 252-60. |
| [6] | Winter MJ, Nagtegaal ID, van Krieken JH, et al. The epithelial cell adhesion molecule (Ep-CAM) as a morphoregulatory molecule is a tool in surgical pathology[J]. Am J Pathol, 2003, 163(6): 2139-48. |
| [7] | Akita H, Nagano H, Takeda Y, et al. Ep-CAM is a significant prognostic factor in pancreatic cancer patients by suppressing cell activity[J]. Oncogene, 2011, 30(31): 3468-76. |
| [8] | van der Gun BT, Melchers LJ, Ruiters MH, et al. Ep-CAM in carcinogenesis: the good, the bad or the ugly[J]. Carcinogenesis, 2010, 31(11): 1913-21. |
| [9] | Bryan RT, Regan HL, Pirrie SJ, et al. Protein shedding in urothelial bladder cancer: prognostic implications of soluble urinary EGFR and EpCAM[J]. Br J Cancer, 2015, 112(6): 1052-8. |
| [10] | Went PT, Lugli A, Meier S, et al. Frequent EpCam protein expression in human carcinomas[J]. Hum Pathol, 2004, 35(1): 122-8. |
| [11] | Litvinov S, Balzar M, Winter MJ, et al. Epithelial cell adhesion molecule (Ep-CAM) modulates cell-cell interactions mediated by classic cadherins[J]. J Cell Biol, 1997, 139(5): 1337-48. |
| [12] | Gastl G, Spizzo G, Obrist P, et al. Ep-CAM overexpression in breast cancer as a predictor of survival[J]. Lancet, 2000, 356(9246): 1981-2. |
| [13] | Varga M, Obrist P, Schneeberger S, et al. Overexpression of epithelial cell adhesion molecule antigen in gallbladder carcinoma is an independent marker for poor survival[J]. Clin Cancer Res, 2004, 10(9): 3131-6. |
| [14] | Yanamoto S, Kawasaki G, Yoshitomi I, et al. Clinicopathologic significance of EpCAM expression in squamous cell carcinoma of the tongue and its possibility as a potential target for tongue cancer gene therapy[J]. Oral Oncol, 2007, 43(9): 869-77. |
| [15] | Stoecklein NH, Siegmund A, Scheunemann P, et al. Ep-CAM expression in squamous cell carcinoma of the esophagus: a potential therapeutic target and prognostic marker[J]. BMC Cancer, 2006, 6: 165. |
| [16] | Songun I, Litvinov S, van de Velde C, et al. Loss of Ep-CAM (CO17-1A) expression predicts survival in patients with gastric cancer[J]. Br J Cancer, 2005, 92(9): 1767-72. |
| [17] | Seligson DB, Pantuck AJ, Liu X, et al. Epithelial cell adhesion molecule (KSA) expression: pathobiology and its role as an independent predictor of survival in renal cell carcinoma[J]. Clin Cancer Res, 2004, 10 (8): 2659-69. |
| [18] | Liao MY, Kuo MY, Lu TY, et al. Generation of an anti-EpCAM antibody and epigenetic regulation of EpCAM in colorectal cancer[J]. Int J Oncol, 2015, 46(4): 1788-800. |
 2014, Vol.42
2014, Vol.42