文章信息
- 邵军,范威,马彪,吴毅平. 2015.
- SHAO Jun, FAN Wei, MA Biao, WU Yiping. 2015.
- 不同乳腺癌干细胞亚群的自我更新和致瘤能力差异
- Difference of Self-renewal and Tumorigenicity among Different Breast Cancer Stem Cells Subpopulations
- 肿瘤防治研究, 2015, 42(09): 887-891
- Cancer Research on Prevention and Treatment, 2015, 42(09): 887-891
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.09.006
-
文章历史
- 收稿日期:2015-04-22
- 修回日期:2015-06-23
2. 430079 武汉,湖北省肿瘤医院乳腺科
2. Department of Breast Cancer,Hubei Cancer Hospital,Wuhan 430079,China
目前研究认为CD44+CD24-/low表型是特异性的乳腺癌干细胞标志物[1, 2, 3],同时乙醛脱氢酶1(aldehyde dehydrogenase 1, ALDH1)被作为一种新的功能型干细胞标志物,用来鉴定、分离多种干细胞和肿瘤干细胞[4, 5, 6, 7, 8]。ALDH1是一种将乙醛脱氢氧化为乙酸的细胞内溶质酶,与组织的发生、分化相关。Ginestier等发现具有高ALDH1活性(ALDH1+)的乳腺癌细胞具备自我更新和强致瘤能力这两个最主要的肿瘤干细胞特征[5]。但是对于CD44+CD24-/low表型的乳腺癌干细胞和高ALDH1活性(ALDH1+)乳腺癌干细胞之间在更新能力、致瘤能力上的差异方面目前研究尚不多见。本实验旨在探讨CD44+CD24-/low和ALDH1+乳腺癌干细胞在自我更新和致瘤能力上的差异。
1 资料与方法 1.1 标本采集标本于2014年1月采集于湖北省肿瘤医院乳腺科1例32岁女性患者,病理类型:浸润性导管癌,三阴性,基底细胞样型。术中切取约1 cm×1 cm新鲜癌组织,无菌下立即置于标本处理液和冰盒中,并送至细胞培养室。标本使用得到患者知情同意,并通过医学伦理审核。
1.2 主要试剂与仪器 1.2.1 实验试剂鼠抗人抗CD44-PECY5单抗、CD44同型对照、鼠抗人抗CD24-PE单抗、CD24同型对照均购自美国eBioscience公司,ALDEFLUOR?Kit购自美国Stem Cell Technologies公司,表皮生长因子(epidermal growth factor,EGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)购自美国BD公司,胶原酶-I和DMEM-F12培养液购自美国Sigma公司,B-27购自美国Invitrogen公司。
1.2.2 实验仪器流式细胞仪(美国BD公司),激光共聚焦显微镜(德国Leica),荧光显微镜(日本Olympus),酶标仪(美国BIO-RAD)等。
1.3 实验方法 1.3.1 原代培养及乳腺微球(mammosphere, MS)悬浮培养将新鲜乳腺癌组织修剪成约1 mm3的组织块,0.25%胰酶-EDTA和Ⅰ型胶原酶37℃恒温水浴箱中消化5 min,以FBS终止消化,之后移至另一培养皿内200目不锈钢滤网上,加入适量D-Hanks液,使细胞充分滤过细胞筛。收集细胞滤液,200 g离心(下同)5 min,弃去上清液,收集细胞,用预先配置好的无血清DMEM-F12培养液(1:50 B27, 20 ng/ml bFGF, 20 ng/ml EGF)常规重悬,接种。需要时制成的单细胞悬液备下一步实验使用。若继续悬浮培养,每3 d换液1次。常规光学显微镜下观察MS的形态变化;若传代,则5 d左右传代1次,继续于无血清培养液中培养。
1.3.2 免疫荧光法鉴定细胞表型重悬原代MS为单细胞悬液,吸取50 μl均匀涂布于载玻片上的6 mm圆圈内,室温下用预冷的固定液固定约10 min,PBS漂洗5 min。用含有 0.5%Triton X-100的非免疫动物血清封闭1 h,PBS漂洗2次;37℃下一抗孵育2 h,PBS漂洗2次,以PBS代替一抗作对照组。用PECY5或PE标记的二抗在37℃下避光孵育45 min,PBS漂洗2次,封片后1 h内上激光共聚焦显微镜照相。阳性为明亮的荧光,阴性为无荧光或仅微弱自发荧光。
1.3.3 流式细胞术检测CD44+CD24-/low和ALDH1阳性细胞CD44+CD24-/low细胞群的分选参照Al-Hajj等[1]的方法进行。注意调整细胞悬液中细胞浓度达到每毫升1×106个。ALDH1阳性细胞分选主要操作步骤如下:单细胞悬液细胞浓度每毫升1×106个,按5 μl/ml加入激活的ALDEFLUOR底物,混合均匀,37℃条件下孵育30 min。离心,弃上清液,加入ALDEFLUOR缓冲液重悬,调整细胞浓度为每毫升1×106个,上机检测。
1.3.4 MS形成能力实验MS形成率是反映肿瘤细胞自我更新能力的重要指标。取分选后的各组和对照组细胞悬液,以含生长因子的无血清培养液重悬后调整至每毫升1×103个细胞,每组细胞设5个复孔,每孔100 μl,96孔培养板接种,再每孔加入含生长因子的无血清培养液100 μl,培养,每孔每2天添加培养液25 μl,第8天对各孔中形成的MS进行镜下计数。MS形成率(MS%)=微球数/接种细胞数×100%。
1.3.5 裸鼠致瘤实验实验动物为BALB/C-nude裸小鼠,雌性,4~6周龄,购自湖南斯莱克景达实验动物有限公司,在层流架带盖鼠盒中饲养(SPF级)。裸鼠致瘤实验分3批进行,裸小鼠每批4组,每组5只。每批4组分别为对照组、CD44+CD24-/low组、ALDH1+组和ALDH1+CD44+CD24-/low组。第1批裸鼠每只接种500个各组细胞,第2批接种5 000个细胞,第3批接种50 000个细胞。按Al-Hajj等[1]方法:(1)收集形态良好的各组细胞,制备单细胞悬液,第1、2、3批分别调整浓度为每毫升1×104, 1×105和1×106个;(2)按体积比1:1将上述细胞与Matrigel基质胶混合,使细胞浓度分别为每毫升0.5×104、0.5×105、0.5×106个;(3)4℃保存各组细胞,并于当天接种。具体步骤如下:(1)按每只小鼠0.1 ml接种于裸鼠前胸一侧皮下,在标准条件下饲养8周;(2)每周检查触摸小鼠1次,测量并记录肿瘤最长径,观察8周后颈椎离断法处死;(3)统计学分析实验数据。
1.4 统计学方法实验结果采用SPSS13.0进行统计学处理。计量资料以均数±标准差(x±s)表示,3组以上数据的比较采用方差分析,组间两两比较采用LSD法,两独立样本间比较采用t检验。P<0.05为差异有统计学意义。
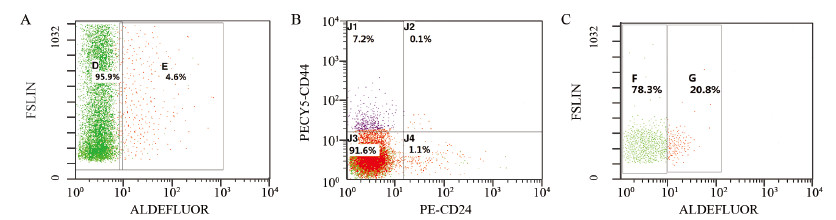
2 结果 2.1 流式细胞术分选结果流式分选ALDH1+细胞比例为4.6%,见图 1A,CD44+CD24-/low表型的肿瘤细胞比例为7.2%,见图 1B。对CD44+CD24-/low群细胞进一步ALDEFLUOR分选后发现,其中20.8%细胞为ALDEFLUOR阳性,见图 1C,提示两群细胞间存在小部分重叠,即ALDH1+CD44+CD24-/low,占总细胞的1.5%。
|
| A: ALDEFLUOR positive (ALDH1+) cells percentage; B: CD44+ CD24-/low cells percentage; C: ALDH1+ cells percentage in CD44+ CD24-/low cells 图 1 流式细胞术分选各组细胞比例 Figure 1Each cells percentage sorted by flow cytometry |
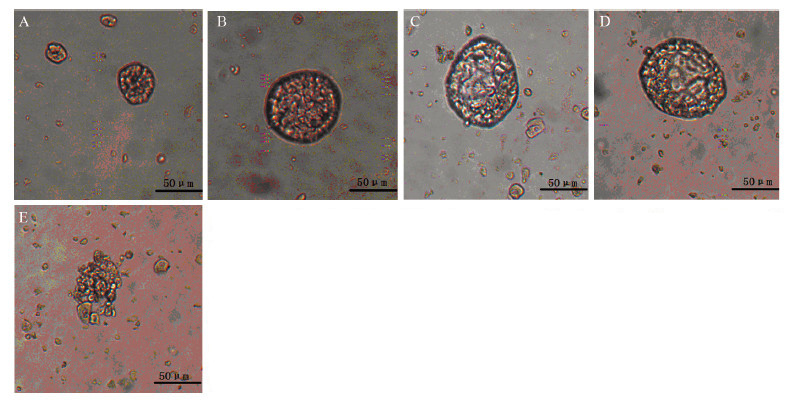
原代细胞无血清培养液悬浮培养48~72 h后,4~5天开始有少量MS形成,见图 2A,1周左右形成典型的成熟MS,继续培养MS不再明显增大;而流式分选出的CD44+CD24-/low、ALDH1+和 ALDH1+CD44+CD24-/low各群细胞经无血清培养液悬浮培养后,普遍在2~3天即可形成MS,数量较多,形成的细胞球较大,由数十至数百个细胞组成,数量增多,球体较大,直径达到80~100 μm,见图 2B~2D,培养10~12天后仍形态稳定,出现崩解的时间晚。其中尤以ALDH1+CD44+CD24-/low群细胞形成MS时间最早,第2天即可观察到MS形成,球体最大,直径可达到110~120 μm,而球体崩解的时间最晚。图 2E示典型MS崩解现象。
|
| A:mammosphere (MS)formed by primary tumor cells after cultured in serum-free medium;B:MS formed by CD44+CD24-/low cells after cultured in serum-free medium for 7d;C:MS formed by ALDH1+cells after cultured in serum-free medium for 7d;D:MS formed by ALDH1+CD44+CD24-/low cells after cultured in serum-free medium for 7d;E:Disintegration of MS in serum-free medium for long-term culturing 图 2 原代肿瘤细胞及分选细胞无血清培养液悬浮培养形成MS (光镜 ×400) Figure 2MS formed by primary tumor cells and sorted cells in serum-free medium suspension culture (light microscope ×400) |
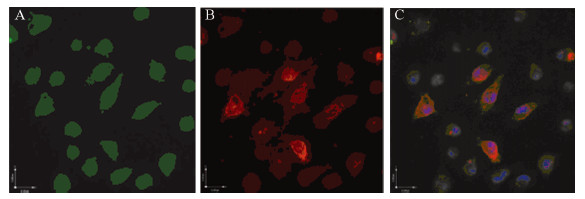
镜下观察发现,ALDH1+细胞胞质着色,呈绿色荧光,胞膜和胞核不显色,见图 3A,CD44+CD24-/low细胞主要是包膜呈棕红色荧光,部分胞质着色,见图 3B,少数细胞同时呈胞质绿色荧光和胞膜棕红色荧光,见图 3C,说明存在ALDH1+、CD44+CD24-/low及ALDH1+CD44+CD24-/low细胞亚群。
|
| A:ALDH1+cells green fluorescence in the cytoplasm by laser confocal microscopy;B:CD44+CD24-/low cells brownish/red fluorescence in the membrane,with some cells showing fluorescence in part of cytoplasm by laser confocal microscopy;C:ALDH1+CD44+CD24-/low cells brownish/red fluorescence in the membrane and green fluorescence in the cytoplasm by confocal microscopy 图 3 激光共聚焦免疫荧光检测结果 Figure 3Confocal immunofluorescence test results |
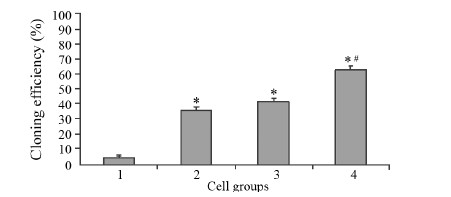
悬浮培养8天后计数,对照组、CD44+CD24-/low、ALDH1+及ALDH1+CD44+CD24-/low四组细胞的MS形成率分别为(4.80±1.10)%、(35.70±1.92)%、(41.50±1.71)%及(62.45±2.50)%,见图 4,三组分选细胞的</ span>MS形成率显著强于对照组细胞(F=198.452, P < 0.001),ALDH1+CD44+CD24-/low组细胞强于CD44+CD24-/low和ALDH1+两组细胞(F=7.644, P=0.0185)。
|
| 1:control group;2:CD44+CD24-/low group;3:ALDH1+group;4: ALDH1+CD44+CD24-/low group;*:P < 0.05,compared with unsorted control group;#:P <0.001,compared with ALDH1+group 图 4 各组细胞无血清悬浮培养8天后克隆形成率比较 Figure 4Comparison of cloning efficiency in each subpopulation after 8d in serum-free suspension culture |
典型的裸鼠移植瘤(图略)。第1批裸鼠接种后观察8周,对照组、CD44+CD24-/low、ALDH1+组均未见移植瘤形成。ALDH1+CD44+CD24-/low组裸鼠在第6周可扪及明确的皮下结节,至第8周达到(0.36±0.07)cm,见图 5A。第二批裸鼠观察8周,对照组始终无移植瘤形成,CD44+CD24-/low组在第7周观察到有移植瘤形成,ALDH1+组在第6周出现移植瘤,而ALDH1+CD44+CD24-/low组则在第3周即有移植瘤生成。至第8周,CD44+CD24-/low、ALDH1+及ALDH1+CD44+CD24-/low三组移植瘤大小分别为(0.25±0.04)、(0.45±0.05)和(0.97±0.06)cm。统计学分析显示,与对照组相比,其余各组细胞的致瘤能力均显著增强。三组分选细胞,致瘤能力由强至弱依次为ALDH1+CD44+CD24-/low组、ALDH1+组和CD44+CD24-/low组,各组之间比较均有显著性差异(F=7.011, P=0.0162),见图 5B。第3批裸鼠ALDH1+CD44+CD24-/low组在第2周即可形成移植瘤,生长速度快,瘤体大,而ALDH1+组、CD44+CD24-/low组和对照组则分别在第5、7周观察到移植瘤形成。第8周测量ALDH1+CD44+CD24-/low组、ALDH1+组、CD44+CD24-/low组和对照组各组裸鼠移植瘤大小,分别为(2.10±0.09)、(1.10±0.06)、(0.85±0.05)和(0.15±0.04)cm。三组细胞的致瘤能力均显著强于对照组,致瘤能力由强至弱依次为ALDH1+CD44+CD24-/low组、ALDH1+组、CD44+CD24-/low组,差异具有统计学意义(F=16.317, P=0.0074)。ALDH1+CD44+CD24-/low组的致瘤能力显著强于ALDH1+组、CD44+CD24-/low组(F=11.558, P=0.010),见图 5C。
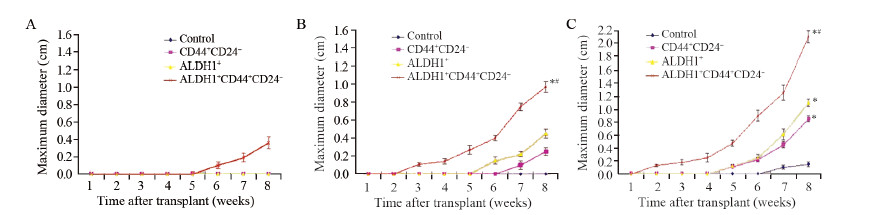
|
| A:500 cells/mouse; B: 5 000 cells/mouse; C: 50 000 cells/mouse 图 5 裸鼠接种后各组细胞生长曲线 Figure 5Growth curves of tumors in each group of nude mice |
肿瘤干细胞具有自我更新、致瘤性和处于未分化状态等干性特征,被认为是肿瘤发生、进展及治疗抵抗的原因,分离、鉴定并分析其生物学特性是深入研究肿瘤干细胞的关键[2]。目前认为CD44+CD24-/low是乳腺癌干细胞的表型标志物[1, 3, 4]。Ginestier等[5]发现具有ALDH1活性的乳腺癌细胞有自我更新和致瘤性的干细胞特征,ALDH1是乳腺癌、肾细胞癌、脑肿瘤、卵巢癌及肉瘤等多种肿瘤干细胞通用的功能性干细胞标志物[5, 6, 7, 8, 9, 10, 11, 12, 13],ALDH1高表达与多种肿瘤预后差相关[14, 15, 16, 17, 18]。 Hwang-Verslues等[6]通过分析CD44+CD24-/low、ESA+、CD133+等多个干细胞标志物后发现,干细胞标志物表达谱在不同乳腺癌细胞株之间以及不同病理类型的原发乳腺癌之间均差异显著,表明乳腺癌细胞中存在表达不同标志物的多个肿瘤干细胞亚群。本实验发现,乳腺癌细胞中CD44+CD24-/low表型的乳腺癌细胞群比例为7.2%,具有ALDH1活性的细胞比例为4.6%,占总细胞1.5%的乳腺癌细胞同时具有CD44+CD24-/low表型和ALDH1活性。免疫荧光实验也证实了此三群细胞的存在。MS形成实验发现将MS制成单细胞悬液后, 接种于无血清培养液中,可以重新形成新的MS,并可以连续传代,说明其具备自我更新能力。CD44+CD24-/low ,ALDH1+及ALDH1+CD44+CD24-/low三组细胞相对于未分选原代细胞具有更强的自我更新能力,而且此三群细胞自我更新能力之间存在明显差异,ALDH1+CD44+CD24-/low细胞的自我更新、增殖能力最强。
CD44+CD24-/low、ALDH1+及ALDH1+CD44+ CD24-/low三组乳腺癌亚群细胞的致瘤能力差异在动物实验中也得到了体现。500个ALDH1+CD44+CD24-/low细胞即可形成移植瘤,而其他组细胞均无此能力。CD44+CD24-/low和ALDH1+细胞在接种5 000个时才有致瘤能力,而原代未分选细胞需要接种50 000个才能形成移植瘤。ALDH1+CD44+CD24-/low细胞接种后出现移植瘤的时间最早,形成的移植瘤最大,提示其具备最强的致瘤能力。
本实验所用的细胞多选择传代1~2次的扩增克隆细胞,以兼顾细胞量和避免干细胞老化。因为Dey等[8]发现乳腺癌干细胞在无血清培养体系中长时间培养后,因培养液中出现高氧环境,细胞端粒酶发生丢失,干细胞自身可发生老化现象,从而导致乳腺癌干细胞的自我更新能力减弱。另外,本实验所用的细胞来自于三阴性乳腺癌患者,对于其他类型乳腺癌,其中各亚群细胞的比例及其自我更新、致瘤能力等可能存在差异,需要进一步研究。
综上可见,CD44+CD24-/low和ALDH1+乳腺癌亚群细胞均具有自我更新能及致瘤能力,具备肿瘤干细胞特征,尤其以ALDH1+CD44+CD24-/low细胞最强。联合运用CD44+CD24-/low和ALDH1可更特异性的鉴定、分选乳腺癌干细胞,有助于更深入了解乳腺癌干细胞生物学特性及从肿瘤干细胞的视角理解肿瘤的异质性。
| [1] | Al-Hajj M, Clarke MF. Self-renewal and solid tumor stem cells[J]. Oncogene, 2004, 23(43): 7274-82. |
| [2] | Wicha MS, Liu S, Dontu G. Cancer stem cells: an old idea--a paradigm shift[J]. Cancer Res, 2006, 66(4): 1883-90. |
| [3] | Reya T, Morrison SJ, Clarke MF, et al. Stem cells, cancer, and cancer stem cells[J]. Nature, 2001, 414(6859): 105-11. |
| [4] | Ponti D, Costa A, Zaffaroni N, et al. Isolation and in vitro propagation of tumorigenic breast cancer cells with stem/ progenitor cell properties[J]. Cancer Res, 2005, 65(13): 5506-11. |
| [5] | Ginestier C, Hur MH, Charafe-Jauffret E, et al. ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome[J]. Cell Stem Cell, 2007, 1(5): 555-67. |
| [6] | Hwang-Verslues WW, Kuo WH, Chang PH, et al. Multiple lineages of human breast cancer stem/progenitor cells identified by profiling with stem cell markers[J]. PLoS One, 2009, 4(12): e8377. |
| [7] | Phillips TM, McBride WH, Pajonk F. The response of CD24-/low/ CD44+ breast cancer-initiating cells to radiation[J]. J Natl Cancer Inst, 2006, 98(24): 1777-85. |
| [8] | Dey D, Saxena M, Paranjape AN, et al. Phenotypic and functional characterization of human mammary stem/progenitor cells in long term culture[J]. PLoS One, 2009, 4(4): e5329. |
| [9] | Ueda K, Ogasawara S, Akiba J, et al. Aldehyde dehydrogenase 1 identifies cells with cancer stem cell-like properties in a human renal cell carcinoma cell line[J]. PLoS One, 2013, 8(10): e75463. |
| [10] | Rasper M, Schäfer A, Piontek G, et al. Aldehyde dehydrogenase 1 positive glioblastoma cells show brain tumor stem cell capacity[J]. Neuro Oncol, 2010, 12(10): 1024-33. |
| [11] | Mieog JS, de Kruijf EM, Bastiaannet E, et al. Age determines the prognostic role of the cancer stem cell marker aldehyde dehydrogenase-1 in breast cancer[J]. BMC Cancer, 2012, 12: 42. |
| [12] | Kuroda T, Hirohashi Y, Torigoe T, et al. ALDH1-high ovarian cancer stem-like cells can be isolated from serous and clear cell adenocarcinoma cells, and ALDH1 high expression is associated with poor prognosis[J]. PLoS One, 2013, 8(6): e65158. |
| [13] | Lohberger B, Rinner B, Stuendl N, et al. Aldehyde dehydrogenase 1, a potential marker for cancer stem cells in human sarcoma[J]. PLoS One, 2012, 7(8): e43664. |
| [14] | Krause U, Ryan DM, Clough BH, et al. An unexpected role for a Wnt-inhibitor: Dickkopf-1 triggers a novel cancer survival mechanism through modulation of aldehyde-dehydrogenase-1 activity[J]. Cell Death Dis, 2014, 5(2): e1093. |
| [15] | Lohberger B, Stuendl N, Wolf E, et al. The novel myxofibrosarcoma cell line MUG-Myx1 expresses a tumourigenic stem-like cell population with high aldehyde dehydrogenase 1 activity[J]. BMC Cancer, 2013, 13: 563. |
| [16] | Wegman-Points LJ, Teoh-Fitzgerald ML, Mao G, et al. Retroviralinfection increases tumorigenic potential of MDA-MB-231 breast carcinoma cells by expanding an aldehyde dehydrogenase (ALDH1) positive stem-cell like population[J]. Redox Biol, 2014, 2: 847-54. |
| [17] | Kim YS, Jung MJ, Ryu DW, et al. Clinicopathologic characteristics of breast cancer stem cells identified on the basis of aldehyde dehydrogenase 1 expression[J]. J Breast Cancer, 2014, 17(2): 121-8. |
| [18] | Wen Zhou, Ye Yang, Zhimin Gu, et al. ALDH1 activity identifies tumor initiating cells and links to chromosomal instability signatures in multiple myeloma[J]. Leukemia, 2014, 28(5): 1155-8. |
 2015, Vol. 42
2015, Vol. 42


