文章信息
- 许月天,孙剑经,罗强,张林西. 2015.
- XU Yuetian, SUN Jianjing, LUO Qiang, ZHANG Linxi. 2015.
- NS-398逆转结肠癌细胞多药耐药性的作用
- NS-398 Reverses Multi-drug Resistance of Colorectal Carcinoma Cells
- 肿瘤防治研究, 2015, 42(09): 877-881
- Cancer Research on Prevention and Treatment, 2015, 42(09): 877-881
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.09.004
-
文章历史
- 收稿日期:2014-11-03
- 修回日期:2015-03-16
2.075000张家口,河北北方学院附属第一医院消化内科;
3.075000张家口,河北北方学院生命科学研究中心
2.Department of Gastroenterology,The First Affiliated Hospital of Hebei North University,Zhangjiakou 075000,China;
3.Life Science Research Center,Hebei North University,Zhangjiakou 075000,China
结肠癌化疗在其临床综合治疗中占有重要地位,但化疗多药耐药性(multi-drug resistance, MDR)严重影响了化疗效果,或导致化疗失败。寻求一种能够逆转MDR,增强其化疗效果,但又不会对人体正常细胞产生不良反应的辅助药物十分必要。研究显示,环氧合酶2(cyclooxygenase-2, COX-2)在肿瘤中的过表达可能与MDR的产生有关,是导致结肠癌MDR的重要因素之一[1],特异性干扰RNA抑制COX-2的过表达,可重新恢复肿瘤细胞对化疗药物的敏感度,但其作用机制尚不完全明确[2, 3]。本研究采用COX-2选择性抑制剂NS-398,对结肠癌5-Fu耐药细胞株HCT-8/Fu进行研究,试图探究COX-2选择性抑制剂作为MDR逆转剂的可能性,从而为结直肠癌等恶性肿瘤提高临床化疗敏感度或制定新辅助化疗方案提供理论依据。
1 材料和方法 1.1 材料 1.1.1 细胞与试剂人结肠癌耐药细胞株HCT-8/Fu购自凯基生物科技发展有限公司;NS-398为Cayman公司产品;5-氟尿嘧啶购自上海旭东海普药业有限公司;胎牛血清及RPMI1640培养液购自Gibco公司;胰蛋白酶-EDTA消化液购自凯基生物科技发展有限公司;CCK-8试剂盒购自北京庄盟国际生物基因科技有限公司;Hoechst33342染液购自北京索莱宝科技有限公司;人前列腺素E2(PGE2)酶联免疫分析试剂盒由美国R&D公司生产;二步法免疫组织化学检测试剂盒为北京中杉金桥生物技术公司产品;Caspase-3活性测定试剂盒购自普利莱基因技术有限公司。
1.1.2 仪器超净工作台为苏州安泰空气技术有限公司;二氧化碳培养箱购自美国热电公司;荧光倒置显微镜为日本尼康公司产品;高速冷冻离心机购自德国贺利氏公司;Spectra Max M2e多功能检测仪为美谷分子仪器有限公司产品。
1.2 实验方法 1.2.1 细胞培养HCT-8/Fu细胞培养于无Hepes含10%胎牛血清,100 u/ml青霉素与100 μg/ml链霉素的RPMI1640培养液中,加入终浓度为15 000 ng/ml的5-Fu以维持其耐药性,置37℃ 5%CO2饱和湿度培养箱中培养,细胞每1~2天传代1次,取对数生长期的细胞进行实验。
1.2.2 采用CCK-8法测定NS-398对结肠癌细胞的毒性取对数生长期细胞株HCT-8/Fu,以RPMI1640培养液调整细胞悬液浓度为1×105/ml,接种于96孔板,细胞贴壁后加药0、10、20、40、80、160 μmol/L NS-398。空白组为不含细胞和药物的培养液。每一浓度设5个复孔,终体积为每孔200 μl,培养24 h后,每孔加入20 μl CCK-8液继续培养4 h。采用全自动酶联免疫检测仪490 nm波长处测吸光度OD值,取6个孔OD值均数,计算细胞增殖抑制率(IR),IR=[1-(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%,选取IR<10%的药物浓度为NS-398的无毒剂量。
1.2.3 NS-398对HCT-8/Fu细胞MDR的逆转作用检测取对数生长期的HCT-8/Fu细胞,调整细胞悬液浓度为1×105/ml,接种于96孔板,每孔200 μl,待细胞贴壁弃培养液后加药,设5-Fu单用组、5-Fu+10 μmol/L NS-398组、5-Fu+20 μmol/L NS-398组。5-Fu等倍稀释成6个药物浓度梯度,每组设5个复孔,每孔终体积为200 μl,培养24 h后,每孔加入CCK-8试剂20 μl,继续培养4 h,采用全自动酶联免疫检测仪490 nm波长测吸光度OD值,计算IC50值,从而计算出逆转倍数,逆转倍数=IC50(HCT-8/Fu+5-Fu)/IC50(HCT-8/Fu+5-Fu+NS-398)。
1.2.4 HCT-8/Fu细胞中Caspase-3活性测定先按Caspase-3活性检测试剂盒说明书测定4-硝基苯胺(p-nitroaniline, pNA)标准曲线,取对数生长期的HCT-8/Fu细胞,设320 μg/ml 5-Fu组、20 μmol/L NS-398组、20 μmol/L NS-398+320 μg/ml 5-Fu组、对照组为不加药组。按分组浓度加药,培养24 h后,吸取细胞培养液,胰酶消化收集细胞悬液,1 000 g 离心5 min收集细胞,吸尽上清液,PBS洗涤3次,按每200万细胞加100 μl裂解液震荡裂解冰浴10 min,再次震荡,4℃,12 000g离心10 min,取上清液按试剂盒说明书添加样品及试剂于96孔板上,酶标仪405 nm处测定吸光度OD值,Caspase-3活性增加百分比=100%×实验处理组OD值/实验对照组OD值。
1.2.5 Hoechst 33342染色观察细胞凋亡取对数生长期的HCT-8/Fu细胞,制成1×105/ml单细胞悬液,接种于载有盖玻片的6孔板中,每孔3 ml,贴壁24 h后加药,设320 μg/mL5-Fu组,20 μmol/L NS-398组,20 μmol/L NS-398+320 μg/mL5-Fu组,继续培养24 h,吸弃培养液,每孔加入1 ml Hoechst 33342染色液,避光条件下孵育25 min,PBS洗涤3次,荧光倒置显微镜下观察细胞形态并拍照。
1.2.6 免疫细胞化学检测P-gp、MRP的表达取对数生长期的HCT-8/Fu细胞,制成1×105/ml单细胞悬液,依上述方法接种于6孔板中,贴壁24 h后加药,设0、20 μmol/L NS-398组,继续培养24 h,10%多聚甲醛固定10 min,PBS冲洗2 min×3次,按照二步法免疫组织化学检测试剂盒说明书染色,在显微镜下,随机计数至少6个高倍(×40)视野的细胞,计数600个细胞。根据细胞染色阳性率分级,无阳性表达者为阴性(-),阳性率低于25%者为弱阳性(+),阳性率在25%~75%之间为中阳性(</ span>++),阳性率大于75%为强阳性(+++)。
1.2.7 细胞培养上清液中PGE2含量的检测取对数生长期的HCT-8/Fu细胞,分别加入含不同浓度NS-398(终浓度为0、10、20 μmol/L),加药后继续培养24 h,用无菌管收集,2 000 r/min离心20 min,收集上清液,按ELISA试剂盒说明书测定标准曲线及PGE2含量。
1.3 统计学方法采用SPSS17.0软件进行统计分析,结果以均数±标准差(x±s)表示,采用方差分析进行组间比较,以P<0.05为差异有统计学意义。
2 结果 2.1 NS-398对HCT-8/Fu细胞的毒性通过CCK-8法测定NS-398作用HCT-8/Fu24 h后抑制率呈剂量依赖性下降,差异有统计学意义(10 μmol/L NS-398 vs.20 μmol/L NS-398 P=0.001,余各组之间P均=0.000),且在终浓度为20、10 μmol/L时抑制率分别为8%、6%,对HCT-8/Fu无明显毒性,见图 1。
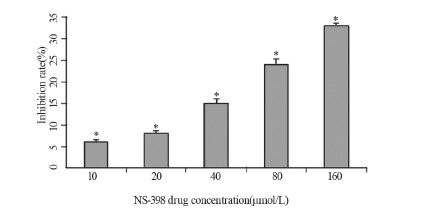
|
| *: P <0.05, compared with each other group 图 1 NS-398对HCT-8/Fu细胞的生长抑制作用 Figure 1Inhibition effect of NS-398 on growth of HCT-8/Fu cells |
终浓度为0、10、20 μmol/L NS-398分别与终浓度为20、80、320、1 280、5 120、20 480 μg/ml 5-Fu联合作用24 h后,其抑制率与5-Fu及NS-398浓度呈剂量依赖性,差异有统计学意义(P<0.05)。5-Fu单用组、5-Fu+10 μmol/L NS-398组、5-Fu+20 μmol/L NS-398组IC50值分别为19 650、5 744、2 620 μg/ml,经计算可得10、20 μmol/L NS-398逆转倍数分别为3.42、7.50。
2.3 细胞Caspase-3活性检测不同药物作用后,酶标仪405 nm处测得底物裂解产生的荧光强度,通过标准曲线计算出20 μmol/L NS-398+320 μg/ml 5-Fu组pNA含量明显高于其他两组(320 μg/ml 5-Fu组,20 μmol/L NS-398组),数据统计表明,各分组药物可不同程度的诱导HCT-8/Fu细胞中Caspase-3活性水平上升,其中20 μmol/L NS-398+320 μg/ml 5-Fu组Caspase-3活性增加百分比同比320 μg/ml 5-Fu组和20 μmol/L NS-398组升高明显,差异具有统计学意义(分别为P=0.000和P=0.010),pNA含量及Caspase-3活性增加百分比,见表 1。
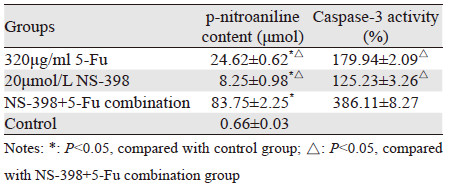 |
Hoechst33342染色后,荧光倒置显微镜下观察,正常细胞核呈弥散均匀的低蓝色,而发生凋亡的细胞核荧光强度增加,呈致密浓染或碎块状,颜色亮白,320 μg/ml 5-Fu组、20 μmol/L NS-398组细胞核多为浅蓝色,只有部分细胞发生凋亡呈致密浓染,而20 μmol/L NS-398+320 μg/ml 5-Fu组细胞数目减少,荧光强度增加,呈致密浓染,细胞凋亡率增加,见图 2。
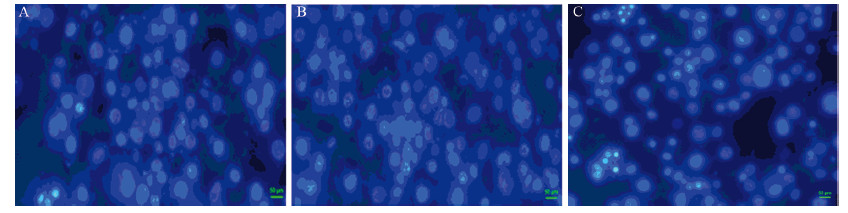
|
| A: 20μmol/L NS-398; B: 320μg/ml 5-Fu; C: 20μmol/L NS-398 + 320μg/ml 5-Fu 图 2 荧光倒置显微镜下观察不同药物作用24h后的细胞凋亡(×20) Figure 2Apoptotic effects of different drugs on HCT-8/Fu cells after 24h under inverted fluorescence microscope(×20) |
免疫细胞化学结果显示20 μmol/LNS-398作用24 h后,细胞P-gp、MRP表达量较对照组(0 μmol/L)明显减少,主要为细胞膜着色,P-gp阳性率由83%下降为19%,由强阳性变为弱阳性,MRP阳性率由79%下降为23%,同样由强阳性变为弱阳性,见图 3。
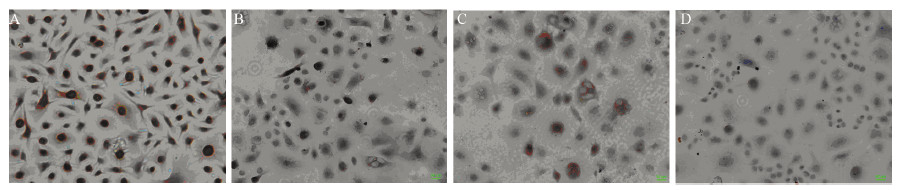
|
| A: MRP expression after treated by 0μmol/L NS-398 for 24h; B: MRP expression after treated by 20μmol/L NS-398 for 24h; C: P-gp expression after treated by 0μmol/L NS-398 for 24h; D: P-gp expression after treated by 20μmol/L NS-398 for 24h; P-gp: P-glycoprotein, MRP :multi-drug resistance related protein 图 3 NS-398作用24h后MRP和P-gp在HCT-8/Fu细胞的表达 Figure 3MRP and P-gp expression in HCT-8/Fu cells treated with NS-398 for 24h |
10、20 μmol/LNS-398作用细胞24 h后,ELISA法测定PGE2含量分别为189.50、151.25 ng/L与0 μmol/L NS-398组的340.13 ng/L相比明显减少,差异有统计学意义(分别为P=0.002和P=0.000),同时其含量变化呈剂量依赖性,随NS-398剂量增加,PGE2含量呈下降趋势。ELISA结果分析显示,NS-398通过抑制COX-2的表达,降低PGE2含量。
3 讨论结肠癌是常见的消化道恶性肿瘤,也是我国十大恶性肿瘤之一。近年来,虽然一些新的抗癌药物如细胞毒性药物、肿瘤分子靶向药物等开始逐步应用于临床,使结肠癌等恶性肿瘤的临床治疗有了明显改观,但仅仅处于初步阶段。目前肿瘤的治疗仍以手术、化疗和放疗为主,其中化疗在结肠癌的治疗中占了重要地位。但由于MDR的存在,严重影响了化疗效果。
MDR是指由一种药物引发,同时对其他多种结构和作用机制完全不同的抗癌药物产生交叉耐药的一种现象,其中P-gp、MRP是经典的多药耐药基因,且在结直肠癌耐药细胞中多呈高表达。两者同属于ATP结合盒膜转运蛋白超家族膜转运蛋白,能将带负电荷的药物分子逆浓度泵出细胞外,降低细胞内药物浓度,使其低于细胞杀伤浓度,导致细胞耐药。因此,如果COX-2选择性抑制剂能够抑制耐药基因P-gp、MRP的表达,则有望能够降低化疗药物的外排,充分发挥药物的效能,有效提高患者的生存期及生存质量[4]。
环氧合酶是花生四烯酸转变为前列腺素过程中的关键限速酶。环氧合酶有三种同工酶,即COX-1、COX-2、COX-3,其中COX-2是一种诱导酶,在正常组织中极少表达,但在炎症及一些癌症相关生物学途径被激活的诱导下可大量表达[5]。有研究表明,COX-2在85%的结肠癌中过表达,且这一变化发生在约50%的腺瘤中,说明COX-2在结肠癌形成的早期阶段发挥重要作用[6]。COX-2过表达还与多种具有分泌性能的组织类型的肿瘤对化疗的抵抗性及预后有关[7]。
本研究发现,浓度为20 μmol/L NS-398对HCT-8/Fu无明显抑制作用,但与5-Fu联用后有明显的逆转作用,使HCT-8/Fu对5-Fu敏感度增加。COX-2选择性抑制剂可使结肠癌细胞增殖受抑制并增强化疗药物的抗癌效果[8]。为了更进一步证实这种想法,我们采用Hoechst 33342染色、Caspase-3活性测定检测20 μmol/L NS-398组、320 μg/ml 5-Fu组、20 μmol/L NS-398+320 μg/ml 5-Fu组的凋亡情况,结果发现20 μmol/L NS-398+320 μg/ml 5-Fu组Hoechst33342染色大量癌细胞呈致密浓染, Caspase-3活性增加,均说明此组细胞凋亡增加,NS-398逆转癌细胞MDR作用显著。
关于COX-2选择性抑制剂逆转MDR机制目前还不清楚。有研究认为可能是通过降低P-gp等耐药基因的表达发挥作用的[9, 10, 11, 12],同时MRP亦能发挥这种作用[13]。本研究发现,20 μmol/L NS-398作用24 h后P-gp、MRP的表达量较0 μmol/L NS-398组显著减少,提示NS-398可能是通过降低细胞膜表面多药耐药基因P-gp、MRP的表达,减少5-Fu外排,从而提高癌细胞内5-Fu浓度,诱导癌细胞发生凋亡,达到逆转癌细胞对5-Fu的耐药性而杀伤癌细胞的目的。
另外,COX-2为花生四烯酸转变为前列腺素过程的关键限速酶。本研究应用20 mol/L NS-398作用于癌细胞24 h后,ELISA法检测到培养上清液中PGE2含量显著低于其他各组。其含量降低可能是NS-398发挥逆转效应的又一有力证据。Cannon等[14]和Wong等[15]认为,COX-2选择性抑制剂可使PGE2表达减少,降低调节性T细胞的数量及抑制活性,从而恢复了机体的抗肿瘤免疫反应及自然杀伤细胞数量,抑制肿瘤的生长及转移。
综上所述,NS-398能够有效逆转HCT-8/Fu细胞的多药耐药性,且在一定范围内呈剂量依赖性;NS-398逆转结肠癌耐药机制可能是通过降低P-gp、MRP的表达及抑制PGE2的产生而实现的。COX-2选择性抑制剂有望成为结直肠癌等恶性肿瘤临床化疗方案的备选药物或新辅助化疗的重要药物;但是COX-2选择性抑制剂逆转MDR作用机制可能较为复杂,还有待更深入的研究。
| [1] | Greenhough A, Smartt HJ, Moore AE, et al. The COX-2/PGE2 pathway: key roles in the hallmarks of cancer and adaptation to the tumour microenvironment[J]. Carcinogenesis, 2009, 30(3): 377-86. |
| [2] | Menter DG, Schilsky RL, DuBois RN. Cyclooxygenase-2 and cancer treatment: understanding the risk should be worth the reward[J]. Clin Cancer Res, 2010, 16(5):1384-90. |
| [3] | Chen W, Bai L, Wang X, et al. Acquired activation of the Akt/ cyclooxygenase-2/Mcl-1 pathway renders lung cancer cells resistant to apoptosis[J]. Mol Pharmacol, 2010, 77(3): 416-23. |
| [4] | Rahman M1, Selvarajan K, Hasan MR, et al. Inhibition of COX-2 in colon cancer modulates tumor growth and MDR-1 expression to enhance tumor regression in therapy-refractory cancers in vivo[J]. Neoplasia, 2012, 14(7): 624-33. |
| [5] | Martín-Sanz P, Mayoral R, Casado M, et al. COX-2 in liver, from regeneration to hepatocarcinogenesis: what we have learned from animal models[J]? World J Gastroenterol, 2010, 16(12): 1430-5. |
| [6] | Galamb O, Spisák S, Sipos F, et al. Reversal of gene expression changes in the colorectal normal-adenoma pathway by NS398 selective COX2 inhibitor[J]. Br J Cancer, 2010, 102(4): 765-73. |
| [7] | Singh B, Cook KR, Vincent L, et al. Role of COX-2 in tumorospheres derived from a breast cancer cell line[J]. J Surg Res, 2011, 168(1): e39-49. |
| [8] | Sui H, Li Q. Research JNK/SAPK signal transduction pathway and multidrug resistance mechanisms[J]. Zhong Liu Fang Zhi Yan Jiu, 2010, 37(7): 844-7.[隋华, 李琦. JNK/SAPK信号转导通路与多药 耐药机制的研究[J]. 肿瘤防治研究, 2010, 37(7): 844-7.] |
| [9] | Bassiouny AR, Zaky A, Neenaa HM. Synergistic effect of celecoxib on 5-fluorouracil-induced apoptosis in hepatocellular carcinoma patients[J]. Ann Hepatol, 2010, 9(4): 410-8. |
| [10] | Liu Q, Liu XJ, Chen YJ, et al. To investigate the reversal effect of MCF-7/Taxol resistant cell lines and multidrug resistance mechanisms of celecoxib combined with paclitaxel on human breast cancer[J]. Sichuan Da Xue Xue Bao(Yi Xue Ban), 2011, 42(3): 326-30.[柳青, 刘雪娟, 陈玉娟, 等. 塞来昔布联合紫杉醇 对人乳腺癌MCF-7/Taxol耐药细胞株多药耐药的逆转作用及机 制的探讨[J]. 四川大学学报(医学版), 2011, 42(3): 326-30.] |
| [11] | Zatelli MC, Luchin A, Piccin D, et al. Cyclooxygenase-2 inhibitors reverse chemoresistance phenotype in medullary thyroid carcinoma by a permeability glycoprotein-mediated mechanism[J]. J Clin Endocrinol Metab, 2005, 90(10): 5754-60. |
| [12] | Roy KR, Reddy GV, Maitreyi L, et al. Celecoxib inhibits MDR1 expression through COX-2-dependent mechanism in human hepatocellular carcinoma (HepG2) cell line[J]. Cancer Chemother Pharmacol, 2010, 65(5): 903-11. |
| [13] | Zhu FS, Chen XM, Huang ZG, et al. Rofecoxib augments anticancer effects by reversing intrinsic multidrug resistance gene expression in BGC-823 gastric cancer cells[J]. J Dig Dis, 2010, 11(1): 34-42. |
| [14] | Cannon CP, Cannon PJ. Physiology. COX-2 inhibitors and cardiovascular risk[J]. Science, 2012, 336(6087): 1386-7. |
| [15] | Wong BC, Zhang L, Ma JL, et al. Effects of selective COX-2 inhibitor and Helicobacter pylori eradication on precancerous gastric lesions[J]. Gut, 2012, 61(6): 812-8. |
 2015, Vol. 42
2015, Vol. 42


