文章信息
- 王海振,张丰,杜振宁. 2015.
- WANG Haizhen, ZHANG Feng, DU Zhenning. 2015.
- 新合成吩嗪衍生物体外诱导癌细胞周期阻滞和凋亡的实验
- Cancer Cell Cycle Arrest and Apoptosis in vitro Induced by Newly Synthesized Phenazine Derivatives
- 肿瘤防治研究, 2015, 42(09): 872-876
- Cancer Research on Prevention and Treatment, 2015, 42(09): 872-876
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.09.003
-
文章历史
- 收稿日期:2015-01-05
- 修回日期:2015-04-10
2. 210009南京,中国药科大学生物技术中心
2.Biotechnology Center, China Pharmaceutical University,Nanjing 210009,China
肿瘤是一种常见病和高发病,发病率呈现逐年上升的趋势。虽然已有很多药物应用于临床,但随着对肿瘤的研究及耐药的发生,人类仍迫切需要发现新的更有效的抗肿瘤药物。
吩嗪类化合物广泛存在于自然界中,自1859年Fordos发现第一个吩嗪结构的天然产物绿脓菌素至今已有100余种不同吩嗪结构的天然产物被发现,通过化学合成手段对吩嗪类天然产物进行结构修饰或全新的合成物也不断出现。其抗肿瘤活性和构效关系的研究也越来越受到人们的关注,作用机制可能与干扰呼吸链、抑制拓扑异构酶活性和DNA断裂作用等相关[1, 2]。
本课题组前期研究从海洋放线菌发酵液中提取分离出新型吩嗪氨基取代化合物,具有良好的抗肿瘤和抗真菌活性。在已有研究基础上,通过化学结构修饰及药效团拼接合成一系列衍生物[3, 4],Mahdavinia等[5]于2013年对3-Amino-2’-oxospiro[benzo[c]pyrano [3, 2-a]phenazine-1, 3’-indoline]-2-carbonitrile(即化合物pc28)的化学合成进行了研究,将吩嗪母核与苯并吡啶拼接,并引入吲哚环,但其生物学活性未见报道。本研究即对四种活性较强的合成吩嗪类化合物做进一步研究,探讨其可能的作用机制。
1 材料和方法 1.1 主要材料和仪器人肺癌细胞株A549、人肝癌细胞株HepG2、人结直肠癌细胞株HCT116和人结直肠腺癌细胞株SW620为中国药科大学生物技术中心保存;吩嗪化合物(pn18、pn23、pc27和pc28)由中国药科大学海洋药物研究中心合成,纯度>90%,四种化合物母核结构相同,取代基类型和位置不同;羟基喜树碱(Hydroxycamptothecine, HCPT)和顺铂(Cisplatin, PDD)购自上海晶纯生化科技股份有限公司,纯度98%;RPMI 1640培养液和胎牛血清购自美国Gibco公司;四甲基偶氮唑盐(MTT)购自美国Sigma公司;吖啶橙/溴乙锭(AO/EB)染色试剂盒和碘化丙啶(PI)染色试剂盒购自南京凯基生物公司;Annexin V-FITC/7-AAD凋亡检测试剂盒购自美国BioLegend公司 ;BCA蛋白定量试剂盒和ECL化学发光试剂盒购自上海碧云天生物技术有限公司;兔抗人p53、caspase-3、β-actin单克隆一抗,山羊抗兔多克隆二抗购自美国Epitomics公司;其他试剂均为市售分析纯。酶标仪(Bio-RAD 680,美国);荧光显微镜(OLYMPUS IX71,日本);流式细胞仪(美国BD公司FACSCalibur);化学发光检测仪(上海天能科技有限公司Tanon 5200)。
1.2 细胞培养与传代细胞接种于含10%胎牛血清的RPMI 1640培养液中,在37℃,5% CO2及饱和湿度条件下培养,每周传代2~3次,用0.25%胰蛋白酶消化,1 : 3传代接种于新的培养瓶中。
1.3 MTT实验检测细胞毒性参照文献中方法[6],取对数期生长细胞接种于96孔培养板,每孔5×103个细胞,培养箱中孵育24 h后更换含化合物(0.625、1.25、2.5、5、10、20、40、80 μmol/L)的完全培养液,每个浓度组设置5个复孔,以HCPT或PDD为阳性对照药物,溶剂对照组含0.1%二甲基亚砜(DMSO),并设置只含有培养液的调零组。培养24、48 或72 h,加入20 μl MTT(5 mg/ml),继续培养4 h后缓慢吸除上清液,加150 μl DMSO,振荡摇晃10 min使结晶充分溶解后用酶标仪检测570 nm吸光度(A)值。计算相对活细胞抑制率(IR):IR=[1-(A实验组均值-A调零组均值)/(A对照组均值- A调零组均值)] ×100%,用GraphPad Prism5软件非线性回归计算半数抑制浓度(IC50)。
1.4 AO/EB染色鉴定细胞凋亡和坏死参照说明书及文献[7],按1.3中方法接种细胞,孵育24 h后更换含20 μmol/L不同化合物的完全培养液。培养24 h后吸除上清液,每孔加入100 μl含AO/EB(均为50 μg/ml)的PBS液,室温下避光静置5 min,荧光显微镜下观察拍照。
1.5 流式细胞仪检测细胞周期取对数生长期细胞接种于6孔板,每孔2×105个细胞,孵育24 h后,用含0.1%胎牛血清的培养液同步化12 h后,更换含20 μmol/L化合物的完全培养液。培养24 h,胰酶消化收集细胞,PBS洗两遍,用预冷70%乙醇在-20℃固定24 h。离心去除乙醇,PBS洗两遍,加入500 μl含1% RNase(DNase free)的缓冲液,37℃孵育30 min。然后加入5 μl PI染料,4℃避光反应15 min,1 h内用流式细胞仪检测DNA含量,数据用Modfit软件分析[8]。
1.6 Annexin V-FITC/7-AAD法检测细胞凋亡参照说明书及文献[9],同1.5中方法接种细胞,孵育24 h后,更换含20 μmol/L化合物的完全培养液。培养24 h,胰酶消化收集细胞,预冷PBS洗两遍,用Binding buffer重悬并调整细胞密度至(0.25×107)~(1.0×107)个细胞每毫升,取100 μl细胞悬液加入5 μl Annexin V-FITC混匀后加入5 μl 7-AAD混匀,室温避光反应5~10 min,样品补加Binding buffer至500 μl,1 h内用流式细胞仪检测细胞凋亡,数据用Flowjo软件分析。
1.7 蛋白提取及免疫印迹按照1.6中方法接种并用化合物处理细胞并收集细胞至1.5 ml离心管中,在冰上裂解提取细胞总蛋白,BCA法测定蛋白浓度,100℃水浴变性10 min,每孔40 μg上样,以12%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳分离,在聚偏二氟乙烯膜湿转适当时间后,用含5%牛血清白蛋白的TBST(Tris-Buffered Saline containing 0.05% Tween 20)封闭1 h,1:1 000稀释一抗,4℃孵育过夜后以TBST清洗三次,每次10 min,1:2500稀释辣根过氧化物酶标记的二抗,室温反应1 h,TBST清洗三次,每次10 min,化学发光显影并拍照[8]。
1.8 统计学方法采用Quantity One(Bio-Rad)软件分析图像,以目标蛋白与β-actin的灰度值表示其相对表达量。用GraphPad Prism5对数据进行统计分析,结果以3次独立实验的均数±标准差表示,组间比较进行t检验,P<0.05为差异有统计学意义。
2 结果 2.1 化合物对肿瘤细胞增殖的影响四种化合物能有效抑制肿瘤细胞存活,其中化合物pc28对HepG2、A549、HCT116作用最强,48 h的IC50比其他三种化合物低;对SW620作用最强的是化合物pn23。相比之下整体对A549作用较弱,对HCT116作用较强,见表 1。在机制研究中选择HCT116为实验细胞株,并检测了化合物作用24和72 h后对细胞增殖的影响。
 |
四种化合物抑制HCT116细胞增殖呈时间和剂量依赖性,相比其他化合物,pc28的剂量依赖性更加明显,在10~20 μmol/L浓度范围,细胞存活率迅速下降,见图 1。

|
| Cells were treated with different compounds at various concentrations for 24, 48 or 72 h; A: pn18; B: pn23; C: pc27; D: pc28 图 1 化合物对HCT116细胞增殖的影响 Figure 1Effect of compound on proliferation of HCT116 cells |
20 μmol/L化合物作用细胞24 h后进行AO/EB染色,荧光显微镜下观察。对照组细胞形态均匀,染色质绿色荧光均匀分布;与之相比,加化合物处理组细胞密度降低,变圆或呈不规则形状,边界模糊。化合物pn23和pc28使HCT116细胞膜出现芽状突起,并可见细胞碎片产生,细胞内略有红色荧光增加说明细胞膜通透性增加,pn18作用稍弱。化合物pc27作用后,细胞内染色质浓缩,细胞核碎裂呈点状,呈现早期凋亡特征,见图 2,说明化合物不同程度诱导细胞凋亡的发生。
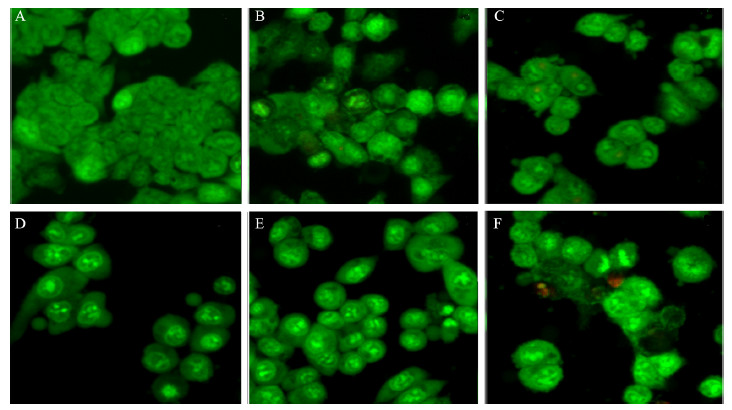
|
| Cells were treated with different compounds(20μmol/L) for 24h and stained with acridine orange/ethidium bromide(AO/EB); A: control group; B:pn18; C: pn23; D: HCPT; E: pc27; F: pc28 图 2 荧光显微镜下观察化合物对HCT116细胞形态的影响 Figure 2Effect of compound on morphology of HCT116 cells observed by fluorescent microscope |
不同浓度化合物作用细胞24 h后引起HCT116细胞周期分布改变,浓度为20 μmol/L时,化合物pn18和pc27诱导G0/G1期细胞分别升高17.5%和25.0%,而pc28诱导S期细胞升高11.0.%,与对照组相比差异均有统计学意义(P=0.0104, P=0.0261和P=0.0161);10 μmol/L和20 μmol/L化合物pn23诱导S期细胞分别升高8.60%和18.4%,与对照组相比差异均有统计学意义(P=0.0153和P=0.034),见图 3。四种化合物均有诱导肿瘤细胞周期阻滞的作用,但作用结果有所差异,化合物pn18和pc27诱导G0/G1期细胞增加,而化合物pn23和pc28诱导S期细胞增加。

|
| Cells were treated with different compounds (0,10 or 20μmol/L) for 24h and analyzed by flow cytometry.A:pn18;B:pn23;C:pc27;D:pc28;*:P < 0.05 compared with 0μmol/L compounds;**:P < 0.01 compared with 0μmol/L compounds 图 3 化合物对HCT116细胞周期的影响 Figure 3Effect of compound on cell cycle of HCT116 |
在流式检测细胞凋亡时,通过annexin V-FITC/7-AAD双染可以将正常细胞、早期凋亡、晚期凋亡和坏死细胞群分开。实验中,四种化合物均不同程度诱导HCT116细胞凋亡增加,由对照组的1.27%升高至56.9%~75.6%,且以早期凋亡为主。其中化合物pc28诱导凋亡细胞增加最为明显,早期凋亡细胞和晚期凋亡细胞分别升高54.9%和19.4%。坏死细胞没有明显增多,见图 4。
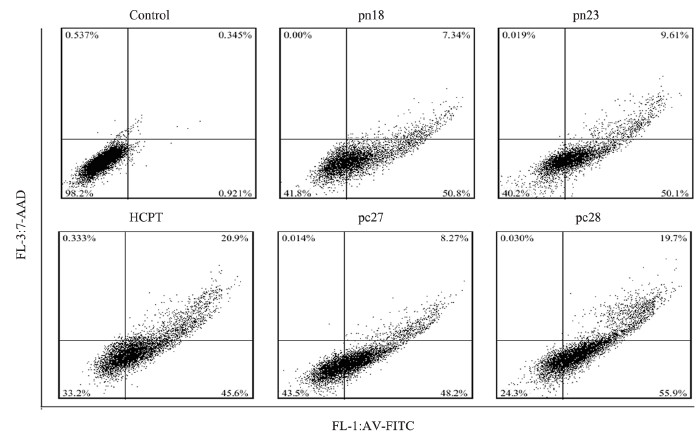
|
| Cells were treated with different compounds (20μmol/L) for 24h and apoptosis was detected by flow cytometry 图 4 化合物对HCT116细胞凋亡的影响 Figure 4Effect of compound on apoptosis of HCT116 cells |
在Western blot实验中,化合物对凋亡调控关键蛋白p53和凋亡执行关键蛋白caspase-3的表达有不同影响。化合物pn23和pc28引起p53蛋白表达升高,为对照组的1.23倍(P=0.0312)和1.17倍(P=0.0182),其他两种化合物对其影响较弱。化合物pc28对caspase-3的表达及激活有促进作用,为对照组的1.44倍(P=0.0013)和1.14倍(P=0.0389),其他化合物作用则较弱,见图 5。

|
| Cells were treated with different compounds(20μmol/L) for 24 h 图 5 Western blot检测化合物对p53和caspase-3蛋白表达的影响 Figure 5Effect of compound on p53 and caspase-3 expression in HCT116 cells analyzed by Western blot |
常用抗肿瘤药物通过诱导细胞周期阻滞和凋亡达到抑制肿瘤生长,p53蛋白在周期阻滞和凋亡中发挥重要作用。作为转录因子,p53具有抗肿瘤作用,能够诱导Bax蛋白表达,通过线粒体途径使细胞凋亡;在周期调控中,能够诱导p21、p27等的表达,从而发挥调节作用[10, 11]。
吩嗪化合物的抗肿瘤活性已有广泛研究,可诱导细胞凋亡或周期阻滞的发生,其作用机制与抑制拓扑异构酶和诱导活性氧产生相关。DNA作为细胞生命活动的重要遗传物质,已成为多种抗肿瘤药物的靶标。吩嗪化合物拥有平面大分子结构,可能通过类似于溴乙锭和喜树碱类化合物的方式与DNA结合[12]。
实验研究结果表明这四种化合物能抑制多种肿瘤细胞增殖,普遍对人结直肠癌细胞HCT116较为有效,并呈时间-剂量依赖性。化合物pn23和pc28能诱导细胞周期阻滞在S期,并使p53表达升高,可能与DNA损伤和合成阻滞相关,其p53表达差异可能与检测时间和作用浓度相关。化合物pn23显示出较强的周期阻滞作用,可能与其诱导p53蛋白高表达相关。化合物pc28有较强的诱导凋亡作用,但其诱导p53表达作用不强,推测可能有除p53通路外其他信号转导途径参与。化合物pn18和pc27虽然也能诱导细胞周期阻滞及凋亡发生,但其G0/G1期细胞显著增加且p53蛋白表达和caspase-3活化程度与pn23和pc28不同,说明它们之间可能存在不同的作用机制。整体来看,通过组合化学合成的化合物< /span>pc28相比简单的基团取代修饰显示出在化合物结构改造和新化合成方面的优势,在抗肿瘤活性方面表现出较强的诱导凋亡作用和一定程度的周期阻滞作用。组合化学原理可能更利于活性化合物的发现,此方式也可为吩嗪类化合物结构改造提供思路。
综上所述,四种新型吩嗪化合物能有效抑制结直肠癌细胞增殖,与诱导周期阻滞和凋亡相关,其具体分子调节机制和信号通路还有待进一步研究。依据组合化学原理合成的化合物pc28表现出较强的抗肿瘤活性,其是否影响DNA结构稳定及诱导肿瘤细胞凋亡的分子机制仍在研究中。
(致谢:感谢中国药科大学陆园园老师提供吩嗪化合物,感谢中国药科大学生物技术中心奚涛教授提供良好的实验条件。)
| [1] | Laursen JB, Nielsen J. Phenazine natural products: Biosynthesis, synthetic analogues, and biological activity[J]. Chem Rev, 2004, 104(3): 1663-86. |
| [2] | Cimmino A, Evidente A, Mathieu V, et al. Phenazines and cancer[J]. Nat Prod Rep, 2012, 29(4): 487-501. |
| [3] | Gao X, Lu Y, Fang L, et al. Synthesis and anticancer activity of some novel 2-phenazinamine derivatives[J]. Eur J Med Chem, 2013, 69: 1-9. |
| [4] | Gao X, Lu Y, Xing Y, et al. A novel anticancer and antifungus phenazine derivative from a marine actinomycete BM-17[J]. Microbiol Res, 2012, 167(10): 616-22. |
| [5] | Mahdavinia GH, Mirzazadeh M, Notash B. A rapid and simple diversity-oriented synthesis of novel 3-amino-2’- oxospiro[benzo[c]pyrano[3, 2-a]phenazine-1, 3’-indoline]-2- carbonitrile/carboxylate derivatives via a one-pot, four-component domino reaction[J]. Tetrahedron Letters, 2013, 54(27): 3487-92. |
| [6] | Xie MJ, Ma YH, Miao L, et al. Emodin-provoked oxidative stress induces apoptosis in human colon cancer HCT116 cells through a p53-mitochondrial apoptotic pathway[J]. Asian Pac J Cancer Prev, 2014, 15(13): 5201-5. |
| [7] | Ribble D, Goldstein NB, Norris DA, et al. A simple technique for quantifying apoptosis in 96-well plates[J]. BMC Biotechnol, 2005, 5: 12. |
| [8] | Lee WS, Chen RJ, Wang YJ, et al. In vitro and in vivo studies of the anticancer action of terbinafine in human cancer cell lines: G0/ G1 p53-associated cell cycle arrest[J]. Int J Cancer, 2003, 106(1): 125-37. |
| [9] | Ma YS, Yang IP, Tsai HL, et al. High glucose modulates antiproliferative effect and cytotoxicity of 5-fluorouracil in human colon cancer cells[J]. DNA Cell Biol, 2014, 33(2): 64-72. |
| [10] | Bates S, Vousden KH. p53 in signaling checkpoint arrest or apoptosis[J]. Curr Opin Genet Dev, 1996, 6(1): 12-8. |
| [11] | O’Connor PM, Jackman J, Bae I, et al. Characterization of the p53 tumor suppressor pathway in cell lines of the National Cancer Institute anticancer drug screen and correlations with the growthinhibitory potency of 123 anticancer agents[J]. Cancer Res, 1997, 57(19): 4285-300. |
| [12] | Wang SL, Wu FY, Cheng C, et al. Multicomponent synthesis of poly-substituted benzo[a]pyrano[2, 3-c]phenazine derivatives under microwave heating[J]. ACS Comb Sci, 2011, 13(2): 135-9. |
 2015, Vol. 42
2015, Vol. 42


