文章信息
- 于洋, 李雁. 2015.
- YU Yang, LI Yan. 2015.
- 胃癌腹膜转移癌治疗研究进展及我国治疗现状
- Development of Peritoneal Carcinomatosis from Gastric Cancer and Current Status of Treatment in China
- 肿瘤防治研究, 2015, 42(08): 829-834
- Cancer Research on Prevention and Treatment, 2015, 42(08): 829-834
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.08.017
-
文章历史
- 收稿日期:2014-10-24
- 修回日期:2014-12-04
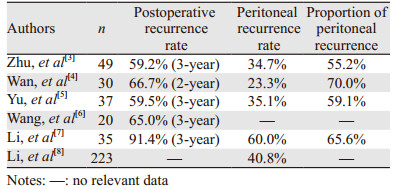
胃癌是我国最常见的恶性肿瘤之一,全世界每年新发胃癌约98.96万例,70%发生于包括我国在内的发展中国家[1]。大多数病例在确诊时已处于进展期,传统治疗手段包括手术治疗及系统性化疗已难以达到治愈。国内研究显示,55.6%~91.4%的胃癌患者于接受根治性手术后3年内复发,其中55.2%~70.0%为腹膜复发,见表 1,说明腹膜复发是我国胃癌患者根治性手术治疗失败的主因。胃癌腹膜转移形成腹膜癌(peritonealcarcinomatosis,PC),主要表现为顽固性腹痛、难治性腹水及快速进展性肠梗阻[2],预后很差,中位生存期不足6月。
 |
腹腔游离癌细胞(peritoneal free cancer cells,PFCCs)是胃癌术后复发及腹膜转移的主要因素,是导致患者预后不良的关键[9]。日本胃癌协会将PFCCs列入胃癌分期的一项重要指标[10],腹水或腹腔冲洗液脱落细胞学检查找到癌细胞,即为Ⅳ期。因此胃癌根治术必需充分切除原发癌肿,彻底清扫胃周淋巴结,同时还需杀灭PFCCs,任何一个环节的缺失都可能导致治疗失败。
李保中等[8]研究了468例进展期胃癌(advanced gastric cancer,AGC)根治性切除术患者,分别于肿瘤切除前、后及灌注化疗后收集腹腔液体,行腹腔液脱落癌细胞检查,结果显示,AGC患者接受根治性手术并常规冲洗腹腔后,PFCCs阳性率为20.6%,而术后6天拔管时患者PFCCs阳性率仍高达15.7%。该组患者术后接受常规系统性化疗,至随访结束共有40.3%的患者出现复发,2年内复发率为25.1%。热灌注化疗组患者通过手术预留的腹腔灌注通道,于手术当天以及术后第1~5天每天接受腹腔热灌注化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)1~2 h,灌注化疗药物为:羟基喜树碱、顺铂、氟尿嘧啶和香菇多糖,总灌洗量5 000 ml/d。该组患者术后第6天拔管时PFCCs阳性率为0,而术后复发率也显著低于单纯化疗组,见表 2。由此可见,PFCCs是导致胃癌患者术后复发的重要原因,而HIPEC可以有效清除PFCCs,减少复发,改善患者预后。
 |
胃癌PC尚无标准的或者推荐的治疗方案,在肿瘤学界的传统概念中,PC属于终末期疾病,只能采取包括全身化疗、腹腔化疗、姑息性手术、靶向治疗[11]等在内的姑息对症治疗。
2.1 全身化疗全身化疗可以控制病情进展、缓解症状,达到减轻肿瘤负荷、降低分期的目的,增加手术切除率。庄志祥等[12]进行了138例Ⅳ期胃癌患者接受全身化疗后的预后因素分析,其中包括腹膜转移患者32例,该组患者接受的化疗方案包括:FP、DCF、SP、FOLFOX4和XELOX,全组患者中位生存期为6月,生存期超过24月的仅6例,Cox比例分析模型发现腹膜转移为一项独立预后因素。Sakuramoto等[13]研究了替吉奥(S-1)作为胃癌辅助化疗的作用,发现术后口服S-1辅助化疗可减少胃癌患者术后复发转移,口服S-1组患者局部复发、区域淋巴结复发以及腹膜复发较单纯手术组均明显降低,但血行转移发生率无明显差异。而Yonemura等[14]报道了术后口服S-1辅助化疗对PFCCs阳性胃癌患者的治疗作用,结果显示口服S-1组和对照组患者1、2年生存率分别为88.0%、53.0%和44.0%、9.0%,中位生存期分别为21.1月和9.1月,表明PFCCs是影响胃癌患者预后的重要因素,而S-1全身化疗能够改善PFCCs阳性患者的预后。
2.2 腹腔化疗腹腔化疗是特异性作用于腹腔内病灶的一种区域性化疗,由于存在腹膜屏障,腹腔化疗可以使局部病灶药物浓度更高,而同时避免严重的全身不良反应。操礼群[15]比较了AGC患者术后早期应用静脉加全身化疗的治疗效果,腹腔化疗组患者3年生存率优于无腹腔化疗组,而复发转移率明显降低。而Yonemura等[16]纳入了96例胃癌PC患者接受联合腹腔内-全身新辅助化疗,并在治疗前后均对腹腔冲洗液进行脱落细胞学检查,化疗药物为口服S-1加多西他赛和顺铂腹腔内注射,2周期治疗后,41例(63.0%)患者PFCCs转阴,这些患者接受手术治疗后32例(78%)患者达到完全细胞减灭。因此腹腔化疗联合全身化疗可预防胃癌术后复发转移,并辅助治疗胃癌PC,为手术治疗提供条件。
2.3 手术治疗胃癌PC患者行姑息性手术的主要目的在于缓解症状,降低出血、穿孔等并发症风险,为其他综合治疗提供条件。丁友成等[17]比较了57例胃癌PC患者的临床病理特征及治疗结果,生存分析表明行姑息性切除的患者的生存时间明显长于未行手术切除者。Cox回归多因素分析显示手术切除是影响预后的唯一因素。吴晖等[18]研究显示:胃癌腹膜种植区域在结肠上区组的患者,淋巴结清扫组与淋巴结未清扫组比较,中位生存期以及1、3、5年生存率均有明显差异,因此适度的淋巴结清扫可显著延长胃癌PC患者生存期,在能够达到病灶全切除时,应行规范的淋巴结清扫。李正荣等[19]研究也显示胃癌PC患者姑息性切除组和未切除组的生存率差异具有统计学意义,切除组中位生存期(13.6月)长于未切除组(4.5月)。
2.4 细胞减灭术+腹腔热灌注化疗近年来国际上已经认识到PC是一种区域性癌转移,而非癌广泛转移,对于部分经谨慎选择的病例,积极的综合治疗不但能够有效控制病情,而且还有希望达到临床治愈。因此探索发展了一套新的综合治疗策略,其核心是肿瘤细胞减灭术(cytoreductive surgery,CRS)加HIPEC[2]。国际上已经开展的随机对照临床研究证明了该策略的疗效,在有些欧美国家,该技术被推荐为PC的标准治疗。
2.4.1 细胞减灭术由于单纯PC的转移病灶多局限于腹膜及腹腔内脏器表面,通过原发病灶切除、腹膜切除、淋巴结清扫以及转移病灶清除等技术,可以将腹腔内肉眼可见病灶全部切除,达到"组织学根治"。但由于患者整体状况、现有技术设备条件、围手术期处理水平、腹膜扩散程度、远处转移以及手术风险和并发症等原因,并非所有患者均能清除所有病灶,因此Sugarbaker[20, 21]提出了腹膜癌指数(peritoneal carcinomatosis index,PCI)和细胞减灭程度(completeness of cytoreduction score,CCR)的概念,用于评估PC状态,PCI评分将腹部分为13个区域:包括"九分法"的9个区域,并将小肠及肠系膜分为4个区域,见图 1。评分标准为:0分:无可见肿瘤;1分:肿瘤直径≤0.5 cm;2分:肿瘤直径>0.5 cm~≤5.0 cm;3分:肿瘤直径>5.0 cm或融合。上述评分总和即为PCI,最高39分。而CCR评分标准为:0分:CRS后无腹膜残余瘤;1分:残余瘤直径<2.5 mm;2分:残余瘤直径2.5 mm~2.5 cm;3分:残余瘤直径>2.5 cm或存在无法切除的病灶。杨肖军等[22]研究显示,低PCI (PCI≤20)和高PCI (PCI>20)者生存期为27.7月和6.4月,差异有统计学意义。CCR-0、CCR-1、CCR-2&3者生存期为43.4月、9.4月和8.3月(P=0.001,CCR-0与CCR1-3比)。多因素分析显示PCI评分和CCR评分是胃癌PC患者的独立预后因素。两项评分标准对于胃癌PC患者临床治疗及患者预后具有重要的指导意义。
2.4.2 腹腔热灌注化疗HIPEC技术最先由Spratt等[23]设计提出,该技术基于正常组织细胞与肿瘤组织对高温耐受性的差异以及热疗与化疗的协同作用,结合腹腔解剖学特点,使用大容量液体灌洗的治疗手段,可使化疗药物对肿瘤的杀伤作用增强20~600倍,能够有效清除PFCCs和微转移病灶,对预防和治疗腹膜转移或复发具有独特疗效。
HIPEC包括灌注时机、灌注溶液、化疗药物、灌注温度、灌注时间、灌注方式以及灌注次数等,国外PC中心大多于关腹前施行HIPEC,在开放的腹腔内术者通过搅动,可使灌注药液在腹腔内均匀分布,并且有利于保持灌注液整体温度的监测和控制;部分肿瘤科医生会选择于术后早期施行HIPEC,通过手术留置灌注管道或者穿刺置管,在密切监护的同时进行灌注治疗,这样可以避免因手术、麻醉时间过长可能导致的患者术后恢复慢、并发症发生率增高等风险。
HIPEC通常可选低渗或者等渗的灌注溶液,张竝等[24]研究了胃癌患者根治术后接受低渗热灌注化疗、等渗热灌注化疗以及单纯手术组,研究显示,低渗热灌注化疗与等渗热灌注化疗均能提高患者的生存率,低渗热灌注化疗在延缓肿瘤复发上优于等渗热灌注化疗。因为低渗溶液可引起肿瘤细胞肿胀、破裂,并增加细胞膜通透性,提高肿瘤细胞对化疗药物的摄取。而等渗疗法相对更加稳定,灌注治疗时间较低渗疗法更长,并且可应用较高的化疗药物浓度同时避免严重的全身不良反应。等渗灌注疗法通常选择0.9%氯化钠溶液或者平衡液,国内学者大多倾向于使用0.9%氯化钠溶液作为灌注溶剂,见表 3。
 |
张家裕等[25]利用新西兰大白兔建立胃空肠吻合口,模拟胃癌根治术后的胃肠吻合,关腹前进行低渗腹腔热灌注治疗,研究显示,虽然实验组和对照组在术后10天均未发生吻合口瘘,检测吻合口破裂压也无明显统计学差异,但实验组羟脯氨酸明显低于对照组,表明吻合口愈合过程中纤维蛋白合成量存在差异,实验组吻合口病理显示黏膜、黏膜下层不连续,黏膜下肌层缺如,无明显纤维组织反应,吻合口还处于充血水肿的状态,炎性细胞浸润,淋巴滤泡形成,而假手术对照组的吻合口黏膜上皮移行、延续,伴随纤维组织增生和少量脂肪组织、血管形成,肌层增厚,炎性反应较轻,表明低渗、温热和化疗药物在一定程度上抑制了胃肠吻合口的愈合。
胃癌PC腹腔灌注治疗选择药物时,首先要考虑胃癌敏感的药物,其次还应选择大分子、水溶性、离子型药物,因为其腹腔代谢速度较慢,而在血浆中清除速度较快,由于HIPEC治疗时间通常在1~2 h,所以直接细胞毒性药物可能效果更好。临床常用药物包括:5-Fu,HCPT、EPI、MMC,以及DDP/CBP等铂类药物。
正常组织能耐受的温度高于肿瘤组织,在一定温度范围内,热效应可促进肿瘤凋亡、增强化疗药物疗效、抑制肿瘤血管形成,同时可激发机体免疫系统活性,效果随温度升高而增强,但43℃以上的高温将对机体产生热损伤,温度越高,热损伤作用越严重,HIPEC治疗后并发症的发生率越高,因此HIPEC应选择合适的治疗温度,大多数临床报道的治疗温度为41℃~45℃,研究结果显示低于45℃的HIPEC治疗对术后并发症的发生率无明显影响。
2.4.3 CRS+HIPEC的安全性对于PC患者,通常CRS为获得最佳缩瘤效果而进行的手术范围很大,而HIPEC又延长了手术和麻醉时间,所以HIPEC的病残和死亡风险较高[27],病残率为27%~56%,常见并发症有肠瘘、胆瘘、脓肿、切口裂开、肠梗阻、脑梗塞、肺栓塞、心衰、血液毒性反应、深静脉血栓形成、胸水等。但大量患者行CRS+HIPEC后有两个有趣现象:第一,很少有患者因腹腔内粘连而需要再手术;第二,对二次手术患者探查发现腹腔内粘连程度远远低于预期。动物实验研究也表明5-Fu腹腔内灌注有预防腹腔内粘连作用[32]。随着学习曲线发展,手术技术以及围手术期治疗和护理水平提高,患者的病残率及死亡率可接近普通手术水平。
2.4.4 远期生存分析比较1988年Fujimoto等[28]首次报道了胃癌PC患者接受CRS+HIPEC治疗后平均生存期为(7.2 ± 4.6)月,随后美国、日本、韩国、澳大利亚、法国、荷兰及欧洲其他国家相继开展了该疗法对胃癌PC患者的临床研究。其中,我国杨肖军、李雁[22, 26, 29, 30, 31]等进行了CRS+HIEPC治疗胃癌PC的系列临床研究,证实胃癌PC患者接受CRS+HIPEC治疗后,生存期可延长约70%(6.5月vs.11.0月),与对照组相比,治疗组并发症发生率并未明显增加。Wu等[32]报道了62例胃癌伴卵巢或盆腔转移的女性患者,32例CRS+HIPEC治疗组患者中位生存期较30例单纯CRS组患者明显延长(15.5月vs.10.4月),其中伴随盆腔转移的患者接受CRS+HIPEC治疗后中位生存期较单纯CRS组患者明显延长(10.1月vs.7.4月),而单纯卵巢转移患者接受HIPEC与否生存期无明显差异。
3 展望随着国际肿瘤学界的探索,CRS+HIPEC在理论和技术层面不断突破,已成为目前治疗PC的最优选择,充分发挥了多治疗模式的协同效应,体现了肿瘤综合治疗的思想。相继开展的随机对照试验均显示,CRS+HIPEC相对于传统治疗方式具有明显的治疗优势,对于部分经过选择的PC患者,积极的综合治疗不但能够有效控制病情进展,而且还有希望达到临床治愈。国际腹膜癌大会已通过CRS+HIPEC作为经过选择的结直肠癌PC患者的标准治疗方法,而对于胃癌同时性PC患者,也已有Ⅰ级循证医学证据支持推荐CRS+HIPEC治疗[31]。当前,国内针对胃癌PC主要采取姑息性治疗措施(如全身化疗、腹腔内化疗、姑息性手术等),HIPEC技术主要作为预防AGC患者术后腹膜转移、控制恶性腹水、结合全身化疗控制胃癌PC进展,只有少数中心能够将CRS+HIPEC视为具有治愈希望的治疗手段并应用于是临床,因此,亟需深入研究CRS+HIPEC在胃癌PC中的治疗效果,在肿瘤学科内建立专家共识,并形成治疗指南,以弥补我国在PC研究领域的不足,推动肿瘤学科的整体进步。
| [1] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2):69-90. |
| [2] | Li Y. My standpoint of perioneal carcinomatosis study[J]. Zhongguo Zhong Liu Lin Chuang, 2012, 39(22):1685-6.[李雁.腹膜癌研究之我见[J].中国肿瘤临床, 2012, 39(22):1685-6.] |
| [3] | Zhu ZG, Tang R, Yan M, et al. Clinical effect of intraoperative peritoneal hyperthermic chemotherapy for advanced gastric cancer[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2006, 9(1):26-30.[朱正纲,汤睿,燕敏,等.术中腹腔内温热化疗对进展期胃癌的临床疗效研究[J].中华胃肠外科杂志, 2006, 9(1):26-30.] |
| [4] | Wan JH, Xu YL, Shao J. Intraoperitive hyperthermic intraperitoneal chemotherapy to prevent the peritoneal recurrence of gastric cancer[J]. Shi Yong Zhong Liu Xue Za Zhi, 2006, 20(2):114-5.[万剑慧,徐幼龙,邵俊.胃癌术中腹腔温热化疗预防腹膜复发[J].实用肿瘤学杂志, 2006, 20(2):114-5.] |
| [5] | Yu WX, Xu Q. Clinical observation of postoperative intraperitoneal chemotherapy for advanced gastirc cancer[J]. Shi Yong Lin Chuang Yi Yao Za Zhi, 2006, 10(11):96-7.[虞卫新,徐群.进展期胃癌术后腹腔灌注化疗的临床观察[J].实用临床医药杂志, 2006, 10(11):96-7.] |
| [6] | Wang SX, Chen HB, Chen WY, et al. Observation on therapeutic outcome of operation combined with hyperthermic intraperitoneal lavage chemotherapy in treatment of stages Ⅲb and Ⅳ gastric cancer[J]. Zhongguo Pu Tong Wai Ke Za Zhi, 2007, 16(4):305-7.[王生祥,陈红兵,陈文元,等.手术联合腹腔温热灌注化疗治疗 Ⅲb,Ⅳ期胃癌的疗效观察[J].中国普通外科杂志, 2007, 16(4):305-7.] |
| [7] | Li W, Shi Z, Duan ZP, et al. Clinical study of early postoperative intraperitoneal hyperthermic chemotherapy for advanced gastric cancer[J]. Luzhou Yi Xue Yuan Xue Bao, 2008, 31(4):436-8.[李伟,史志,段佐平,等.进展期胃癌术后早期腹腔温热灌注化疗的临床研究[J].泸州医学院学报, 2008, 31(4):436-8.] |
| [8] | Li BZ, Li SM, Guan JY, et al. Clinical effect of postoperative continued intraperitoneal hyperthermic immunochemotherapy for advanced gastric cancer[J]. Xian Dai Zhong Xi Yi Jie He Za Zhi, 2008, 17(26):4074-6.[李保中,李守淼,管建云,等.进展期胃癌术中术后持续腹腔内温热免疫化疗的临床疗效分析[J].现代中西医结合杂志, 2008, 17(26):4074-6.] |
| [9] | Mezhir JJ, Shah MA, Jacks LM, et al. Positive peritoneal cytology in patients with gastric cancer:natural history and outcome of 291 patients[J]. Ann Surg Oncol, 2010, 17(12):3173-80. |
| [10] | Japanese Gastric Cancer Association:Japanese gastric cancer treatment guidelines 2010 (ver. 3)[J]. Gastric Cancer, 2011, 14(2):113-23. |
| [11] | Tan YN, Yuan Y. Treatment advances of peritoneal metastasis from gastric cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2015, 42(5):506-10.[谭伊诺,袁瑛.胃癌腹膜转移的治疗进展[J].肿瘤防治研究, 2015, 42(5):506-10.] |
| [12] | Zhuang ZX, Lu YF, Shen LQ. Prognostic factors for survival of 138 patients with stage Ⅳ gastric cancer[J]. Zhongguo Zhong Liu Chuang, 2009, 36(23):1336-9.[庄志祥,陆玉峰,沈丽琴. 138例Ⅳ期胃癌者预后因素分析[J].中国肿瘤临床, 2009, 36(23):1336-9.] |
| [13] | Sakuramoto S, Sasako M, Yamaguchi T, et al. Adjuvant chemotherapy for gastric cancer with S-1, an oral fluoropyrimidine[J]. N Engl J Med, 2007, 357(18):1810-20. |
| [14] | Yonemura Y, Endou Y, Bando E, et al. The usefulness of oral TS-1 treatment for potentially curable gastric cancer patients with intraperitoneal free cancer cells[J]. Cancer Therapy, 2006,4:135-42. |
| [15] | Cao LQ. Clinical application of early postoperative two-way chemotherapy for advanced gastric cancer[J]. Shi Yong Zhong Liu Xue Za Zhi, 2007, 21(2):144-5,149.[操礼群.进展期胃癌术后早期双途径化疗的临床应用[J].实用肿瘤学杂志, 2007, 21(2):144-5, 149.] |
| [16] | Yonemura Y, Endou Y, Shinbo M, et al. Safety and efficacy of bidirectional chemotherapy for treatment of patients with peritoneal dissemination from gastric cancer:selection for cytoreductive surgery[J]. J Surg Oncol, 2009, 100(4):311-6. |
| [17] | Ding YC, Zhu ZG, Zhang J, et al. The analysis of clinicopathologic characters and survival in gastric cancer with peritoneal metastasis[J]. Zhongguo Shi Yong Wai Ke Za Zhi, 2003, 23(5):295-7.[丁友成,朱正纲,张俊,等.胃癌腹膜转移的临床病理特征及治疗结果分析[J].中国实用外科杂志, 2003, 23(5):295-7.] |
| [18] | Wu H, He YL, Cai SR, et al. Clinicopathological features and surgical interventions of gastric cancer with peritoneal seeding of different location[J]. Zhongguo Shi Yong Wai Ke Za Zhi, 2007, 27(11):879-82.[吴晖,何裕隆,蔡世荣,等.胃癌腹膜种植临床病理特征及手术对预后的影响[J].中国实用外科杂志, 2007, 27(11):879-82.] |
| [19] | Li ZR, Zhan WH, He YL, et al. Results of surgery in patients with gastric cancer extending to peritoneal metasasis[J]. Zhongguo Shi Yong Wai Ke Za Zhi, 2006, 26(11):855-7.[李正荣,詹文华,何裕隆,等.胃癌腹膜转移手术治疗的探讨[J].中国实用外科杂志, 2006, 26(11):855-7.] |
| [20] | Harmon RL, Sugarbaker PH. Prognostic indicators in peritoneal carcinomatosis from gastrointestinal cancer[J]. Int Semin Surg Oncol, 2005, 2(1):3. |
| [21] | Sugarbaker PH. Cytoreductive surgery and peri-operative intraperitoneal chemotherapy as a curative approach to pseudomyxoma peritonei syndrome[J]. Eur J Surg Oncol, 2001, 27(3):239-43. |
| [22] | Yang XJ, Li Y, Yang GL, et al. Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy in the treatment of gastic cancer with ascites and/or peritoneal carcinomatosis[J]. Wuhan Da Xue Xue Bao(Yi Xue Ban), 2010, 31(5):635-9.[杨肖军,李雁,杨国樑,等.细胞减灭术加腹腔热灌注化疗治疗胃癌腹膜癌[J].武汉大学学报(医学版), 2010, 31(5):635-9.] |
| [23] | Spratt JS, Adcock RA, Muskovin M, et al. Clinical delivery system for intraperitoneal hyperthermic chemotherapy[J]. Cancer Res, 1980, 40(2):256-60. |
| [24] | Zhang B, Jiang CH, Fang XD, et al. Influence of hypotonic intraoperative intraperitoneal chemohyperthermia(HIPCH) on the long term survival of patients with gastric cancer[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2004, 7(4):289-91.[张竝,姜朝晖,方旭东,等.胃癌患者术中腹腔低渗热灌注化疗的长期预后观察[J].中华胃肠外科杂志, 2004, 7(4):289-91.] |
| [25] | Zhang JY, Ni L, Cao YJ, et al. Experimental study of the influence of intraoperative hypotonic peritoneal chemo-hyperthermia on the healing of gastrointestinal anastomosis[J]. Xian Dai Zhong Liu Yi Xue, 2013, 21(5):1002-5.[张家裕,倪雷,曹亦军,等.术中低渗腹腔温热灌注化疗对胃肠吻合口愈合影响的实验研究[J].现代肿瘤医学, 2013, 21(5):1002-5.] |
| [26] | Li Yan, Zhou YF, Xie CH, et al. Cytoreductive surgery plus hyperthermic intra-peritoneal chemotherapy for peritoneal caicinomatosis from gastric cancer[J]. Zhongguo Zhong Liu Lin Chuang, 2012, 39(22):1734-40.[李雁,周云峰,谢丛华,等.细胞减灭术加腹腔热灌注化疗治疗胃癌腹膜转移癌的临床研究[J].中国肿瘤临床, 2012, 39(22):1734-40.] |
| [27] | Shen P, Levine EA, Hall J, et al. Factors predicting survival after intraperitoneal hyperthermic chemotherapy with mitomycin C after cytoreductive surgery for patients with peritoneal carcinomatosis[J]. Arch Surg, 2003, 138(1):26-33. |
| [28] | Fujimoto S, Shrestha RD, Kokubun M, et al. Intraperitoneal hyperthermic perfusion combined with surgery effective for gastric cancer patients with peritoneal seeding[J]. Annals of Surgery, 1988, 208(1):36-41. |
| [29] | Yang XJ, LiY, al-shammaa Hassan AH, et al. Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy improves survival in selected patients with peritoneal carcinomatosis from abdominal and pelvic malignancies:results of 21 cases[J]. Ann Surg Oncol, 2009, 16(2):345-51. |
| [30] | Yang XJ, LiY, Yonemura Y. Cytoreductive surgery plus hyperthermic intraperitoneal chemotherapy to treat gastric cancer with ascites and/or peritoneal carcinomatosis:Results from a Chinese Center[J]. J Surg Oncol, 2010, 101(6):457-64. |
| [31] | Yang XJ, Huang CQ, Suo T, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy improves survival of patients with peritoneal carcinomatosis from gastric cancer:final results of a phase Ⅲ randomized clinical trial[J]. Ann Surg Oncol, 2011, 18(6):1575-81. |
| [32] | Wu XJ, Yuan P, Li ZY, et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy improves the survival of gastric cancer patients with ovarian metastasis and peritoneal dissemination[J]. Tumour Biol, 2013, 34(1):463-9. |
 2015, Vol. 42
2015, Vol. 42



