文章信息
- 刘清银,李明,涂斌,胡晓丹,孙良起,李华信. 2015.
- LIU Qingyin, LI Ming, TU Bin, HU Xiaodan, SUN Liangqi, LI Huaxin. 2015.
- 应用磁珠联合质谱技术建立结直肠癌血清差异蛋白诊断模型
- Serum Peptidome Patterns of Colorectal Cancer Based on Magnetic Bead Separation and Mass-spectrometry Technique
- 肿瘤防治研究, 2015, 42(08): 801-805
- Cancer Research on Prevention and Treatment, 2015, 42(08): 801-805
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.08.011
-
文章历史
- 收稿日期:2014-10-17
- 修回日期:2015-01-18
2. 471031 洛阳,中国人民解放军第150中心医院呼吸科;
3. 471003 洛阳,洛阳市海关出入境检验检疫局检验科;
4. 471031 洛阳,中国人民解放军第150中心医院输血科
2. Department of Respiration,The 150th Hospital of Chinese PLA,Luoyang 471031,China;
3. Import and Export Inspection and Quarantine Division,Luoyang 471003,China;
4. Department of Transfusion,The 150 th Hospital of Chinese PLA,Luoyang 471031,China
结直肠腺癌是世界上常见的恶性肿瘤之一[1]。约50%的患者术后因局部复发或转移而死亡,这与患者就诊时分期较晚及是否选择合理的治疗方法有关。因此,有效的早期筛查及诊断是临床亟待解决的问题[2]。蛋白质组学领域的进展为肿瘤相关标志物的研究带来了新的希望[3, 4, 5]。本研究应用弱阳离子磁珠(weak cation exchange,WCX)结合基质辅助激光解析离子化飞行时间质谱(matrixassisted laser desorption/ionization time of flight massspectrometry,MALDI-TOF MS)对比分析了结直肠腺癌Ⅰ、Ⅱ期患者与健康志愿者血清蛋白质谱的差异,建立了具有较高准确性的结直肠腺癌诊断模板,现报道如下。
1 资料和方法 1.1 临床资料本研究得到解放军第150中心医院伦理委员会认证,所纳入病例及健康志愿者均为知情同意后行标本采集及相关检查。结直肠腺癌患者80例,均经术后病理学诊断确诊,其中TNM Ⅰ期28例、TNM Ⅱ期52例,平均年龄为(53.82±9.06)岁,术前经B型超声检查,排除肝、骨转移。同时收集健康志愿者血清76例,年龄、性别与结直肠腺癌组相比,差异无统计学意义。经体格、肠镜检查等排除结直肠占位性病变。按照完全随机化的方法,将结直肠腺癌患者与健康志愿者分为建模组与验证组。建模组包括结直肠腺癌40例,其中TNM Ⅰ期13例、TNM Ⅱ期27例,健康志愿者38例;验证组包括结直肠腺癌40例,其中TNM Ⅰ期15例、TNM Ⅱ期25例,健康志愿者38例。
1.2 血清标本采集采集健康志愿者清晨空腹静脉全血5 ml (不加抗凝剂),室温静置30 min后,以2 000 r/min离心15 min,取上清液分装,于-80℃冰箱冻存备用。结直肠腺癌患者于术前当日清晨采集,分离血清。
1.3 设备及试剂Autoflex-Ⅲ MALDI质谱仪、WCX磁珠试剂盒、α-氰基-4-羟基肉桂酸(α-cyano-4-hydroxycinnamic acid,CHCA)和混合标肽均购自德国Bruker公司。乙腈(acetonitrile,ACN)、尿素及三氟乙酸(trifluoroacetic acid,TFA)等购自美国Sigma公司。PHOMO型酶标检测仪购自河南郑州安图生物有限公司。
1.4 蛋白质的纯化操作流程参阅文献报道[6]:(1)4℃冰箱取出磁珠试剂盒,取出弱阳离子磁珠悬浮液一管,手动上下摇动1 min,完全混匀磁珠悬浮液;(2)取10 μl磁珠结合缓冲液加入200 μl样品管中,再加入10 μl磁珠及5 μl血清,用加样枪上下吸打混匀,避免产生气泡;(3)室温静置5 min,将样品管放入磁珠分离器,使磁珠贴壁1 min,磁珠与悬浮液体分离,用加样枪吸去悬浮液体;(4)加入100 μl磁珠清洗缓冲液,在磁珠分离器前后相邻两孔间反复移动样品管10次,使样品管在磁珠分离器上静置,磁珠贴壁,用加样枪吸去悬浮液体,枪头应避免接触到磁珠,避免吸走磁珠,重复本步骤2次;(5)从磁珠分离器上取下样品管,并向样品管中加入5 μl磁珠洗脱缓冲液,混匀贴壁的磁珠,反复吸打10次,将样品管放入磁珠分离器,磁珠贴壁2 min,磁珠与悬浮液体充分分离后,将上清液移入干净的0.5 ml样品管(先在管内加入5 μl稳定缓冲液,用加样枪小心吸打混匀);(6)先加入1 μl洗脱样品,室温放干后,再加入1 μl基质(3g/L CHCA,50% ACN,2% TFA),室温放干,准备质谱分析。
1.5 点靶先加入1 μl洗脱样品,室温放干后,再加入1 μl基质(3 mg/ml CHCA,50% ACN,2% TFA),室温放干,以备质谱分析。
1.6 质谱检测与生物信息学分析采用MALDI质谱仪,使用线性模式,设定采集范围为质荷比从600到18 000。应用Flex Analysis2.4获取质谱,Clinprot Tools 2.2 进行质谱图的平滑、衰减及标峰等处理,输出含有质荷比值和峰强度等数据,软件自动对数据进行统计学处理,以P<0.05为差异有统计学意义。Clinprot Tools 2.2对建模组样本的质谱图进行分析,采用支持向量机(support vector machine,SVM)算法建立诊断模板,计算敏感度与特异性。以a表示正确诊断的结直肠癌的病例数、b表示正确诊断的健康志愿者的例数、c表示错误诊断的结直肠癌的病例数、d表示错误诊断的健康志愿者的例数,敏感度为a/(a+c),特异性为b/(b+d)。为进一步评价所获取的诊断模板的诊断价值,以诊断模板对验证组样本进行判别、验证。
1.7 CEA的检测采用ELISA试剂盒,PHOMO型酶标仪检测验证组样本CEA浓度,实验步骤依说明书进行。
1.8 统计学方法用SPSS16.0统计软件分析结直肠腺癌与健康志愿者之间的临床资料(年龄、性别)之间的差异是否有统计学意义及诊断模板的诊断价值是否优于CEA。年龄采用均数±标准差,组间比较采用t检验;性别及两种诊断方法诊断价值的比较采用卡方检验,均为双侧检验,P<0.05为差异有统计学意义。
2 结果 2.1 差异蛋白质定量分析建立建模组样本血清蛋白质谱,在相对分子质量600~18 000内共检测到131个蛋白峰,代表性蛋白质谱,见图 1。以峰的曲线下面积评估蛋白的丰度,比较分析结直肠腺癌与健康志愿者之间差异蛋白质谱,共发现44个蛋白峰差异有统计学意义(P<0.05)。其中在结直肠腺癌中表达上调峰35个,表达下调峰9个,见表 1~2。以m/z 1 330.95、2 883.96及9 294.14等3个差异蛋白峰为例,其定量结果显示在结直肠腺癌中均明显升高,见图 2。

|
| AUC: Areas under the receiver operating characteristic curve; Red: 10 colorectal cancer patients; Blue: 10 healthy volunteers 图 1 结直肠癌与健康志愿者血清代表性质谱图 Figure 1 Aligned mass spectra of serum protein profile of model construction group obtained by MALDI-TOF after purification with WCX magnetic beads |

|
| 图 2 结直肠癌诊断模板中质荷比(m/z)为1 330.95、 2 883.96及9 294.14的蛋白定量结果 Figure 2 Box-and-whiskers plot calculated from the areas of the three proteins (m/z 1 330.95,2 883.96 and 9 294.14) selected for diagnostic model |
 |
 |
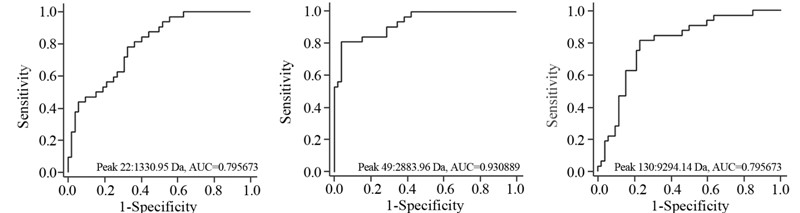
利用Clinprot Tools 2.2中支持向量机算法建立了由3个在结直肠腺癌中高表达蛋白(m/z 1 330.95、2 883.96及9 294.14)组成的诊断模型,准确性为94.87%(74/78)。其蛋白诊断结直肠腺癌的ROC曲线下面积分别为0.80、0.93及0.80,见图 3。
|
| 图 3 结直肠癌诊断模板中质荷比(m/z)为1 330.95、 2 883.96及9 294.14的蛋白诊断价值评估 Figure 3 Receiver operating characteristic curves(ROC) of the three proteins (m/z 1330.95,2 883.96 and 9 294.14) selected for diagnostic model |
为进一步评价本研究中所建立诊断模板的诊断价值,我们利用诊断模板对验证组样本进行分组,结果显示其敏感度为87.50%(35/40),特异性为89.47%(34/38),约登指数为0.77。其中,对验证组中15例早期患者(TNMⅠ期)诊断的敏感度为87.67%(13/15)。按说明书要求,以血清CEA浓度≥5 ng/ml为临界值,CEA诊断结直肠腺癌的灵敏度和特异性分别为60.00%(24/40)和55.26%(21/38)。诊断模板对结直肠腺癌的诊断价值高于CEA (χ2=78,P=0.000)。
3 讨论结直肠癌是临床常见的恶性肿瘤之一,其术后5年生存率随肿瘤分期的增高而显著降低,因此早期诊断、及时治疗是提高结直肠癌预后的主要因素[7]。目前,结直肠癌的诊断包括对高危人群进行体格检查、大便隐血试验、影像学检查和纤维结肠镜等,对结直肠癌的诊断尤其是对Ⅰ期的诊断较为困难[8]。在结直肠癌发生、发展的过程中,一些肿瘤细胞的蛋白质或多肽可以被巨噬细胞吞噬后携带到循环系统中,因此血液的蛋白质可发生相应变化,从而使得应用血清来发现特异标志物成为一种可能[9]。血清学检查具有非侵袭性、患者依从性好等优势,发现对结直肠癌分子分期及分型有意义的标志物对结直肠腺癌的防治有重要意义[2]。目前常用的血清标志物检测如CEA等对结直肠癌尤其是Ⅰ期患者的诊断灵敏度、特异性均较低[10]。因此,探索血清学检测结直肠癌,特别是早期患者具有重要的临床意义。
目前,蛋白质组已广泛用于疾病标志物的筛查[11, 12, 13, 14]。磁珠纯化蛋白,重复性较高,MALDI质谱是目前蛋白质组学研究的主要技术手段之一,具有显著的技术优势,结合相应的生物信息学分析软件,可以对不同状态下的获取蛋白质表达图谱进行定量分析,通过比较疾病与对照的差异蛋白质谱,建立由多个差异蛋白组成的诊断模板,可以准确识别疾病组患者,目前多用于乳腺癌、食管癌、糖尿病、胃癌、类风湿等疾病的临床筛查方法的研究[6, 15, 16, 17, 18]。Fan等利用这一技术平台,对结直肠癌血清蛋白质谱进行了研究,建立了有m/z为741和7 772两个蛋白组成的诊断模板,具有较高的诊断意义[19]。对筛选出来的差异蛋白进行鉴定是进一步分析差异蛋白的功能与意义的基础。Fan等结合纳升液相和LTQ Orbitrap XL质谱仪,鉴定了在结直肠癌诊断中有一定意义的蛋白alpha-2-HS-glycoprotein precursor和tubulin beta chain[20]。这一技术的应用对血清差异蛋白质谱的研究拓展了新的思路。
腺癌是结直肠癌最主要的病理类型之一。本研究采用磁珠联合MALDI-TOF-MS技术对40例结直肠腺癌患者和38例健康志愿者进行了血清蛋白质谱对比分析研究,结果发现有44个蛋白质峰在两组之间的表达的差异有统计学意义。以利用Clinprot Tools软件对数据进行分析,确立了以m/z为1 330.95、2 883.96及9 294.14等3个蛋白质所组成的模板,能正确地将结直肠腺癌患者与健康志愿者分组。为进一步评价诊断模板的诊断价值,我们将收集的另外一组样本作为验证组,由建立的诊断模板对验证组样本在双盲条件下进行分类,结果显示,该模板可以将40例结直肠腺癌中的35例正确分组,将38例健康者中的35例进行正确分组,具有较高的诊断价值。与之前研究[19, 20]相比,本研究最大的特点在于纳入了结直肠腺癌临床分期较早的患者,特别是纳入了一批结直肠腺癌TNM Ⅰ期患者。该诊断模板可以将15例早期患者(TNM Ⅰ期)中的13例正确诊断,提示该模板在早期诊断中具有较好的应用价值。尽管如此,由于样本量小,尤其是早期患者的样本量较小,因此有待于扩大样本之后进一步验证其临床应用价值。此外,对发现的对结直肠腺癌早期诊断有价值的蛋白质/多肽进行鉴定和功能分析将有助于阐明结直肠腺癌发生、发展机制,但由于技术上的局限性,此部分研究尚未取得理想结果。因此,不断地采用新技术、新方法对差异蛋白进行鉴定和功能描述也是我们今后的研究方向。
| [1] | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013, 63(1):11-30. |
| [2] | Smith RA, Cokkinides V, Brooks D, et al. Cancer screening in the United States, 2011:A review of current American Cancer Society guidelines and issues in cancer screening[J]. CA Cancer J Clin, 2011, 61(1):8-30. |
| [3] | Cho WC. Contribution of oncoproteomics to cancer biomarker discovery[J]. Mol Cancer, 2007, 6:25. |
| [4] | Martinez-Aguilar J, Chik J, Nicholson J, et al. Quantitative mass spectrometry for colorectal cancer proteomics[J]. Proteomics Clin Appl, 2013, 7(1-2):42-54. |
| [5] | Ikonomou G, Samiotaki M, Panayotou G. Proteomic methodologies and their application in colorectal cancer research[J]. Crit Rev Clin Lab Sci, 2009, 46(5-6):319-42. |
| [6] | Fan NJ, Gao CF, Zhao G, et al. Serum peptidome patterns for early screening of esophageal squamous cell carcinoma[J]. Biotechnol Appl Biochem, 2012, 59(4):276-82. |
| [7] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2):69-90. |
| [8] | Ang CS, Phung J, Nice EC. The discovery and validation of colorectal cancer biomarkers[J]. Biomed Chromatogr, 2011, 25(1-2):82-99. |
| [9] | Makridakis M, Vlahou A. Secretome proteomics for discovery of cancer biomarkers[J]. J Proteomics, 2010, 73(12):2291-305. |
| [10] | Ahlquist DA. Molecular detection of colorectal neoplasia[J]. Gastroenterology, 2010, 138(6):2127-39. |
| [11] | Fan NJ, Li K, Liu QY, et al. Identification of tubulin beta chain, thymosin beta-4-like protein 3, and cytochrome b-c complex subunit 1 as serological diagnostic biomarkers of gastric cancer[J]. Clin Biochem, 2013(46):1578-84. |
| [12] | Fan NJ, Gao CF, Wang XL. Identification of regional lymph node involvement of colorectal cancer by serum SELDI proteomic patterns[J]. Gastroenterol Res Pract, 2011, 2011:784967. |
| [13] | Ghafourian S, Sekawi Z, Raftari M, et al. Application of proteomics in lab diagnosis[J]. Clin Lab, 2013, 59(5-6):465-74. |
| [14] | Martinez-Aguilar J, Molloy MP. Label-free selected reaction monitoring enables multiplexed quantitation of S100 protein isoforms in cancer cells[J]. J Proteome Res, 2013, 12(8):3679-88. |
| [15] | Fan NJ, Gao CF, Wang XL. Tubulin beta chain, filamin a Alpha Iisoform 1, and cytochrome b-c1 complex subunit 1 as serological diagnostic biomarkers of esophageal squamous cell carcinoma:a proteomics study[J]. OMICS, 2013, 17(4):215-23. |
| [16] | Fan NJ, Gao CF, Zhao G, et al. Serum peptidome patterns of breast cancer based on magnetic bead separation and mass spectrometry analysis[J]. Diagn Pathol, 2012, 7:45. |
| [17] | Tang W, Shi YQ, Zou JJ, et al. Serum biomarker of diabetic peripheral neuropathy indentified by differential proteomics[J]. Front Biosci(Landmark Ed), 2011, 16:2671-81. |
| [18] | Dai Y, Hu C, Wang L, et al. Serum peptidome patterns of human systemic lupus erythematosus based on magnetic bead separation and MALDI-TOF mass spectrometry analysis[J]. Scand J Rheumatol, 2010, 39(3):240-6. |
| [19] | Fan NJ, Gao CF, Wang XL, et al. Serum peptidome patterns of colorectal cancer based on magnetic bead separation and MALDITOF mass spectrometry analysis[J]. Biomed Biotechnol, 2012, 2012:985020. |
| [20] | Fan NJ, Kang R, Ge XY, et al. Identification alpha-2-HSglycoprotein precursor and tubulin beta chain as serology diagnosis biomarker of colorectal cancer[J]. Diagn Pathol, 2014, 9:53. |
 2015, Vol. 42
2015, Vol. 42


