文章信息
- 苗成利,何远翔,李玉坤,蒋彦永,于军辉,刘星,罗成华. 2015.
- MIAO Chengli, HE Yuanxiang, LI Yukun, JIANG Yanyong, YU Junhui, LIU Xing, LUO Chenghua. 2015.
- 腹膜后肿瘤临床病理特征与诊治分析
- Clinicopathological Features and Diagnosis of Retroperitoneal Tumor
- 肿瘤防治研究, 2015, 42(08): 797-800
- Cancer Research on Prevention and Treatment, 2015, 42(08): 797-800
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.08.010
-
文章历史
- 收稿日期: 2015-06-18
- 修回日期: 2015-07-06
2. 100039 北京,中国人民解放军总医院普外科;
3. 100038 北京,首都医科大学附属北京世纪坛医院肿瘤外科三病区
2. Department of General Surgery, The Chinese People’s Liberation Army General Hospital, Beijing 100039, China;
3. Tumors Center, Department of Surgical Oncology, Beijing Shijitan Hospital, Capital Medical University, Beijing 100038, China
腹膜后肿瘤(retroperitoneal tumor,RPT)是起源于腹膜后潜在间隙肿瘤的总称,主要包括脂肪肉瘤、平滑肌肉瘤、纤维瘤等,但不包括肝、十二指肠、胰腺、肾、肾上腺、输尿管、骨骼等腹膜后脏器的肿瘤,不包括它处转移瘤[1]。软组织肿瘤约占成人实体肿瘤的1%,其中约15%~20%发生在腹膜后[2],其病理类型超过50种,不同的病理类型,其临床预后截然不同[3]。因其临床发病率低,手术难度大,风险高,国内外少有专业的腹膜后肿瘤中心,因此腹膜后肿瘤的大样本统计报道较少,本研究收集了北京大学国际医院腹膜后肿瘤中心、中国人民解放军总医院和首都医科大学附属北京世纪坛医院三家医院收治的687例腹膜后肿瘤患者资料,并进行了详细临床病理特征与诊治分析,以期对国内腹膜后肿瘤的诊治提供一些经验。
1 资料与方法 1.1 一般资料收集1975年9月—2014年12月,北京大学国际医院腹膜后肿瘤中心、中国人民解放军总医院和首都医科大学附属北京世纪坛医院三家医院收治的687例腹膜后肿瘤患者,其中男387例,女300例,男:女为1.29:1,平均年龄39.8岁(3~80岁)。本组687例腹膜后肿瘤患者入院前未曾手术者450例、外院手术探查未切除,来院要求手术者68例、复发病例共169例,其中第一、二、三、四、五、八、九次复发者分别为111、37、15、3、1、1、1例。患者的主要临床表现:腹痛、腹胀(404例)、腹部包块(375例)、下肢水肿、疼痛、麻木(112例)、腰痛(101例)、消瘦、乏力(78例)、食欲下降、恶心、呕吐、返酸(75例)、发热(51例)、大便困难(48例)、小便困难(31例)、直肠刺激征(21例)、体表破溃流脓(16例)、腹泻(4例)、呼吸困难(4例)、休克(2例);健康体检时发现(63例)。本组病例中,术前获得组织学诊断者242例。
1.2 病理资料687例患者中,良性肿瘤173例,交界性肿瘤44例,恶性肿瘤470例。原发性腹膜后恶性肿瘤中常见的为脂肪肉瘤、平滑肌肉瘤、恶性纤维组织细胞瘤分别占全部腹膜后肿瘤11.6%、8.7%、4.4%。良性肿瘤常见的为畸胎瘤,占全部肿瘤5%。687例患者中良性肿瘤占25.2%,交界性肿瘤占6.4%,恶性占68.4%。本研究中原发性肿瘤592例,占86.2%。继发性肿瘤95例,占13.8%,其病理类型复杂,临床上常难以确定原发病灶。
1.3 手术方式687例患者中,523例行手术治疗,164例未行手术治疗。手术患者中,肿瘤完整切除者382例,基本全切除者(切除95%以上)78例,大部切除(切除70%~95%)者12例,部分切除(切除50%~70%)者14例,未切除仅行活检者37例。术中173例行联合切口,主要包括“┤”形、“├”形、“┬”形、“┼”形切口等。未手术的主要原因包括:因术前肿瘤全身转移或患者恶病质状态,有手术禁忌症的64例,术前评估心、肝、肾、肺等功能不能耐受手术者49例,因手术风险大,术前谈话后,家属或患者本人放弃手术者50例。
1.4 统计学方法所有统计分析通过软件SPSS15.0来实现,数据比较采用卡方检验,风险因素评估采用Cox回归分析方法。P<0.05为差异有统计学意义。
2 结果 2.1 手术效果术中出血100~15 000 ml,平均1 616.0 ml,输血0~14 000 ml,平均1 427.9 ml。手术时间60~1 140min,平均309.5 min。在本研究中,肿瘤是否能够完整切除(包括基本切除)与肿瘤良恶性及是否行联合脏器切除有明显的相关性(其中我们根据随访结果,把随访期间未复发的交界性肿瘤归为良性,而复发的归为恶性),而与术前是否有症状及是否术前行栓塞治疗无关,见表 1。研究中132例患者行联合脏器切除,术中联合多脏器切除的概率高,以同时联合切除肾脏及结肠常见。包括远端胃切除者7例,十二指肠部分切除者10例,胰体尾切除者20例,小肠部分切除者51例,结、直肠部分切除者88例,单侧肾脏切除者73例,肾上腺切除者25例,输尿管部分切除者22例,膀胱切除者10例,脾脏切除者13例,子宫切除者5例,附件者15例,下腔静脉部分切除者20例。同时行血管移植者18例,其中腹主动脉移植2例、髂血管移植16例(动脉10例,静脉6例)。行联合脏器切除者132例,肿瘤均达到全切除,而未行联合脏器切除者391例中,仅有327例肿瘤完全切除。
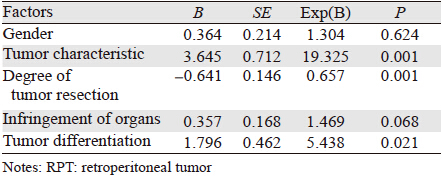
术后发生胃肠瘘9例,大出血8例,胰瘘5例,肠粘连及梗阻5例,腹腔感染及脓肿4例,深静脉血栓3例,一过性高血糖1例,消化道出血1例,胸腔积液肺不张1例;急性肾功能衰竭、泌尿系感染、尿瘘各1例;切口坏死、切口液化、切口疝、皮下积血积液、切口裂开各1例。术后复发行多次手术者169例,最多者手术达10次。平均复发时间为1.5年。以患者性别、年龄、病程、有无临床表现、肿块部位、肿瘤切除情况、肿瘤侵犯腹部脏器情况、病理类型等作为自变量,以复发及随访时间作为因变量进行多因素Cox回归分析,结果见表 2。从表 2中可以看出,肿瘤性质、肿瘤切除程度、肿瘤分化程度是原发性腹膜后肿瘤术后复发的影响因素(P<0.05)。肿瘤切除愈彻底,复发时间愈晚。
 |
687例患者中,良性肿瘤173例,其中纤维瘤3例,纤维平滑肌瘤1例,韧带样纤维瘤9例,硬纤维瘤9例,特发性腹膜后纤维化2例,脂肪瘤3例,平滑肌脂肪瘤1例,纤维血管脂肪瘤1例,平滑肌瘤10例,蔓状淋巴管瘤2例,淋巴管瘤8例,淋巴管肌瘤1例,血管淋巴管瘤2例,神经纤维瘤5例,良性神经鞘瘤34例,节细胞神经纤维瘤15例,化学感受器瘤4例,苗勒氏管囊肿1例,良性畸胎瘤34例,Castleman's病3例,良性嗜铬细胞瘤10例,后肾腺瘤1例,胰岛细胞瘤1例,单纯性囊肿11例,非特异性脂膜炎1例,结核1例;交界性肿瘤44例,其中炎性假瘤1例,纤维瘤病29例,肌纤维母细胞瘤1例,侵袭性纤维瘤3例,血管内皮细胞瘤1例,间皮瘤1例,骨巨细胞瘤1例,室管膜瘤1例,黏液瘤(分化不确定的肿瘤)2例,滑膜肉瘤(分化不确定的肿瘤)4例;恶性肿瘤470例,其中纤维肉瘤7例,恶性纤维组织细胞瘤30例,脂肪肉瘤80例,平滑肌肉瘤60,胃肠外恶性间质瘤8例,横纹肌肉瘤10例,血管肉瘤3例,恶性血管外皮瘤6例,恶性血管内外皮瘤1例,恶性间皮瘤18例,恶性神经鞘瘤29例,神经母细胞瘤29例,原始神经外胚层肿瘤/尤文氏瘤6例,恶性副神经节瘤20例,软骨肉瘤2例,骨肉瘤(成骨肉瘤)2例,恶性畸胎瘤12例,精原细胞瘤7例,生殖细胞瘤5例,绒毛膜上皮癌1例,内胚窦瘤1例,恶性淋巴瘤21例,恶性嗜铬细胞瘤2例,皮质癌6例,肾透明细胞癌1例,肾癌1例,肝癌1例,胰腺癌5例,前列腺癌1例,部位难确定肿瘤共计95例(包括恶性Brenner瘤1例,囊腺癌2例,腺癌4例,腺鳞癌1例,鳞癌1例,癌肉瘤1例,恶性肿瘤34例,转移性恶性肿瘤45,肉瘤6例)。
3 讨论腹膜后肿瘤发病率低,但其组织学类型繁多,分类复杂,加之生长部位深,并经常与腹膜后重要的脏器和血管紧密相邻,因此其临床表现、组织学类型、累及脏器、外科治疗均较复杂[4]。本研究发现腹膜后肿瘤患者一般特征为:男女比例(1.29:1)接近,发病年龄多在40~60岁(平均39.8岁),大部分肿瘤生长缓慢,部位深不易发现,病程长(平均25.1月),临床表现缺乏特异性,9.2%无症状及体征,仅在查体时发现。术中“不可切除”率高(10%),复发病例多,占总就诊者24.6%。
腹膜后肿瘤的病理诊断非常困难,组织来源众多,包括腹膜后间隙的脂肪、疏松的结缔组织、血管、神经、淋巴甚至胚胎残留组织等。可分为原发性腹膜后肿瘤和继发性腹膜后肿瘤,原发性腹膜后肿瘤大体分为三类:良性、交界性或低度恶性及恶性。良性肿瘤最常见的为畸胎瘤、神经鞘瘤、纤维瘤等,一般良性肿瘤诊断较容易。交界性或低度恶性肿瘤包括:纤维瘤病、胃肠道间质瘤等。原发性恶性肿瘤包括:各种亚型的肉瘤、恶性神经来源肿瘤、恶性嗜铬细胞瘤、恶性间质瘤等[2]。临床上出现难以分类的软组织恶性肿瘤时可以进行恶性分级,以便指导下一步治疗。继发性腹膜后肿瘤主要包括胰腺癌、肾细胞癌肾上腺皮质癌、结直肠癌、宫颈癌,及各种肉瘤转移癌等。有时寻找原发灶困难,可结合临床必要时行腹部CT及PET-CT检查[5]。从本研究的Cox分析可以看出肿瘤病理性质是腹膜后肿瘤的术后复发的主要影响因素。因此提高腹膜后肿瘤病理诊断的准确性,并进一步对腹膜后肿瘤进行更详细的分类是更进一步了解腹膜后肿瘤生物学特性的基础。
腹膜后肿瘤经常侵犯重要脏器,临床多见的为肾脏、肠道及腹膜后大血管包括下腔静脉、髂动静脉、肠系膜上动静脉,侵犯上述脏器时常常导致手术切除不够彻底,或无法手术。因此正确处理受累的脏器及血管,完整切除肿瘤是术后复发的影响因素[6]。腹膜后肿瘤手术困难,根据我们的经验总结出手术中的一些技巧供参考:(1)因腹膜后肿瘤病程长,发现晚,肿瘤一般巨大,因此术中需足够大的切口,位于盆底的肿瘤经常需要行腹骶联合切口才能将肿瘤完整切除,本组研究中33%的手术患者行联合切口:包括“┤”形、“├”形、“┬”形、“┼”形切口。(2)合理的手术入路,正确的手术解剖间隙,避免从肿瘤表面直接切开腹膜。如左肾脂肪囊来源的脂肪肉瘤,需将降结肠分离,向内侧牵拉,暴露出肿瘤,而不能直接将降结肠系膜切开。(3)由易向难策略。肿瘤切除过程中,肿瘤经常侵犯脏器,界限不清,因此当分离困难可寻找肿瘤其他边缘分离,我们称为“更换场景”,这样逐步分离,切除肿瘤。(4)分割切除策略:当肿瘤巨大,分离困难时,必要时可分割切除肿瘤,这样可降低出血及脏器损伤概率,但术中要保护好周围组织,减少肿瘤扩散。(5)肾静脉以下腔静脉慢性梗阻,切除不需重建。左肾静脉受侵犯,如靠近腔静脉切除,不需重建[6, 7, 8]。门静脉及肠系膜上静脉受侵,如切除5 cm以内,可行端端吻合,但血管阻断时间应在30~60 min以内。(6)出血的处理:积极抗休克,局部暂时压迫,保持镇静,勿盲目钳夹。瘤周大血管误伤时,用血管器械控制大血管,修补;供瘤血管破裂时,用钳夹,结扎或缝扎;骶前血管破裂时,暂时压迫止血,肿瘤切下后再彻底止血;瘤床出血时,用宫纱或纱垫填塞、压迫创面、缝合切口、结束手术,术后3天拔除宫纱。本研究中肿瘤完整切除73%,基本全切除14.9%,大部切除2.3%,部分切除2.7%,仅行活检者7.1%。 整体切除后局部复发率可控制在15%以下。从本研究的统计来看,RPT侵及周围大血管是影响肿瘤彻底切除的主要障碍,但非手术的禁忌。肿瘤的良恶性明显影响肿瘤的完整切除率,而术前有无临床症状及术前是否进行血管栓塞术并未影响肿瘤全切除率。因此通过提高腹膜后恶性肿瘤的完全切除率,尤其是完全切除,是降低腹膜后肿瘤术后复发主要措施[9]。
本研究中,Cox回归分析显示影响腹膜后肿瘤术后复发的因素主要有:肿瘤性质、肿瘤切除程度、肿瘤分化程度。但在临床上我们经常遇到一些腹膜后肿瘤的患者,首次手术,肿瘤完整切除,但术后仍在半年内复发,因此我们考虑肿瘤的生物学特性是其是否复发及复发时间的关键因素,要想从根本上控制腹膜后肿瘤除了提高肿瘤手术技术外还要进一步研究肿瘤的生物学特性[10, 11]。笔者初步研究了腹膜后脂肪肉瘤的单核苷酸多态性(SNP)发现了叶酰聚谷氨酸合酶FPGS基因与腹膜后脂肪肉瘤的发生有密切关系[12]。因此进一步研究肿瘤的生物学特性仍是我们从根本上控制肿瘤的出发点。
本研究未讨论患者生存率,因考虑到本研究中病理类型复杂,不同病理类型预后明显不同,且年龄、手术切除次数、术前术后等综合治疗、是否吸烟等混杂因素进行修正效验困难,因此我们将在后续研究中分病理类型进行生存率统计。
| [1] | Luo CH. Retroperutoneal Tumor[M]. Beijing: People’s Medical Publishing House, 2013: 1-3. [罗成华. 腹膜后肿瘤[M]. 北京: 人民卫生出版社, 2013: 1-3.] |
| [2] | Tseng WW, Madewell JE, Wei W, et al. Locoregional disease patterns in well-differentiated and dedifferentiated retroperitoneal liposarcoma: implications for the extent of resection?[J]. Ann Surg Oncol, 2014, 21(7): 2136-43. |
| [3] | Clark MA, Fisher C, Judson I, et al. Soft-tissue sarcomas in adults[J]. New Engl J Med, 2005, 353(7): 701-11. |
| [4] | Long ZW, XuY, Liu XW, et al. Clinical analnysis of 200 cases primary retroperitoneal tumors[J]. Zhongguo Shi Yong Wai Ke Za Zhi, 2013, 33(2): 127-29. [龙子雯, 徐宇, 刘晓文, 等. 原发性腹膜后肿瘤200例诊治分析[J]. 中国实用外科杂志, 2013, 33(2): 127-29.] |
| [5] | Chen CC, Guo XF, Yuan ZL, et al. The CT imaging characteristics of retroperitoneal non-functional paraganglioma[J]. Zhong Liu Fang Zhi Yan Jiu, 2014, 41(6): 667-8. [陈长春, 郭小芳, 袁子龙, 等. 腹膜后非功能性副神经-节瘤的CT影像学特点[J]. 肿瘤防治究, 2014, 41(6): 667-8.] |
| [6] | Jiang H, wang YX, Li B, et al. Surgical management of leiomysarcoma of the inferior vena cava[J]. Vascular, 2015, 23(3): 329-32. |
| [7] | Patschan D, Müller GA. Acute kidney injury[J]. J Inj Violence Res, 2015, 7(1): 19-26. |
| [8] | Liu Y, Sun Y, Jiang, et al. A novel strategy of vascular reconstruction after radical resection of an inferior vena cava leiomyosarcoma[J]. Ann Vasc Surg, 2013, 27(6): 803. |
| [9] | Li B, Luo CH, Zheng W. Risk factors for recurrence and survival in patients with primary retroperitoneal tumors[J]. J BUON, 2013, 18(3): 782-7. |
| [10] | Crago AM, Singer S. Clinical and molecular approaches to well differentiated and dedifferentiated liposarcoma[J]. Curr Opin Oncol, 2011, 23(4): 373-8. |
| [11] | Engstr?m K, Bergh P, Gustafson P, et al. Liposarcoma: outcome based on the Scandinavian Sarcoma Group register[J]. Cancer, 2008, 113(7): 1649-56. |
| [12] | Miao C, Liu D, Zhang F, et al. Association of FPGS genetic polymorphisms with primary retroperitoneal liposarcoma[J]. Sci Rep, 2015, 5: 9079. |
 2015, Vol. 42
2015, Vol. 42



