文章信息
- 吕民豪,秦丽,李军涛,郭旭辉,刘法文,崔树德,张恒伟. 2015.
- LV Minhao, QIN Li, LI Juntao, GUO Xuhui, LIU Fawen, CUI Shude , ZHANG Hengwei. 2015.
- 原发性乳腺癌分子分型与新辅助化疗疗效及预后的相关性
- Relationship of Molecular Subtypes with Responses and Outcome of Primary Breast Cancer Patients Treated with Neoadjuvant Chemotherapy
- 肿瘤防治研究, 2015, 42(08): 782-788
- Cancer Research on Prevention and Treatment, 2015, 42(08): 782-788
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.08.007
-
文章历史
- 收稿日期: 2014-09-09
- 修回日期: 2014-10-14
新辅助化疗(neoadjuvant chemotherapy,NAC)已成为局部晚期乳腺癌的标准治疗方案,同时在早期乳腺癌的应用也逐渐增多[1]。新辅助化疗的主要目的在于缩小肿瘤,降低临床分期,以期将不可手术患者转化为可手术或达到保乳手术,同时可评价肿瘤对化疗药物的敏感度并为术后辅助化疗提供指导[2]。相关研究报道,新辅助化疗后达到病理完全缓解(pCR)的患者预后明显优于未达到pCR的患者[3, 4]。在新辅助化疗前就对其是否能达到pCR做出预测,可以最大限度的增加新辅助化疗的疗效、降低其不良反应 [5]。乳腺癌是一种异质性非常明显的恶性肿瘤,具有相同临床病理特征的患者,往往表现为不同的生物学行为,对治疗的反应性及预后不同 [6]。分子分型的金标准是基因芯片技术,但研究发现用免疫组织化学指标代替基因芯片技术作为分子分型的基础是可行且经济的 [7, 8, 9, 10, 11]。关于乳腺癌不同分子分型对新辅助化疗敏感度及预后可能有所不同,已有相关的研究报道。本研究通过对本组病例进行分析,进一步探讨乳腺癌分子分型对新辅助化疗疗效及预后的预测价值,期望使乳腺癌的个体化治疗成为可能。
1 资料与方法 1.1 病例入选标准和排除标准选择河南省肿瘤医院乳腺外科2008年1月至 2010年1月初治乳腺癌患者204例进行回顾性分析,均为女性, 年龄 22~70岁, 中位年龄47岁。(1)女性,且至少接受了二周期的新辅助化疗。(2)新辅助化疗前行乳腺肿物14 G空心针穿刺活检,病理确诊为乳腺癌,且有足够的组织量行免疫组织化学检测(ER、PR、HER2、Ki67)。(3)心肺肝肾功能正常, 且无其他化疗禁忌证。(4)新辅助化疗前后,肿瘤大小的变化有完整准确的评价资料。(5)炎性乳腺癌及转移性乳腺癌患者排除在外,接受赫赛汀靶向治疗的患者排除在外。(6)完整的治疗及随访资料。
1.2 新辅助化疗方案及疗效评价采用FEC、TEC和TCb方案。其中FEC方案88例,TEC方案26例,TCb方案90例。FEC方案:5-氟尿嘧啶500 mg/m2、表柔比星80~100 mg/m2、环磷酰胺500 mg/m2;TEC方案:多西他赛75 mg/m2、表柔比星75~80 mg/m2、环磷酰胺500 mg/m2;TCb方案:多西他赛75 mg/m2、卡铂AUC=6。21天为一个化疗周期。雌激素受体阳性者口服他莫昔芬或芳香化酶抑制剂。其余治疗方案均按照NCCN指南进行。疗效按WHO制定的实体瘤评价标准(RECIST)分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)[12]。完全缓解又分为:临床完全缓解(cCR)和病理完全缓解(pCR)。cCR(clinical complete remission)定义为原发肿瘤及区域淋巴结的临床表现完全消失且持续至少1月;pCR(pathologic complete remission)定义为原发肿瘤及区域淋巴结均无浸润性癌残留,其中残留原位癌也包括在pCR 组。
1.3 检测方法及结果判定 1.3.1 免疫组织化学SP法检测ER、PR均为核染色,阳性细胞核≥1%为阳性,<1%为阴性;HER2 定位于细胞膜,没有染色或≤30%肿瘤细胞染色为阴性(-),>30%的肿瘤细胞有不完整细胞膜染色为弱阳性(+),>30%的肿瘤细胞有较弱但完整的细胞膜染色为阳性(++),>30%的肿瘤细胞有较强完整的细胞膜染色为强阳性(+++),本研究将免疫组织化学法结果为(-)和(+)者看作HER2 表达阴性,即HER2基因无扩增,(++)及(+++)者看作HER2 表达阳性,即 HER2基因扩增,需进一步行FISH检测。Ki67也是核染色,阳性细胞核≥14%为高表达,<14%为低表达。
1.3.2 FISH检测检测HER2基因的扩增水平。统计Ratio值(Ratio值=30个细胞核中红信号总数/绿信号总数)。Ratio<1.8 为阴性,提示HER2基因无扩增;Ratio>2.2为阳性,提示HER2基因扩增;Ratio在1.8~2.2时,选择增加计数细胞至100个,或重FISH 检测来判断最终结果。
1.3.3 分子分型以免疫组织化学法为基础将乳腺癌分为四个分子分型:Lu min al A型:ER和(或)PR阳性,HER2阴性,Ki67低表达(<14%)。Luminal B型:ER和(或)PR阳性,HER2阴性,Ki67高表达(≥14%);ER和(或)PR阳性,HER2阳性,Ki67在任何水平。HER2阳性:ER阴性,PR阴性,HER2阳性。三阴型:ER阴性,PR阴性,HER2阴性。
1.4 随访从第1次化疗首日开始计算,所有患者均随访至2014年1月,所有患者的随访信息均通过门诊随访或电话随访进行。复发指临床及组织学显示同侧乳腺或者区域淋巴结复发.远处转移指临床及影像学检查显示远处转移灶。无病生存期(DFS)指从第1次化疗首日开始至第1次复发或转移时间或末次随访时间,总生存(OS)时间指从第1次化疗当天开始至死亡或末次随访的时间。
1.5 统计学方法所得数据采用SPSS17.0统计学软件进行单因素卡方检验,乳腺癌分子亚型、临床及病理变量与疗效的关系用Logistic二元回归模型进行多因素分析。组间无病生存率和总生存率比较采用Kaplan-Meier生存分析和Long rank检验,P<0.05为差异有统计学意义。
2 结果 2.1 不同分子分型乳腺癌患者的临床病理特征204例患者均可评价疗效。其中,Luminal A型有40例(19.6%),Luminal B型有46例(22.5%),HER2阳性型有36例(17.6%),三阴乳腺癌亚型有82例(40.2%)。204例患者中,ER、PR和HER2的阳性率分别是39.2%、34.3%和23.5%。4组患者的年龄、肿瘤大小、淋巴结状况、临床分期等方面差异无统计学意义(P均>0.05),见表 1。
 |
单因素分析发现:分子分型,临床分期,ER状态可以预测pCR(P值分别为0.03、0.002和0.001)。Logistic二元回归模型进行多因素分析发现:月经状态,pre-N分期,分子分型和化疗方案可预测pCR(P值分别为0.032、0.015、0.002和0.010),见表 2。
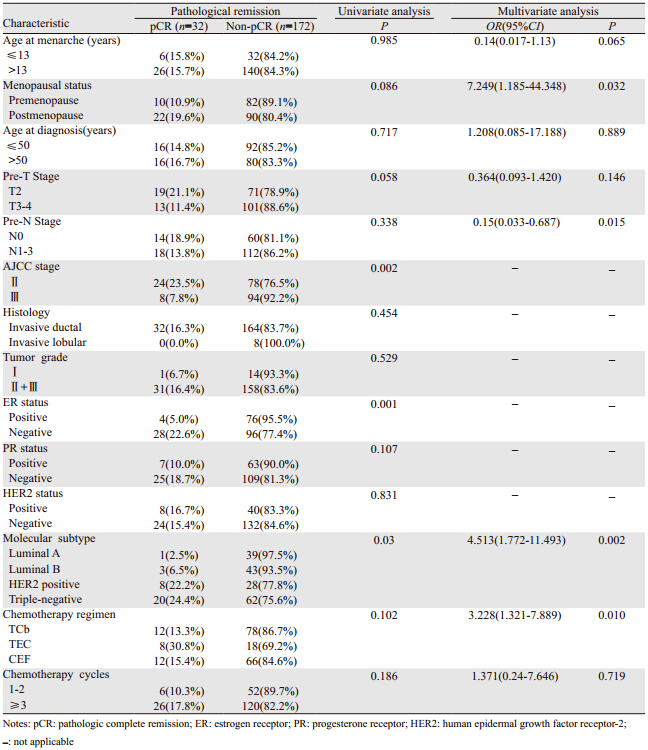 |
204例患者均可评价疗效,总pCR率为15.7%(32例)。Luminal A型、Luminal B型、HER2阳性和三阴乳腺癌亚型的p C R率分别为2 . 5 %(1/40)、6.5%(3/46)、22.2%(8/36)和24.4%(20/82);χ2 检验发现,乳腺癌不同的分子分型的pCR间差异有统计学意义(P=0.03),见表 2。相对于Luminal亚型,HER2阳性和三阴乳腺癌亚型具有更高的pCR率。
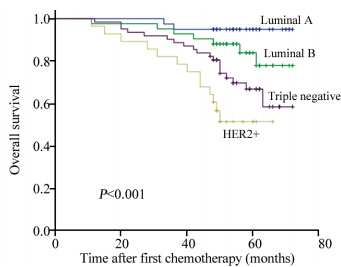
2.4 乳腺癌分子分型与预后的关系全组患者随访时间11~72月,中位随访时间54月。71例患者出现局部复发或远处转移,42例患者在复发或远处转移后死亡,29例患者复发或远处转移后仍存活。整个人群中,Luminal A型,Luminal B型,HER2阳性和三阴乳腺癌亚型的5年DFS率分别是84.4%、69.4%、44.0%和58.8%,差异有统计学意义(P=0.001),见图 1; Luminal A型,Luminal B型,HER2阳性和三阴乳腺癌亚型的5年OS率分别是95.0%、85.4%、62.4%和72.4%,差异亦有统计学意义(P=0.002) ,见图 2。获得pCR的患者5年的DFS和OS分别为90.1%及95.5%;明显优于化疗后未获得pCR的患者,其5年DFS和OS分别为59.0%及75.0%(P=0.002, P=0.012),见图 3~4。 在化疗后未获得pCR的患者中,Luminal A型、Luminal B型、HER2阳性和三阴乳腺癌亚型的5年DFS率分别是84.4%、66.4%、28.9%和49.8%,差异有统计学意义(P<0.001),见图 5;Luminal A型、Luminal B型、HER2阳性和三阴乳腺癌亚型的5年OS率分别是95.0%,83.9%,51.5%和66.8%,差异亦有统计学意义(P<0.001),见图 6。

|
| 图 1 乳腺癌患者中不同分子分型无病生存率的Kaplan-Meier分析 Figure 1 Kaplan-Meier analyses of DFS of breast cancer patients with different molecular subtypes |

|
| 图 2 乳腺癌患者中不同分子分型总生存率的Kaplan-Meier分析 Figure 2 Kaplan-Meier analyses of OS of breast cancer patients with different molecular subtypes |

|
| 图 3 获得病理完全缓解与非病理完全缓解患者无病生存率的Kaplan-Meier分析 Figure 3 Kaplan-Meier analyses of DFS of breast cancer patients that achieved pCR or not |

|
| 图 4 获得病理完全缓解与非病理完全缓解乳腺癌患者总生存率的Kaplan-meier分析 Figure 4 Kaplan-Meier analyses of OS of breast cancer patients that achieved pCR or not |

|
| 图 5 新辅助化疗后仍有癌残留的乳腺癌患者中不同分子分型无病生存率的Kaplan-Meier分析 Figure 5 Kaplan-Meier analyses of DFS of breast cancer patients that had residual disease after neoadjuvant chemotherapy with different molecular subtypes |
|
| 图 6 新辅助化疗后仍有癌残留的乳腺癌患者中不同分子分型总生存率的Kaplan-Meier分析 Figure 6 Kaplan-Meier analyses of OS of breast cancer patients that had residual disease after neoadjuvant chemotherapy with different molecular subtypes |
乳腺癌是一种异质性非常明显的恶性肿瘤,具有相同临床病理特征的患者,往往表现为不同的生物学行为,对治疗的反应性及预后不同。目前有不少研究已经发现,乳腺癌不同的分子分型对新辅助化疗敏感度有所不同[13, 14, 15]。但对中国中原地区女性乳腺癌患者,目前未见相关报道。在本研究中,与Luminal 乳腺癌相比,HER2阳性和三阴乳腺癌亚型具有更高的pCR率对新辅助化疗更敏感。
由于Luminal A型乳腺癌高表达激素受体且低表达Ki67,其对化疗不甚敏感,一些学者甚至认为Luminal A型可以只接受内分泌治疗并应该避免新辅助化疗[16, 17]。但是,我们在乳腺癌患者中应用新辅助化疗,并不是单纯为了达到pCR,通过新辅助化疗的降期作用,我们可以改变手术方式,增加保乳手术率。在本研究中,接受新辅助化疗的Luminal A型乳腺癌患者中,尽管pCR率只有2.5%,但是OR(cCR/cPR)率仍达到了75.0%,且有15.0%的患者符合保乳标准但可惜的是患者均拒绝了保乳手术。所以,我们的意见和一些报道[18, 19]相似,对于Luminal A型乳腺癌患者,若治疗前除了肿物大小其他条件均符合保乳手术标准,新辅助化疗仍不失为一种非常有效的治疗手段。
一些研究已经报道[20, 21],与Luminal 乳腺癌相比,HER2阳性和三阴乳腺癌亚型具有更差的预后。造成不同分子分型预后不同的原因可能为:自身的生物学差异,对系统治疗的抵抗,抑或两者都有。Carey等[11]研究发现,不同分子分型乳腺癌患者接受新辅助化疗,与Luminal亚型相比,三阴乳腺癌可以获得更高的pCR率,但反而获得更差的预后。本研究也发现了相似的现象,与Luminal A及Luminal B型相比,三阴乳腺癌及HER2阳性乳腺癌具有更差的预后;且这种差异性在没有获得pCR的患者中更明显。对于这种现象,可能的解释包括:(1)三阴乳腺癌缺乏内分泌治疗和分子靶向治疗,且恶性度较高,易复发、转移。(2)HER2阳性乳腺癌恶性度较高,且本研究中HER2阳性乳腺癌没有接受赫赛汀靶向治疗。(3)新辅助化疗后三阴乳腺癌和HER2阳性乳腺癌更容易获得pCR,但一旦没有获得pCR,三阴乳腺癌和HER2阳性乳腺癌更容易出现早期复发及转移。所以,对于新辅助化疗后未获得pCR的三阴及HER2阳性乳腺癌,可能需要更激进的干预来降低其复发及转移,提高其预后。
新辅助化疗后达到pCR的患者,不同分子分型的患者其预后均较好,在本研究5年随访时间内,几乎均无病生存。但对于Luminal亚型,尽管其pCR率较低但其预后较好,所以pCR率可能不是一个非常恰当的预测及评价指标。Symmans等[22]提出一个新的预后指标来代替pCR,肿瘤残留负荷RCB(residual cancer burden)是通过下列因素计算得到的:原发肿瘤直径、瘤床的细胞结构及腋窝淋巴结负荷;RCB是远处无复发生存率的显著预测因子,可以被用来更准确的评价新辅助化疗敏感度。
我们的研究存在一些局限性。首先,样本较少。其次,我们排除了接受赫赛汀治疗的HER2阳性乳腺癌患者,这样势必会降低其五年生存率。再次,样本中,三阴乳腺癌比例偏高,可能是局部晚期乳腺癌入组过多引起。
综上所述,我们的研究发现,以免疫组织化学(ER、PR、HER2和Ki67)为基础的分子分型可以预测中国中原地区女性乳腺癌患者新辅助化疗的敏感度及预后。相对于Luminal亚型,HER2阳性和三阴乳腺癌亚型具有更高的pCR率。新辅助化疗后达到pCR的患者,其预后较好。与Luminal亚型相比,HER2阳性和三阴乳腺癌亚型预后更差;这种预后差异在化疗后未达到pCR的群体中更为明显。三阴乳腺癌对内分泌治疗及赫赛汀治疗无效,化疗仍是主要治疗手段,因此寻找新的治疗靶点成为其个体化治疗及改善预后的关键。目前乳腺癌的分子分型还很不完善,尤其Luminal B的定义尚不十分明确。我们相信在不久的将来,在乳腺癌新辅助化疗中,分子分型将显示出巨大的优越性,为解决肿瘤的异质性、新辅助化疗方案的最优选择及预测预后提供合理的解释和探索。
| [1] | Miller E, Lee HJ, Lulla A, et al. Current treatment of early breast cancer: adjuvant and neoadjuvant therapy[J]. F1000Res, 2014, 3: 198. |
| [2] | Angelucci D, Tinari N, Grassadonia A, et al. Long-term outcome of neoadjuvant systemic therapy for locally advanced breast cancer in routine clinical practice[J]. J Cancer Res Clin Oncol, 2013, 139(2): 269-80. |
| [3] | Rastogi P, Anderson SJ, Bear HD, et al. Preoperative chemotherapy: updates of National Surgical Adjuvant Breast and Bowel Project Protocols B-18 and B-27[J]. J Clin Oncol, 2008, 26(5): 778-85. |
| [4] | van der Hage JA, van de Velde CJ, Julien JP, et al. Preoperative chemotherapy in primary operable breast cancer: results from the European Organization for Research and Treatment of Cancer trial 10902[J]. J Clin Oncol, 2001, 19(22): 4224-37. |
| [5] | Kim SI, Sohn J, Koo JS, et al. Molecular subtypes and tumor response to neoadjuvant chemotherapy in patients with locally advanced breast cancer[J]. Oncology, 2010, 79(5-6): 324-30. |
| [6] | Carey LA, Perou CM, Livasy CA, et al. Race, breast cancer subtypes, and survival in the Carolina Breast Cancer Study[J]. JAMA, 2006, 295(21): 2492-502. |
| [7] | Hugh J, Hanson J, Cheang MC, et al. Breast cancer subtypes and response to docetaxel in node-positive breast cancer: use of an immunohistochemical definition in the BCIRG 001 trial[J]. J Clin Oncol, 2009, 27(8): 1168-76. |
| [8] | Ortiz AP, Frías O, Pérez J, et al. Breast cancer molecular subtypes and survival in a hospital-based sample in Puerto Rico [J]. Cancer Med, 2013, 2(3): 343-50. |
| [9] | Cheang MC, Voduc D, Bajdik C, et al. Basal-like breast cancer defined by five biomarkers has superior prognostic value than triple-negative phenotype[J]. Clin Cancer Res, 2008, 14(5):1368-76. |
| [10] | Livasy CA, Karaca G, Nanda R, et al. Phenotypic evaluation of the basal-like subtype of invasive breast carcinoma[J]. Mod Pathol, 2006, 19(2): 264-71. |
| [11] | Carey LA, Dees EC, Sawyer L, et al. The triple negative paradox: primary tumor chemosensitivity of breast cancer subtypes[J]. Clin Cancer Res, 2007, 13(8): 2329-34. |
| [12] | James K, Eisenhauer E, Christian M, et al. Measuring response in solid tumors: unidimensional versus bidimensional measurement[J]. J Natl Cancer Inst, 1999, 91(6): 523-8. |
| [13] | Huober J, von Minckwitz G, Denkert C, et al. Effect of neoadjuvant anthracycline-taxane-based chemotherapy in different biological breast cancer phenotypes: overall results from the GeparTrio study[J]. Breast Cancer Res Treat, 2010, 124(1): 133-40. |
| [14] | Bhargava R, Beriwal S, Dabbs DJ, et al. Immunohistochemical surrogate markers of breast cancer molecular classes predicts response to neoadjuvant chemotherapy: A single institutional experience with 359 cases[J]. Cancer, 2010, 116(6): 1431-9. |
| [15] | Straver ME, Rutgers EJ, Rodenhuis S, et al. The relevance of breast cancer subtypes in the outcome of neoadjuvant chemotherapy[J]. Ann Surg Oncol, 2010, 17(9):2411-8. |
| [16] | Parker JS, Mullins M, Cheang MC, et al. Supervised risk predictor of breast cancer based on intrinsic subtypes[J]. J Clin Oncol, 2009, 27(8): 1160-7. |
| [17] | Rodenhuis S, Mandjes IA, Wesseling J, et al. A simple system for grading the response of breast cancer to neoadjuvant chemotherapy[J]. Ann Oncol, 2010, 21(3): 481-7. |
| [18] | Goldhirsch A , Wood WC, Coates AS, et al. Strategies for subtypes—dealing with the diversity of breast cancer: highlights of the St Gallen International Expert Consensus on the Primary therapy of Early Breast Cancer 2011[J]. Ann Oncol, 2011, 22(8): 1736–1747. |
| [19] | Straver ME, Rutgers EJ, Rodenhuis S, et al. The Relevance of breast Cancer subtypes in the outcome of neoadjuvant chemotherapy[J]. Ann Surg Oncol, 2010, 17(9): 2411-8. |
| [20] | Kümler I , Tuxen MK, Nielsen DL. A systematic review of dual targeting in HER2-positive breast cancer[J]. Cancer Treat Rev, 2014, 40(2): 259-70. |
| [21] | Prat A, Cruz C, Hoadley KA, et al. Molecular features of the basallike breast cancer subtype based on BRCA1 mutation status[J]. Breast Cancer Res Treat, 2014, 147(1): 185-91. |
| [22] | Symmans WF, Peintinger F, Hatzis C, et al. Measurement of residual breast cancer burden to predict survival after neoadjuvant chemotherapy[J]. J Clin Oncol, 2007, 25(28): 4414-22. |
 2015, Vol. 42
2015, Vol. 42