文章信息
- 张天,晁玮霞,赵云岗,王明,王广超,贺红梅,刘瑞敏,魏书堂,韩大正,朱晗,马瑾,谷娟,马远方,齐义军. 2015.
- ZHANG Tian, CHAO Weixia, ZHAO Yungang, WANG Ming, WANG Guangchao, HE Hongmei, LIU Ruimin, WEI Shutang, HAN Dazheng, ZHU Han, MA Jin, GU Juan, MA Yuanfang, QI Yijun. 2015.
- 支持向量机预测食管鳞癌患者术后生存期
- Support Vector Machine Predicts Survival of Esophageal Squamous Cell Carcinoma Patients
- 肿瘤防治研究, 2015, 42(08): 765-771
- Cancer Research on Prevention and Treatment, 2015, 42(08): 765-771
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.08.004
-
文章历史
- 收稿日期: 2014-08-04
- 修回日期: 2014-12-29
2. 475004 开封,河南大学医学院预防医学教研室;
3. 475004 开封,河南大学第一附属医院消化内科
2. Department of Preventive Medicine, He'nan University, Kaifeng 475004, China;
3. Department of Digestive Medicine, The First Affiliated Hospital of He'nan University, Kaifeng 475000, China
中国食管癌(esophageal cancer,EC)的发病率和死亡率位居全球前列,在2008年全球新增的482 000个EC患者中[1],约有一半发生在中国[2]。中国EC的组织学类型主要为食管鳞状细胞癌(esophagealsquamous cell carcinoma,ESCC),约占所有EC的90%[3]。中国食管鳞癌发病率差异很大,高发区与低发区比值高达500:1[4]。目前,外科手术切除联合新辅助放疗和(或)化疗是根治食管癌的首选及最有效的治疗手段[5, 6]。近20年来,尽管EC的临床治疗手段不断改善,但预后仍很差,5年整体生存率为15%~34%[7]。
EC具有异质性,其发生发展是一个多病因、多步骤、涉及多分子的复杂动态演变过程,而传统的TNM分期并不能完全代表EC的分子生物学特性。因此,临床上经常发现TNM分期与预后不一致的现象;接受相同治疗手段的同一TNM分期的ESCC患者,其预后可能完全不同,表明单纯TNM分期系统判断ESCC预后具有一定的局限性。因此,亟需建立ESCC术后复发风险及长期生存的客观评估体系,为选择治疗方法、判断预后、疗效评估、避免过度治疗等提供依据;此外,还有助于揭示食管癌预后的分子基础,并为食管癌生物防治提供新思路。
本研究应用支持向量机(support vector machine,SVM)算法分析168例ESCC患者的临床病理特征及14-3-3σ、热休克蛋白gp96和巨噬细胞移动抑制因子(macrophage migration inhibition factor,MIF)蛋白的表达特征,建立ESCC术后生存期的SVM预测模型。
1 资料和方法 1.1 研究对象168例ESCC包括:河南大学淮河医院进行手术治疗的82例ESCC和上海芯超生物科技有限公司ESCC组织芯片共86例ESCC。ESCC随访患者的纳入标准包括:2003—2008年间接受根治性手术且术前无放化疗治疗,临床病理资料完整,组织病理学确诊为鳞状细胞癌,存档固定蜡块组织可进行免疫组织化学(immunohistochemistry,IHC)分析。
1.2 ESCC患者随访于2012—2013年间对上述ESCC患者进行回顾性随访,查阅病案、入户或电话随访确定患者生存状态,或确定死亡原因及时间。ESCC患者的生存时间为手术日期至患者死亡、失访或最后一次随访日期,失访、至最后一次随访时间仍生存患者或非食管癌相关病因死亡患者为截尾数据,死亡原因为食管癌相关疾病的患者为完全数据。168例ESCC患者包括125例男性和43例女性,平均年龄(67.0±5.3)岁(年龄范围51~80岁),平均随访时间为(42.3±9.8)月(时间范围1~60月)。
1.3 免疫组织化学方法检测ESCC中14-3-3σ、gp96和MIF蛋白表达免疫组织化学方法参考以前方法进行。鼠单抗14-3-3σ抗体(1:200,sc-100638)、山羊多抗gp96抗体(1:200,sc-1794)和兔多抗MIF抗体(1:100,sc-20121)均购自美国Santa Cruz公司。ABC(PK-4001)试剂盒购自美国Vector Laboratories,二氨基联苯胺(DAB,ZLI-9032)底物试剂盒购自北京中杉生物技术有限公司。IHC结果半定量分析:染色强度分为3级(无染色为0,弱阳性为1,中度阳性为2,强阳性为3),免疫阳性细胞百分数分为4级(阳性细胞数< 10%为0,10%~25%为1,>25%~50%为2,>50%~75%为3,>75%~100%为4),最终综合评分为染色强度和免疫阳性细胞数评分之积(0~12分)。免疫评分≤6为低表达,>7为高表达。
1.4 支持向量机算法支持向量机算法是基于统计学习理论的一种分类器,它在有限样本特别是小样本的情况下表现出特殊的优势[8]。本研究采用径向基函数(radial basis function,RBF)作为支持向量机的核函数,基于贪婪选择的网格寻优方法确定最优的惩罚参数c和松弛变量g。对8例资料不完整的ESCC患者,采用k-近邻法填充缺失值。应用Matlab软件进行SVM运算,将168例ESCC随机分为128例训练组和40例测试组,将训练组128例ESCC所有属性进行各种组合建立最优ESCC预后分类模型(ESCC-SVM),用测试组40例ESCC检验该ESCC-SVM预测高、低死亡风险ESCC患者术后生存期的准确性,该随机分组共进行3次。
1.5 统计学方法所有统计学分析采用SPSS16.0 软件分析。Kaplan-Meier法绘制生存曲线,各组间的比较采用Log rank检验,Cox回归模型分析ESCC预后影响因素。组间差异分析采用卡方检验或Fisher精确检验。受试者工作特征(receiver operating characteristic,ROC)曲线确定ESCC各属性及ESCC-SVM预测模型的分类效能。P < 0.05为差异有统计学意义。
2 结果 2.1 14-3-3σ、gp96、MIF蛋白表达及临床病理特征与ESCC患者术后生存期的相关性Kaplan-Meier生存分析表明:168例ESCC患者的整体平均生存时间为31.0月,五年整体生存率为30.3%,见图 1A,女性ESCC患者(43例,59.0月)的平均生存时间长于男性(125例,26.6月),其五年整体生存率分别是58.1%、17.8%(χ2=9.157,P=0.002),见图 1B;T1~2期ESCC患者(128例,35.9月)平均生存时间长于T3~4期ESCC(40例,13.0月),其五年整体生存率分别为31.3%、16.4%( χ2=10.738,P=0.001),见图 1C;未发生淋巴结转移ESCC患者(101例,43.8月)平均生存时间长于淋巴结转移ESCC患者(67例,16.3月),其五年生存率分别是39.8%、14.2%(χ2=19.180,P=0.000),见图 1D;TNMⅠ~Ⅱ期ESCC患者(109例,44.3月)平均生存时间长于TNMⅢ~Ⅳ期ESCC(59例,15.6月),其五年整体生存率分别为40.6%、8.1%( χ2= 27.745,P=0.000),见图 1E;14-3-3σ高表达ESCC患者(44例,44.6月)的术后平均生存时间长于低表达或完全失表达的ESCC患者(124例,24.5月),14-3-3σ高表达及低表达ESCC患者的5年整体生存率分别为43.5%、25.6%(χ2=8.448,P=0.004),见图 1F;年龄、分化程度、gp96、MIF对ESCC患者术后生存期的影响无统计学意义。

|
| A: The 5-year overall survival rate of 168 ESCC patients was 30.3%; B: The 5-year overall survival rates of ESCC patients for female (n=43) and male (n=125) were 58.1% and 17.8%,respectively(P=0.002); C: The 5-year overall survival rates of ESCC patients with T1-2(n=40) and T3-4(n=128) stage were 16.4% and 31.3%,respectively(P= 0.001); D: The 5-year overall survival rates of ESCC patients with(n=67) and without(n=101) lymph node metastasis were 14.2% and 39.8%,respectively(P=0.000); E: The 5-year overall survival rates of ESCC patients with TNMⅠ-Ⅱ(n=109) and TNM Ⅲ-Ⅳ(n=59) stage were 40.6% and 8.1%,respectively(P=0.000); F: The 5-year overall survival rates of ESCC patients with low (n=124) and high (n=44) 14-3-3σ were 25.62% and 43.47%,respectively(P=0.004) 图 1 食管鳞状细胞癌患者Kaplan-meier生存曲线 Figure 1 Kaplan-meier survival curves of esophageal squamous cell carcinoma(ESCC) patients |
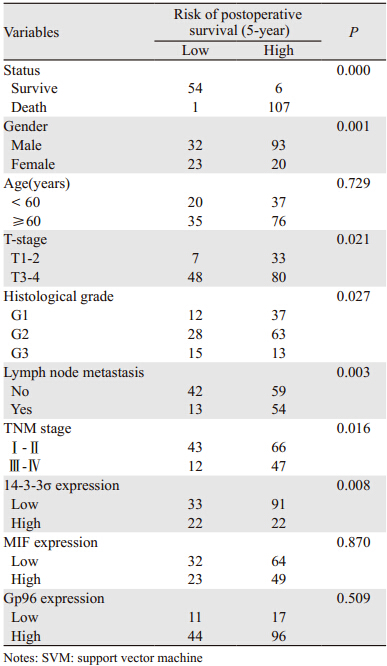
比较分析训练组和测试组ESCC临床病理资料、14-3-3σ、MIF和gp96等属性的分布,两组各属性间差异无统计学意义(P>0.05),见表 1。通过贪婪选择网格寻优的方式确定最佳参数值及最优指标数目,应用128例训练组ESCC建立的ESCC预后SVM分类模型(ESCC-SVM)的最优属性包含性别、T分期、分化程度、淋巴结转移、TNM分期、14-3-3σ和gp96。应用该ESCC-SVM分析测试组40例ESCC的死亡风险,整体生存时间大于5年和小于5年的ESCC患者分别是13例、27例。ROC曲线分析ESCC-SVM及其他预后相关因子区分高低风险ESCC的效能,分别显示了各预后因子区分训练组和测试组中高、低死亡风险ESCC的ROC曲线下面积(AUC),见图 2A~B。ESCC-SVM预测的ESCC生存期的效能明显优于其他各因子,其在训练组和测试组中的AUC分别为0.96、0.86。Kaplan-Meier生存分析表明:在训练组和测试组ESCC中,该ESCC-SVM预测的高、低风险组的5年总体生存率分别是1.4% vs. 100% ( χ2= 98.46,P=0.000)、3.6% vs. 96.7%(χ2=116.411,P=0.000),见图 2C~D。对该ESCC-SVM预测的五年死亡高低风险ESCC患者和各变量进行卡方检验或Fisher精确检验分析,表明该ESCC-SVM与性别、T分期、分化程度、淋巴结转移、TNM分期和14-3-3σ均显著相关,见表 2。为进一步确定该ESCC-SVM预测效能,又进行了另两次独立的随机分组测试,发现该SVM模型预测ESCC预后的准确率分别为85.2%、88.4%。
 |

|
| A,B: ROC curves showed the prediction performance of gender,age,T-stage,histological grade,lymph node metastasis,TNM stage,14-3-3σ,MIF, gp96 and ESCC-SVM on 5-year survival of ESCC patients in training(A) and validation(B) groups; C,D: The 5-year overall survival curves of ESCC patients with predicted low and high survival risk in training (n=128,C) and validation (n=40,D) groups 图 2 训练组(A,C)和测试组(B,D)食管鳞状细胞癌患者ROC和Kaplan-Meier生存曲线 Figure 2 ROC and Kaplan-Meier survival curves of ESCC patients in both training(A,C) and validation (B,D) groups |
 |
应用Cox单因素比例风险回归模型分析14-3-3σ、gp96、MIF及临床病理属性对ESCC术后生存期的影响,发现性别、T分期、淋巴结转移、TNM分期、14-3-3σ是影响ESCC预后的重要因素(P < 0.05),见表 3。
 |
Cox多因素比例风险回归模型的分析表明:在不包含ESCC-SVM模型一中,T分期、TNM分期、14-3-3σ是ESCC生存期的独立影响因素(P<0.05);在ESCC-SVM作为协变量一同进入模型二,年龄、T分期、gp96及ESCC-SVM是影响ESCC预后的关键因素(P<0.05),见表 4。
 |
EC预后的影响因素包括TNM分期、肿瘤的完整切除率、受累淋巴结数目、肿瘤浸润深度及分化程度等,但这些EC预后因素并不能客观地反映肿瘤多阶段演进过程中的生物学多样性,导致目前临床上常用的TNM分期在预测ESCC患者预后中具有一定的主观和客观局限性,亟需建立新的预后预测模型,为ESCC的临床治疗提供理论依据。此外,仅50%的肿瘤患者对目前临床上常用的放化疗敏感[9],因此,术后低复发、低死亡风险的肿瘤患者应尽量避免过度治疗,尤其是避免放化疗的不良反应,达到经济、有效的治疗效果;术后高复发、高死亡风险的肿瘤患者手术后,可接受高剂量的放化疗、生物治疗等多学科综合治疗。
EC的发生发展过程中涉及到许多分子异常变化,因此,单纯形态学改变或单个异常分子很难准确预测EC患者预后。SVM是近年来发展迅速的一种智能计算方法,通过机器学习,摒除人为干扰,把复杂的分类问题转化为在高维空间的线性可分问题,可以解决非线性分类问题[8];SVM分类预测的准确性优于其他分类模型,如人工神经网络、决策树等[10, 11]。本研究应用SVM算法分析了168例接受根治性手术治疗ESCC患者的临床病理属性和14-3-3σ、gp96、MIF等蛋白表达特征,建立了包含性别、T分期、分化程度、淋巴结转移、TNM分期、14-3-3σ和gp96等最优属性组成的ESCC术后生存期预测模型ESCC-SVM。该ESCC-SVM预测训练组和测试组ESCC五年整体生存率的准确率分别为97.7%、90.0%,明显优于目前临床应用的TNM分期(分别为62.5%、67.5%)及其他各临床病理属性。此外,该ESCC-SVM、年龄、T分期、gp96是影响ESCC预后的独立因素,并且该ESCC-SVM(P=0.000)与生存期的相关性较其他各相关预后因子更显著。剔除协变量ESCC-SVM的Cox多因素分析表明gp96不再是影响ESCC生存期的独立影响因素,仅T分期、TNM分期、14-3-3σ是ESCC生存期的独立影响因素。该结果表明由7个属性组成的ESCC-SVM与14-3-3σ和gp96存在相互关联,T分期和ESCC-SVM更能预测ESCC术后的生存期。比较各临床病理属性及ESCC-SVM的ROC曲线,发现ESCC-SVM的预测ESCC术后死亡风险的准确性最优,进一步表明该ESCC-SVM是术后ESCC预后因子的综合体现,更能全面地反映ESCC的生物学特性和临床特征,是理想的ESCC预后预测模型。然而,本研究涉及的ESCC病例较少,最长随访时间仅有五年,能够反映ESCC生物学特性的分子标志物也较少,限制了ESCC-SVM的最优属性构成及预测效能,进一步的研究尚需扩大样本数及筛查更多的预后相关分子标志物,验证本研究建立的或建立新的ESCC-SVM模型。
14-3-3蛋白是一族高度保守的酸性蛋白,普遍表达于所有真核生物。在哺乳动物中表达的14-3-3家族蛋白包括α/β、γ、ε、σ、ζ、τ/θ和η,参与蛋白转运、细胞周期、细胞增殖分化、细胞衰老、细胞凋亡、DNA修复等多种生物学过程。在上述7个成员中,14-3-3σ特异表达于上皮细胞,与肿瘤的演进过程更密切[11, 12, 13]。由于14-3-3σ在细胞周期中的负调控作用、诱导p53蛋白表达及p53蛋白对14-3-3σ正反馈调节,多认为14-3-3σ是一候选肿瘤抑制基因,并且14-3-3σ低表达发生于多种肿瘤[14]。然而,亦有研究报道14-3-3σ高表达于胰腺癌、结直肠癌、肺癌、ESCC等,并与肿瘤患者预后呈正相关[15, 16, 17, 18, 19]。与本研究结果类似,中国学者已报道了14-3-3σ低表达ESCC患者的5年总生存率明显低于高表达患者[20],而日本的一项研究表明细胞核内高表达14-3-3σ是ESCC患者预后不良的显著独立因子[19]。14-3-3σ在不同组织起源的肿瘤,甚至不同地区的相同组织学类型的肿瘤中表达的不一致性,提示14-3-3σ表达可能与肿瘤类型、标本来源有关。
Gp96(又称作grp94或Endoplasmin)属于热休克蛋白90(HSP90)家族,是内质网中丰度最高的分子伴侣蛋白之一。Gp96高表达见于多种肿瘤,如肝癌、胃癌、结肠癌、食管癌、肺癌、口腔癌等,并与肿瘤患者的预后显著相关[21, 22, 23, 24, 25, 26, 27, 28, 29]。本研究发现ESCC组织中gp96表达显著高于癌旁组织,但与ESCC术后生存期不显著相关。尽管如此,本研究建立的由七属性组成的ESCC-SVM包括gp96和14-3-3σ,并且其预测效能优于各预后相关因子的单独预测效能。
总之,本研究建立了由性别、T分期、分化程度、淋巴结转移、TNM分期、14-3-3σ和gp96等最优属性组成的术后ESCC生存风险的ESCC-SVM预警模型,优于TNM分期的预后评估体系,为高死亡风险的ESCC进行多学科的综合治疗和个体化治疗奠定理论基础。
| [1] | Ferlay J, Shin H R, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12): 2893-917. |
| [2] | Holmes RS, Vaughan TL. Epidemiology and pathogenesis of esophageal cancer[J]. Semin Radiat Oncol, 2007, 17(1): 2-9. |
| [3] | Jemal A, Bray F, Center M M, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90. |
| [4] | Liu LH, Meng J, Zhang C, et al. Serum protein fingerprint diagnoic patterns was estaslished by MALDI-TOF MS for human esophagial carcinoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2012, 39(2): 169-72. [刘丽华, 孟君, 张璁, 等. 运用MALDI-TOF MS方法建立食管癌患者血清蛋白指纹图谱诊断模型[J]. 肿瘤防治研究, 2012, 39(2): 169-72.] |
| [5] | Pennathur A, Luketich J D. Resection for esophageal cancer: strategies for optimal management[J]. Ann Thorac Surg, 2008, 85(2): S751-6. |
| [6] | Lin Y, Chen JQ, Li JC, et al. Value of postoperative radiochemotherapy for thoracic esophageal squamous cell carcinoma with lymph node metastasis[J]. Zhonghua Zhong Liu Za Zhi, 2014, 36(2): 151-4. [林宇, 陈俊强, 李建成, 等. 淋巴结阳性胸段食管鳞癌术后放化疗的价值[J]. 中华肿瘤杂志, 2014, 36(2): 151-4.] |
| [7] | Allum WH, Stenning SP, Bancewicz J, et al. Long-term results of a randomized trial of surgery with or without preoperative chemotherapy in esophageal cancer[J]. J Clin Oncol, 2009, 27(30): 5062-7. |
| [8] | Spinosa EJ, Carvalho AC. Support vector machines for novel class detection in bioinformatics[J]. Genet Mol Res, 2005, 4(3): 608-15. |
| [9] | Pennathur A, Gibson MK, Jobe BA, et al. Oesophageal carcinoma[J]. Lancet, 2013, 381(9864): 400-12. |
| [10] | Wang H, Huang G. Application of support vector machine in cancer diagnosis[J]. Med Oncol, 2010, 28(Suppl1): s613-8. |
| [11] | Wang SJ, Zhang LW, Yu WF, et al. Establishment of a diagnostic model of serum protein fingerprint pattern for esophageal cancer screening in high incidence area and its clinical value [J]. Zhonghua Zhong Liu Za Zhi 2007, 29(2): 441-3. [王士杰, 张立玮, 于卫芳, 等. 高发区筛查人群食管鳞癌血清蛋白指纹图谱诊断模型的建立及临床价值[J]. 中华肿瘤杂志, 2007, 29(6): 441-3.] |
| [12] | Hermeking H. The 14-3-3 cancer connection[J]. Nat Rev Cancer, 2003, 3(12): 931-43. |
| [13] | Dougherty MK, Morrison DK. Unlocking the code of 14-3-3[J]. J Cell Sci, 2004, 117(10): 1875-84. |
| [14] | Mackintosh C. Dynamic interactions between 14-3-3 proteins and phosphoproteins regulate diverse cellular processes[J]. Biochem J, 2004, 381(2): 329-42. |
| [15] | Freeman AK, Morrison DK. 14-3-3 Proteins: diverse functions in cell proliferation and cancer progression[J]. Semin Cell Dev Biol, 2011, 22(7): 681-7. |
| [16] | Iacobuzio-Donahue CA, Ashfaq R, Maitra A, et al. Highly expressed genes in pancreatic ductal adenocarcinomas: a comprehensive characterization and comparison of the transcription profiles obtained from three major technologies[J]. Cancer Res, 2003, 63(24): 8614-22. |
| [17] | Perathoner A, Pirkebner D, Brandacher G, et al. 14-3-3sigma expression is an independent prognostic parameter for poor survival in colorectal carcinoma patients[J]. Clin Cancer Res, 2005, 11(9): 3274-9. |
| [18] | Shiba-Ishii A, Noguchi M. Aberrant stratifin overexpression is regulated by tumor-associated CpG demethylation in lung adenocarcinoma[J]. Am J Pathol, 2012, 180(4): 1653-62. |
| [19] | Shiba-Ishii A, Kano J, Morishita Y, et al. High expression of stratifin is a universal abnormality during the course of malignant progression of early-stage lung adenocarcinoma[J]. Int J Cancer, 2011, 129(10): 2445-53. |
| [20] | Okumura H, Kita Y, Yokomakura N, et al. Nuclear expression of 14-3-3 sigma is related to prognosis in patients with esophageal squamous cell carcinoma[J]. Anticancer Res, 2010, 30(12): 5175-9. |
| [21] | Ren HZ, Pan GQ, Wang JS, et al. Reduced stratifin expression can serve as an independent prognostic factor for poor survival in patients with esophageal squamous cell carcinoma[J]. Dig Dis Sci, 2010, 55(9): 2552-60. |
| [22] | Wang X P, Wang Q X, Lin H P, et al. Significance of clinicopathology and expression of heat shock protein 72 and glycoprotein 96 in human hepatocellular carcinoma[J]. Afr J Microbiol Res, 2011, 5(31): 5607-14. |
| [23] | Wang XP, Wang QX, Ying XP, et al. Correlation between clinicopathology and expression of heat shock protein 72 and glycoprotein 96 in human gastric adenocarcinoma[J]. Tohoku J Exp Med, 2007, 212(1): 35-41. |
| [24] | Zheng HC, Takahashi H, Li XH, et al. Overexpression of GRP78 and GRP94 are markers for aggressive hehavior and poor progonosis in gastric carcinoma[J]. Hum Pathol, 2008, 39(7): 1042-9. |
| [25] | Wang XP, Wang QX, Guo LS, et al. Immunolocalization of heat shock protein 72 and glycoprotein 96 in colonic adenocarcinoma[J]. Acta Histochem, 2008, 110(2): 117-23. |
| [26] | Wang X, Wang Q, Lin H. Correlation between clinicopathology and expression of heat shock protein 72 and glycoprotein 96 in human esophageal squamous cell carcinoma[J]. Clin Dev Immunol, 2010, 2010: 212537. |
| [27] | Wang XP, Liu GZ, Song AL, et al. Expression and significance of heat shock protein 70 and glucose-regulated protein 94 in human esophageal cancer[J]. World J Gastroenterol, 2005, 11(3): 429-32. |
| [28] | Wang Q, An L, Chen Y, et al. Expression of endoplasmic reticulum molecular chaperon GRP94 in human lung cancer tissues and its clinical significance[J]. Chin Med J (Engl), 2002, 115(11): 1615-9. |
| [29] | Lin CY, Lin TY, Wang HM, et al. GP96 is over-expressed in oral cavity cancer and is a poor prognostic indicator for patients rece iving radiotherapy[J]. Radiat Oncol, 2011, 6:136. |
 2015, Vol. 42
2015, Vol. 42


