文章信息
- 胡丽丽,尹燕军,钟文娟,邱峰. 2015.
- HU Lili, YIN Yanjun, ZHONG Wenjuan, QIU Feng. 2015.
- miR-200c增强肺癌A549细胞对紫杉醇及吉非替尼的敏感度及相关机制
- miR-200c Enhances Sensitivity of Lung Cancer Cell A549 to Paclitaxel and Gefitinib and Related Mechanism
- 肿瘤防治研究, 2015, 42(08): 760-764
- Cancer Research on Prevention and Treatment, 2015, 42(08): 760-764
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.08.003
-
文章历史
- 收稿日期: 2014-10-14
- 修回日期: 2015-01-28
以表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinaseinhibitor,EGFR-TKI)为主的靶向治疗能显著提高晚期非小细胞肺癌(non small cell lung cancer,NSCLC)疗效,其中代表性的药物吉非替尼通过抑制表皮生长因子受体(epidermal growth factorreceptor,EGFR)自身及底物磷酸化,阻断下游的主要信号转导通路,如PI3K-Akt、Ras-Raf-MAPK通路,抑制肿瘤细胞增殖、促进细胞凋亡、抑制血管生成,但耐药问题使得该类药物的应用也受到一定限制,因此研究如何增强肿瘤细胞对抗肿瘤药物的敏感度具有重要的临床意义。miR-200c在大多数恶性肿瘤中表达水平明显降低,多项研究已证实miR-200c可通过靶向作用于转录因子锌指E-盒结合同源异形盒(zinc-finger E-boxhomeobox 1,ZEB1)和ZEB2来上调上皮钙黏蛋白的表达,从而抑制上皮间质转化的发生,阻止肿瘤细胞迁移、侵袭[1, 2]。miR-200c还与多种抗肿瘤药物的耐药相关,恢复其表达可增加药物的敏感度甚至逆转耐药。本研究通过上调肺癌A549细胞中miR-200c表达,观察A549细胞对紫杉醇、吉非替尼及两药联合敏感度的影响,探讨两药联合是否比单药更有效及其可能作用机制。
1 材料与方法 1.1 实验材料 1.1.1 主要试剂紫杉醇(10 mg/片)购自阿拉丁试剂公司,吉非替尼(250 mg/片)由阿斯利康公司馈赠,MTT(250 mg)购自Amresco公司,RPMI1640培养液、胎牛血清、胰酶为北京全式金生物有限公司产品,Lipofectamine 2000购自美国Invitrogen公司,miR-200c mimic和mimic NegativeControl、miR-200c和U6引物购自广州锐博生物科技有限公司,Real-time PCR试剂盒购自TaKaRa公司,细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司,兔抗人TUBB3、p-EGFR、EGFR、p-Akt、Akt、p-MAPK、MAPK单抗均购自CST公司,山羊抗兔的二抗购自北京中杉金桥生物技术有限公司。
1.1.2 细胞人肺癌A549细胞购于中国科学院细胞生物学研究所。常规培养于含10%胎牛血清的RPMI1640培养液中,置于5%CO2、37℃培养箱内,待细胞密度为80%~90%时胰酶消化传代,传代3~5代后用于后续的转染实验。
1.2 实验方法 1.2.1 细胞转染取对数生长期A549细胞以2×105个/孔接种于6 cm培养皿,24 h后细胞长至30%~40%融合,按Lipofectamine 2000说明书进行转染,分别转染miR-200c mimic(转染组)和mimic Negative Control(阴性对照组),并设立空白对照组,培养4 h后换液,48 h后收集细胞提取总RNA。
1.2.2 Real-time PCR检测miR-200c表达收集转染后各组细胞,用TRIzol提取总RNA,按试剂盒说明书反转录合成cDNA并行PCR反应,反应条件为95℃ 20 s,95℃ 10 s,60℃ 20 s,70℃ 10 s,共40个循环。miR-200c表达量用2-ΔΔCT表示。miR-200c反转录引物:5’-GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAATTGCACTGGATACGACTCCATC-3’,PCR上游引物:5’-GGTAATACTGCCGGGTAAT-3’,下游引物:5’-CAGTGCGTGTCGTGGAGT-3’。
1.2.3 MTT检测药物敏感度取对数生长期A549细胞,5×103个/孔接种于96孔板,培养24 h按1.2.1方法转染。转染24 h后转染组和阴性对照组分别加入终浓度为2、4、8、16 nmol/L紫杉醇单药(miR-200c-T组和Control-T组),5、10、20、40 μmol/L吉非替尼单药(miR-200c-G和Control-G组)以及紫杉醇单药联合吉非替尼单药(miR-200c-G+T组和Control-G+T组),设不加药物的空白对照,继续培养48 h各孔加入20 μl MTT,4 h后加入150 μlDMSO,孵育30 min,用酶标仪测定490 nm吸光值。计算细胞增殖抑制率和紫杉醇、吉非替尼的半数抑制浓度(IC50)。
1.2.4 流式细胞仪检测细胞凋亡根据MTT结果选择紫杉醇浓度为10 nmol/L、吉非替尼20 μmol/L进行后续实验。取对数生长期A549细胞,2×105个/孔接种于6孔板,培养24 h按1.2.1方法转染。转染24 h后转染组和阴性对照组分别加入紫杉醇、吉非替尼单药、两药联合,设不加药物的空白对照组(miR-200c组和Control组)。培养48 h收集各组细胞,按AnnexinV-FITC试剂盒说明书操作,检测细胞凋亡率。
1.2.5 Western blot检测TUBB3蛋白、EGFR、 Akt、MAPK磷酸化蛋白及总蛋白的表达取对数生长期A549细胞以2×105个/孔接种于6 cm培养皿,培养24 h按1.2.1方法转染。转染24 h后转染组和阴性对照组分别加入紫杉醇、吉非替尼单药、紫杉醇+吉非替尼两药联合,设空白对照组,继续培养48 h按总蛋白提取试剂盒说明书提取各组细胞的蛋白,蛋白定量后行SDS-PAGE凝胶电泳,转膜,封闭,p-Akt、p-MAPK一抗(1:1000),EGFR、p-EGFR、Akt、MAPK、TUBB3一抗(1:500)4℃孵育过夜,二抗(1:5000)孵育1 h,显影、定影。用Gelpro32软件分析胶片上蛋白条带灰度值。
1.3 统计学方法采用SPSS17.0统计软件,数据以(x±s)表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果 2.1 A549细胞转染miR-200c鉴定Real-time PCR结果显示转染组、阴性对照组和空白对照组miR-200c相对表达量分别为(1 1746.96±1 989.30)、(1.06±0.05)、(1.00±0.02),转染组miR-200c表达显著高于阴性对照组和空白对照组(P<0.0001),而阴性对照组与空白对照组之间差异无统计学意义(P=0.6238)。说明转染miR-200c的A549细胞中miR-200c的表达显著增加,转染成功。
2.2 转染miR-200c后细胞对紫杉醇、吉非替尼药物敏感度的影响MTT结果miR-200c-T组IC50为6.1 nmol/L,较Control-T组降低(P=0.036);miR-200c-G组IC50为15.4 μmol/L,较Control-G组降低(P=0.042)。说明上调miR-200c可增强A549细胞对紫杉醇、吉非替尼单药的敏感度,见图 1。以紫杉醇为参照,miR-200c-G+T组与Control-G+T组对A549细胞的IC50分别为5.8 nmol/L和6.7 nmol/L;以吉非替尼为参照,分别为14.6 μmol/L和16.7 μmol/L(P=0.054)。说明miR-200c上调后,A549细胞对紫杉醇与吉非替尼两药联合的敏感度无明显影响。
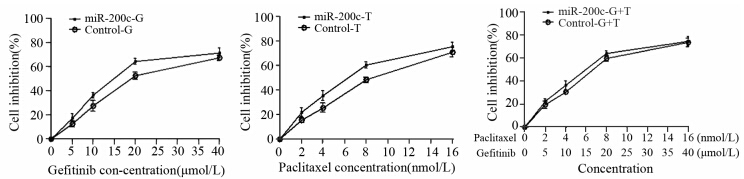
|
| 图 1 各处理组对A549细胞的增殖抑制作用 Figure 1 The proliferation inhibition effect of drugs to A549 cells in different groups |
流式细胞仪结果显示miR-200c-T 组、Control-T组细胞总凋亡率分别为26.6%、16.5%(P=0.0054);miR-200c-G组、Control-G组总凋亡率分别为15.8%、11.0%(P=0.0149);miR-200c组、Control组总凋亡率分别为8.7%、7.7%(P=0.0739)。提示上调miR-200c可提高紫杉醇、吉非替尼单药对A549细胞的促凋亡作用。而miR-200c-G+T组与Control-G+T组细胞总凋亡率分别为32.8%、30.1%(P=0.0514)。提示miR-200c上调后,紫杉醇与吉非替尼两药联合对A549细胞的促凋亡作用无明显影响,见图 2。
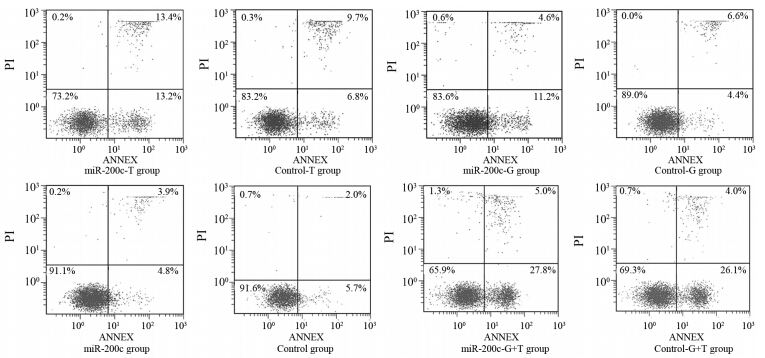
|
| 图 2 各处理组对A549细胞凋亡的影响 Figure 2 Cell apoptosis in different treatment groups |
Western blot结果显示miR-200c-T组与Control-T组比较,TUBB3蛋白表达显著降低(P=0.0009),见图 3A。
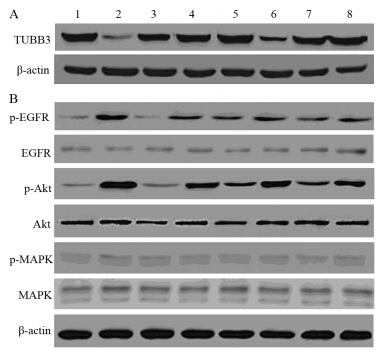
|
| 1. miR-200c-G group; 2. miR-200c-T group; 3. miR-200c-G+T group; 4. miR-200c group; 5. Control-G group; 6. Control-T group; 7. Control- G+T group; 8. Control group 图 3 各处理组对A549细胞中TUBB3、p-EGFR、EGFR、p-Akt、Akt、p-MAPK、MAPK蛋白表达的影响 Figure 3 The expression of TUBB3,p-EGFR,EGFR, p-Akt,Akt,p-MAPK and MAPK protein in different treatment groups |
Western blot结果显示miR-200c-G组与Control-G组相比,磷酸化蛋白p-EGFR、p-Akt表达降低(P值分别为0.0132、0.0063);磷酸化蛋白p-MAPK及总蛋白MAPK、EGFR、Akt总蛋白表达差异无统计学意义(P值分别为0.7229、0.8881、0.5955、0.6344)。miR-200c-G+T组与Control-G+T组比较,磷酸化蛋白p-EGFR、p-Akt表达降低(P值分别为0.013、0.021);p-MAPK及总蛋白MAPK、EGFR、Akt总蛋白表达差异无统计学意义(P值分别为0.8467、0.78、0.9633、0.5946)。而miR-200c-G+T组与miR-200c-T组比较,磷酸化蛋白p-EGFR、p-Akt表达明显下调(P值分别为0.0011、0.0018);与miR-200c-G组相比,磷酸化蛋白p-EGFR、p-Akt表达无明显差异(P值分别为0.1102、0.2174),见图 3B。
3 讨论NSCLC大多数确诊时已是局部晚期或出现远处转移,失去手术治疗机会。紫杉醇与铂类的两药联合方案常用于晚期NSCLC,但仍有部分患者对化疗不敏感或存在耐药。
miR-200c是位于12号染色体(12p13.31)的miR-200家族成员之一,在乳腺癌、膀胱癌、肺癌等多种肿瘤中的表达水平显著低于正常组织,与多种药物的耐药相关。多项研究证实β-微管蛋白Ⅲ(beta-tubulin Ⅲ,TUBB3)是miR-200c的直接作用靶点,上调miR-200c表达可通过抑制TUBB3表达增加肿瘤细胞对紫杉醇的敏感度,甚至逆转耐药,这在子宫内膜癌、卵巢癌、乳腺癌均得到了验证[3, 4]。本研究中转染miR-200c入肺癌A549细胞后加入紫杉醇,结果显示转染组(miR-200c-T组)IC50低于阴性对照组(Control-T组),细胞凋亡率高于阴性对照组,TUBB3蛋白表达明显降低。说明miR-200c表达上调后可能通过抑制TUBB3蛋白表达提高A549细胞对紫杉醇的敏感度。
另外miR-200c也与EGFR-TKI耐药相关,Bryant等[5]发现A549细胞miR-200c表达水平上调后,对厄洛替尼的敏感度明显增加。徐姝等[6]发现上调miR-200c表达水平使肺癌细胞株H1650及H1299对吉非替尼敏感度较前显著增加。同样在本研究中A549细胞中miR-200c表达上调后,吉非替尼敏感度增加,细胞凋亡率也增高,进一步的机制研究发现EGFR、Akt磷酸化蛋白表达降低,而各组EGFR、Akt总蛋白和MAPK磷酸化蛋白、总蛋白表达无明显差异。说明miR-200c表达上调后可能通过抑制EGFR下游信号通路中的PI3K-Akt通路上的EGFR、Akt磷酸化蛋白表达增强A549细胞对吉非替尼的敏感度,而与Ras-Raf-MAPK信号通路无明显相关。这与miR-200c通过抑制Akt信号通路增加胃癌细胞对顺铂的敏感度[7]及乳腺癌细胞对阿霉素的敏感度[8]研究结果是相吻合的。Zhong等[9]在肺癌细胞中上调miR-145、miRNA-126表达后对吉非替尼的敏感度明显提高,这一作用是通过抑制EGFR下游信号通路得以实现的,其中Akt磷酸化水平明显下降。
另外本研究拟探讨miR-200c表达上调后对紫杉醇联合吉非替尼是否具有协同作用,结果发现转染组(miR-200c-G+T组)与阴性对照组(Control-G+T组)相比,IC50、细胞凋亡率和EGFR、Akt、MAPK磷酸化蛋白和总蛋白表达均无明显差异。表明miR-200c对两药联合无协同作用。紫杉醇主要作用于G2/M期细胞,而吉非替尼将细胞阻滞于G0/G1期,则G2/M期细胞显著减少,进入增殖期细胞数量明显减少,使紫杉醇的细胞毒作用减弱[10],这可能与两药联合无增效作用相关。而本研究得出阴性结果的原因可能与紫杉醇联合吉非替尼的给药方式有关,贾刚等[10]研究发现先给予紫杉醇后用吉非替尼有增强抑制肺癌细胞生长的作用,而同时给予紫杉醇与吉非替尼或先给予吉非替尼后用紫杉醇对抑制细胞生长无显著增强作用,Van Schaeybroeck等[11]报道将吉非替尼与化疗联合用于多个NSCLC细胞株,若细胞中EGFR磷酸化水平升高则能从后续吉非替尼治疗中获益。本研究发现转染miR-200c入肺癌A549细胞后加入吉非替尼抑制EGFR和Akt的磷酸化蛋白表达,而加入紫杉醇EGFR和Akt的磷酸化蛋白表达升高,可能先加入紫杉醇再序贯给予吉非替尼对抑制EGFR、Akt磷酸化作用加强,更能起到协同抗肿瘤作用。这在FASTACT-Ⅱ[12]临床研究中也得到了验证,先给予化疗药物再序贯使用厄洛替尼的晚期NSCLC患者无进展生存期(progress free survival,PFS)及总生存期(overall survival,OS)均获得显著延长。
综上所述,上调miR-200c表达可增强肺癌A549细胞对紫杉醇及吉非替尼的敏感度,可能分别与TUBB3蛋白和EGFR、Akt磷酸化蛋白表达水平降低有关,这可能为晚期NSCLC化疗或EGFRTKI耐药患者提供新的治疗思路,但其具体的作用机制有待进一步研究。
| [1] | Park SM, Gaur AB, Lengyel E, et al. The miR-200 family determines the epithelial phenotype of cancer cells by targeting the E-cadherin repressors ZEB1 and ZEB2[J]. Genes Dev, 2008, 22(7): 894-907. |
| [2] | Jurmeister S, Baumann M, Balwierz A, et al. MicroRNA-200c represses migration and invasion of breast cancer cells by targeting actin-regulatory proteins FHOD1 and PPM1F[J]. Mol Cell Biol, 2012, 32(3): 633-51. |
| [3] | Cochrane DR, Spoelstra NS, Howe EN, et al. MicroRNA-200c mitigates invasiveness and restores sensitivity to microtubuletargeting chemotherapeutic agents[J]. Mol Cancer Ther, 2009, 8(5): 1055-66. |
| [4] | Leskel?S, Leandro-García LJ, Mendiola M, et al. The miR-200 family controls β-tubulin Ⅲ expression and is associated with paclitaxel-based treatment response and progression-free survival in ovarian cancer patients[J]. Endocr Relat Cancer, 2010, 18(1): 85-95. |
| [5] | Bryant JL, Britson J, Balko JM, et al. A microRNA gene expression signature predicts response to erlotinib in epithelial cancer cell lines and targets EMT[J]. Br J Cancer, 2012, 106(1): 148-56. |
| [6] | Xu S, Wu JZ, Cao HX, et al. Hypermethylation of miR-200c promoter correlated with EGFR-TKI resistance in lung cancer cells[J] Nanjing Yi Ke Da Xue Xue Bao(Zi Ran Ke Xue Ban), 2013, 33(1): 1-5. [徐姝, 吴建中, 曹海霞, 等. miR-200c启动子区甲基化与肺癌细胞对EGFR-TKI耐药相关[J]. 南京医科大学学报(自然科学版), 2013, 33(1): 1-5.] |
| [7] | Chen Y, Zuo J, Zhang XZ, et al. miRNA-200c enhances sensitivity of gastric cancer SGC7901/DDP cells to cisplatin through inhibiting Akt pathway[J]. Zhongguo Zhong Liu Sheng Wu Zhi Liao Za Zhi, 2012, 19(6): 582-7. [陈勇, 左静, 张西志, 等. miRNA-200c通过抑制Akt通路提高胃癌SGC7901/DDP细胞对顺铂的敏感性[J]. 中国肿瘤生物治疗杂志, 2012, 19(6): 582-7.] |
| [8] | Chen Y, Sun Y, Chen L, et al. miRNA-200c increases the sensitivity of breast cancer cells to doxorubicin through the suppression of E-cadherin-mediated PTEN/Akt signaling[J]. Mol Med Rep, 2013, 7(5): 1579-84. |
| [9] | Zhong M, Ma X, Sun C, et al. MicroRNAs reduce tumor growth and contribute to enhance cytotoxicity induced by gefitinib in non-small cell lung cancer[J]. Chem Biol Interact, 2010, 184(3): 431-8. |
| [10] | Jia G, Zhang WM, Zhou J, et al. Effects of paclitaxel and gefitinib on the proliferation and cell cycle of human lung adenocarcinoma cell SPC-A1[J]. Zhongguo Fei Ai Za Zhi, 2008, 11(3): 339-44. |
| [11] | Van Schaeybroeck S, Kyula J, Kelly DM, et al. Chemotherapyinduced epidermal growth factor receptor activation determines response to combined gefitinib/chemotherapy treatment in nonsmall cell lung cancer cells[J]. Mol Cancer Ther, 2006, 5(5): 1154-65. |
| [12] | Mok T, Yang JJ, Lam KC. Treating patients with EGFR-sensitizing mutations: first line or second line—is there a difference?[J]. J Clin Oncol, 2013, 31(8): 1081-8. |
 2015, Vol. 42
2015, Vol. 42


