文章信息
- 孟亮,余小祥,刘智明,冀保卫,陈治标,樊成,陈波. 2015.
- MENG Liang, YU Xiaoxiang, LIU Zhiming, JI Baowei, CHEN Zhibiao, FAN Cheng, CHEN Bo. 2015.
- 水通道蛋白4与人星形胶质细胞瘤迁移的相关性
- Role of Aquaporin-4 in Migration of Human Astrocytoma
- 肿瘤防治研究, 2015, 42(08): 756-759
- Cancer Research on Prevention and Treatment, 2015, 42(08): 756-759
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.08.002
-
文章历史
- 收稿日期: 2014-11-06
- 修回日期: 2015-02-01
2. 430060 武汉,武汉大学人民医院神经外科
2. Department of Neurosurgery, Renmin Hospital of Wuhan University, Wuhan 430060, China
星形脑胶质细胞瘤患者大部分预后不佳,主要原因是肿瘤周围浸润带无法完全切除,导致复发率高。肿瘤细胞的迁移是肿瘤浸润扩散的一个关键性的因素。研究表明,在哺乳动物中,水通道蛋白能加快多种肿瘤细胞迁移[1, 2]。人星形胶质细胞中富含水通道蛋白4(AQP4)[3],那么在人星形胶质细胞瘤中,AQP4的表达和肿瘤细胞的恶性程度和迁移侵袭能力是否有关系,本实验对此进行研究。
1 材料与方法 1.1 组织标本收集2009—2014年间我院收治并经病理证实为星形胶质细胞瘤的患者36例,男15例,女21例,依据WHO分级标准分为轻度恶性(Ⅰ级和Ⅱ级)和重度恶性(Ⅲ级和Ⅳ级),其中轻度恶性胶质瘤患者18例,男9例,女9例,平均年龄(50±1)岁;重度恶性胶质瘤患者18例,男6例,女12例,平均年龄(52±2)岁;以源于创伤性挫伤脑组织的星形细胞作为对照组,共15例,其中男9例,女6例,平均年龄(46±2)岁;所有标本的获取均征得患者家属和(或)患者的书面同意,符合科学研究伦理学标准。
1.2 试剂DMEM高糖培养液,青霉素-链霉素双抗,ECL发光液,SDS-PAGE凝胶配制试剂盒均购自中国碧云天生物技术研究所,反转录试剂盒,SYBR Green mix均购自日本Toyobo公司,小鼠抗人β-actin,HRP标记羊抗小鼠IgG均购自美国SantaCruz公司,胎牛血清购自美国Hyclone公司,胰蛋白酶购自美国Amresco公司,Transwell小室系统购自美国Corning公司。
1.3 原代细胞培养将脑组织或肿瘤组织于无菌操作台中PBS溶液清洗干净,去除表面血液,去除脑膜和血管,置于钢丝网研磨粉碎,将得到的组织混悬液经过400目尼龙网过滤,得到细胞悬液,将细胞悬液置于离心机中,700 g离心5 min,去上清液,用含有10%胎牛血清的DMEM培养液重悬细胞,以每毫升1.0×105个细胞的密度将细胞接种到培养瓶中,于37℃、5% CO2 95%湿度条件下培养。3天后更换培养液,待细胞铺满培养瓶底约95%时传代。
1.4 荧光定量PCR方法将培养瓶中的培养液弃去,用4℃的PBS溶液冲洗3次,吸干;加入1 ml的TRIzol Reagent,铺匀,平放静置5 min。将液体倒入灭菌后的EP管内,加三氯甲烷250 μl,充分混匀,静置5 min,4℃ 13 000 g离心10 min。取上清液500 μl于另一灭菌EP管内,加入等量的异丙醇,混匀后放入4℃的冰箱,15 min后取出,4℃ 13 000 g离心10min;倾倒出上面的液体,留在管底的白色沉淀即为RNA。加入75%的乙醇1 ml,4℃ 7 500 g离心5 min。将上面的液体倒出,只剩白色沉淀;再瞬时离心,尽量吸干管内的液体,晾干,再加入适量的去离子水加以溶解。反转录反应体系:RNA 5μl,5×RT 缓冲液4 μl,dNTP 2 μl,Oliga(dT)201 μl,无RNase水6 μl,Rnase抑制剂1 μl,ReverTraAce 1 μl,总体系20 μl;反应条件:42℃ 20 min,95℃ 5 min,4℃ 5 min。Real-time PCR:反应体系SYBR Green mix12.5 μl,引物(5 pmol/μl)2 μl,ddH2O 8 μl,cDNA(10倍稀释)2.5 μl,总体系 25μl。反应条件50℃ 2 min,95℃ 2 min,然后按95℃15 s,退火15 s,72℃ 45 s的顺序进行40个循环,最后72℃作用10 min。行荧光检测,测得各组CT值取平均数,依次获得ΔCT=ΔCT目的基因-ΔCTβ-actin,ΔΔCT=ΔCT实验-ΔCT对照,扩增倍数=2-ΔΔCT,比较不同组目的基因扩增倍数的差异。AQP4引物:上游5’-CATTTGTITGCAATCAATATAC-3’,下游5’-GACAGAAGACATACTCGTAAAGT-3’; β-actin引物:上游5’-GTCCACCGCAAATGCTTCTA-3’,下游5’-TGCTGTCACCTTCACCGTTC-3’。
1.5 免疫印迹检测收集对数生长期细胞,将细胞裂解液、PMSF和1%(v/v)的磷酸酶抑制剂于冰上混合均匀。加入300 μl上述细胞裂解液混合物,冰上放置20 min,期间不断摇动,收集混合物,12 000 r/min,5 min,4℃离心,取上清液,即为所提细胞总蛋白溶液,BCA法测蛋白浓度。按每孔50 μg上样,行常规变性聚丙烯酰胺凝胶电泳,应用湿法将蛋白转移到NC膜上(250 mA,85 min),5%BSA溶液(w/v)室温下封闭2 h,一抗封闭4℃过夜(一抗稀释浓度均为1:1000),TBST溶液洗膜10 min,3次,加入按1:5000稀释的HRP标记的二抗,室温孵育1h,TBST溶液洗膜10 min,3次,ECL发光液孵育,暗室曝光显影于X线胶片。使用Quantity one4.62软件检测各条带灰度值,比较各组AQP4/β-actin灰度值。
1.6 Transwell法检测细胞迁移能力将无菌Transwell小室放入培养板,每孔加入含血清培养液0.5 ml,37℃条件下孵育1 h后弃去培养液,将细胞重浮无血清培养液中。上室细胞接种密度为每微升50个,接种体积100 μl,下室加入600 μl含10%胎牛血清的DMEM培养液。于培养箱培养24 h。取出小室,PBS清洗后用4%多聚甲醛固定20min,加入0.1%结晶紫溶液染色10 min,双蒸水清洗3次,湿棉签擦去膜室内侧细胞.显微镜下观察照相,切下膜,浸入100 μl 10%乙酸中脱色10 min。在酶标仪下570 nm 波长处检测脱色液的吸光度值。
1.7 统计学方法用SPSS 13.0统计软件进行分析,数据用均数±标准差(x±s)表示,进行多个独立样本t检验,并进行相关分析,检验水平设定P<0.05。
2 结果 2.1 细胞培养结果组织悬液与含血清培养液中培养约12小时后,可见贴壁细胞,继续培养,贴壁细胞随时间增加而增多,可见细胞呈现多角形,有长突触,每3~4天更换培养液一次,约10天左右铺满瓶底,消化传代。
2.2 荧光定量PCR检测AQP4基因的表达结果AQP4基因扩增倍数2-ΔΔCT分别为:低级别组(1.65±0.052),高级别组(2.04±0.196),经比较可知AQP4基因相对表达量在实验组高于对照组,两实验组相比,高级别组显著高于低级别组,见图 1。

|
| *: P=0.041,**: P=0.008; #: P=0.032 图 1 不同级别星形胶质瘤细胞中AQP4基因相对表达量 Figure 1 The level of aquaporin-4(AQP4) gene in different groups of astrocytoma |
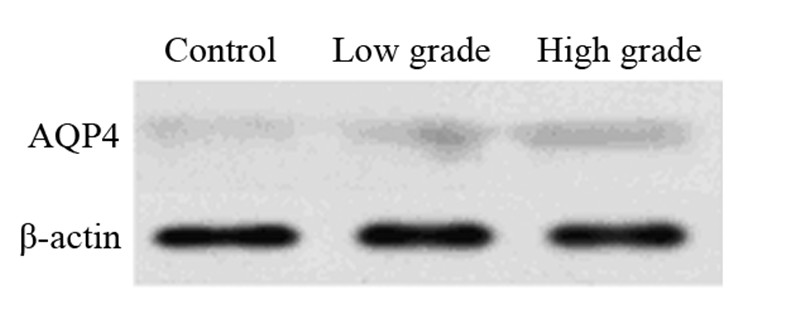
对照组AQP4/β-actin灰度值为(0.103±0.012),低级别组AQP4/β-actin灰度值为(0.185±0.100),高级别组AQP4/β-actin灰度值为(0.248±0.028),各组比较,差异有统计学意义(P=0.018)。免疫印迹实验结果显示AQP4蛋白条带灰度随细胞恶性程度的增高而增高,高级别星形胶质细胞瘤组明显高于低级别胶质细胞组和正常星形细胞组(P=0.036),见图 2。
|
| 图 2 不同级别星形胶质瘤细胞中AQP4蛋白表达 Figure 2 The level of AQP4 protein in different groups of astrocytoma |
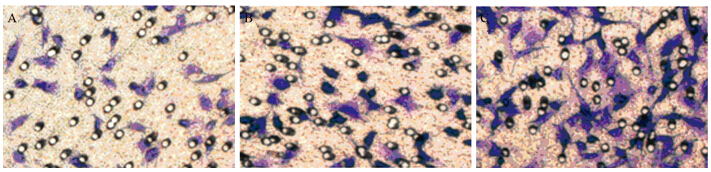
应用Transwell法检测星形胶质细胞、低级别胶质瘤细胞和高级别胶质瘤细胞的穿膜能力,将穿过小室底膜的细胞于乙酸中脱色,测得各组脱色液吸光度值:对照组(0.408±0.010),低级别组(0.590±0.033),高级别组(0.986±0.026),可见胶质瘤组明显高于对照组(P=0.041),且高级别组显著高于低级别组(P=0.029)。各组细胞迁移随AQP4表达的增高,细胞迁移能力也增强(P=0.033),见图 3。
|
| A: control group; B: low grade group; C: high grade group 图 3 Transwell法检测细胞迁移能力 Figure 3 The migration of normal astrocyte,low-grade astrocytoma cells and high-grade astrocytoma cells measured with Transwell assay |
水通道蛋白(aquaporin,AQP)是细胞膜上的一种糖蛋白,属于膜嵌入蛋白家族(major intrinsicprotein,MIP),分子量为30 kD左右,能够单独转运水或者小分子的溶质,比如甘油,尿素。水通道蛋白能够使细胞膜水的渗透性提高5~50倍。水通道蛋白有多种亚型,其中与中枢神经系统关系最为密切的是AQP1和AQP4。AQP1在脑组织主要存在于侧脑室﹑第四脑室脉络膜上皮微绒毛顶膜,在海马和室管膜细胞也有低水平表达。AQP4在脑组织中主要分布于星形胶质细胞和室管膜细胞,尤其是在于毛细血管和软脑膜直接接触的胶质细胞上[4, 5, 6]。研究表明,AQP1在某些肿瘤细胞中表达增加,参与了肿瘤的恶性生物学行为,如:小脑囊性成血管细胞瘤、前列腺癌、结肠癌、卵巢恶性肿瘤以及胶质瘤的内皮细胞[7, 8]。Hu等[1]发现:转染AQP1 到肿瘤细胞株B16F10 和4T1 后,肿瘤细胞膜渗透压增加5~10倍,且体外分析发现有AQP1表达的细胞其迁移能力较无AQP1表达的肿瘤细胞高2~3倍。即AQP1表达的增加能提高肿瘤细胞的迁移能力。Saadoun等[9]发现移植肿瘤细胞到AQP1基因敲除小鼠的皮下或颅内,发现肿瘤细胞血供减少并出现大量坏死,明显破坏肿瘤的生长。原代培养的野生型和AQP1基因缺失小鼠的主动脉内皮细胞,其黏附和更新能力无明显差异,但是AQP1基因缺失小鼠肿瘤细胞迁移能力大大降低。这进一步证实了,AQP1和肿瘤细胞迁移能力的密切关系。
和AQP1同一家族的AQP4是否具备同样的能力?Saadoun等[9]通过RNA干扰技术使野生型的星形胶质细胞中AQP4表达下调90%,发现其细胞的迁移能力则明显下降。研究表明,在人类恶性胶质瘤中,AQP4的表达明显上调[3, 10]。这和本实验结果一致。本实验中发现AQP4基因含量和蛋白表达在恶性星形细胞瘤细胞中明显增高,且随恶性程度的增高而增高。进一步研究表明,随AQP4表达增高,细胞迁移能力也增强,即AQP4表达越高,细胞穿透能力越强,其具体机制尚待进一步研究。
有研究表明,在细胞迁移时,迁移细胞前部伪足的顶端内部由于肌动蛋白裂解和离子摄入产生局部渗透压梯度,驱动水分子通过细胞膜进入该部位,增加局部静水压并引起细胞膜突伸,从而为肌动蛋白聚合创造空间。在这一过程中,水通道蛋白介导的水跨膜转运起到关键作用[2, 11]。Saadoun等[9]将非内皮细胞分别转染AQP1和AQP4后,其细胞迁移能力和伤口愈合能力明显加强;且细胞的层形足板极化的主要边缘(快速水流的地方)有明显的细胞皱褶,因而他们认为水通道蛋白介导的跨膜水转运可以改变细胞膜极化的速率,促进细胞前缘的快速极化。水通道蛋白不表达的细胞其迁移速度很慢,因为大部分脂质双分子层只是适度的通透水。由此表明,细胞膜水通道蛋白提供了一条使水分子快速进入细胞的途径并以此促进细胞迁移。AQP4增强胶质瘤细胞的迁移能力,也可能和这一机制相关。
本实验证实了星形胶质细胞瘤中AQP4的表达随恶性程度的增高而增高,AQP4可能通过影响细胞跨膜水转运参与星形胶质瘤细胞的迁移。这一发现为胶质细胞瘤的研究提供了新途径。
| [1] | Hu J, Verkman AS. Increased migration and metastatic potential of tumor cells expressing aquaporin water channels[J]. FASEB J, 2006, 20(11): 1892-4. |
| [2] | Wolburg H, Noell S, Fallier-Becker P, et al .The disturbed bloodbrain barrier in human glioblastoma[J]. Mol Aspects Med, 2012, 33(5-6): 579-89. |
| [3] | Wang Y, Guan SS, Zhao G, et al. Expressions of aquaporin-4,matrix metallo-proteinase-2 and matrix metallo-proteinase-14 in peritumor edematous zone of glioma and clinical implications[J]. Zhonghua Yi Xue Za Zhi, 2014, 94(29): 2290-2. [王阳, 关树森, 赵岗, 等. 水通道蛋白4、基质金属蛋白酶-2, -14在胶质瘤瘤周水肿组织中的表达及其临床意义[J]. 中华医学杂志, 2014, 94(29): 2290-2.] |
| [4] | Mobasheri A, Marples D. Expression of the AQP-1 water channel in normal human tissues: a semiquantitative study using tissue microarray technology[J]. Am J Physiol Cell Physio, 2004, 286: C529-37. |
| [5] | Nielsen S, Smith BL, Christensen EI, et al. Distribution of the aquaporin CHIP in secretory and resorptive epithelia and capillary endothelia[J]. Proc Natl Acad Sci USA, 1993, 90(15): 7275–9. |
| [6] | Ding T, Ma Y, Li W, et al. Role of aquaporin-4 in the regulation of migration and invasion of human glioma cells[J]. Int J Oncol, 2011, 38(6): 1521-31. |
| [7] | Oshio K, Binder DK, Liang Y, et al. Expression of the aquaporin-1 water channel in human glial tumors[J]. Neurosurgery, 2005, 56(2): 375-81. |
| [8] | Longatti P, Basaldella L, Orvieto E, et al. Aquaporin 1 expression in cystic hemangioblastomas[J]. Neurosci Lett, 2006, 392(3): 178-80. |
| [9] | Saadoun S, Papadopoulos MC, Hara-Chikuma M, et al. Impairment of angiogenesis and cell migration by targeted aquaporin- 1 gene disruption[J]. Nature, 2005, 434(7034): 786-92. |
| [10] | Zhang SB, Dai DW, Dai YM. Advances of aquaporin-4 research[J]. Zhongguo Lin Chuang Shen Jing Ke Xue, 2013, 21(4): 451-5. [张士保, 代大伟, 代亚美. 水通道蛋白-4的研究进展[J]. 中国临床神经科学, 2013, 21(4): 451-5.] |
| [11] | Schwab A. Function and spatial distribution of ion channels and transporters in cell migration[J]. Am J Physiol Renal Physiol, 2001, 280 (5): F739-47. |
 2015, Vol. 42
2015, Vol. 42


