文章信息
- 刘飞,肖瑞海,洪正东,黄雅为,鲁雄兵,潘正跃. 2015.
- LIU Fei, XIAO Ruihai, HONG Zhengdong, HUANG Yawei, LU Xiongbing, PAN Zhengyue. 2015.
- 沉默EZH2基因表达对肾癌细胞生物学行为的影响
- Effects of Silencing EZH2 Gene Expression on Proliferation and Apoptosis of Human Renal Carcinoma Cell Lines
- 肿瘤防治研究, 2015, 42(08): 751-755
- Cancer Research on Prevention and Treatment, 2015, 42(08): 751-755
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.08.001
-
文章历史
- 收稿日期: 2014-09-25
- 修回日期: 2014-12-18
肿瘤的发生发展常与细胞异常生长密切相关,并伴随癌基因的激活、抑癌基因的失活、细胞周期调控紊乱和表观遗传学改变等多方面机制的改变[1]。EZH2作为重要的转录抑制基因可沉默许多基因的表达,在调控肿瘤细胞增殖和凋亡过程中起着重要作用[2]。在体外实验已证实EZH2过表达可促进细胞生长和侵袭转移,在裸鼠实验中显示出癌基因的特性,利用反义结构或RNA干扰能抑制EZH2基因的表达,并因此抑制一些肿瘤细胞的生长[3]。然而EZH2是否参与调控肾癌细胞增殖、细胞周期和凋亡,目前相关报道甚少,因此本研究首先检测EZH2在不同肾癌细胞株的表达状况,然后应用RNA干扰技术沉默肾癌EZH2基因表达,并检测基因沉默后EZH2蛋白表达水平的变化,同时观察沉默EZH2基因表达后对ACHN肾癌细胞生物学行为的影响。
1 材料与方法 1.1 材料与试剂鼠抗人EZH2单克隆抗体(美国Cell SignalingTechnology公司); DMEM/F12培养液和RPMI1640培养液(美国Gibco公司);人近端肾小管上皮细胞HK-2系由华中科技大学附属同济医院肾病研究所惠赠;人肾癌细胞786-0细胞系和ACHN细胞系(武汉大学中国典型培养物保藏中心);胎牛血清(杭州四季青生物公司);胰蛋白酶(美国Promega公司);AnnexinV/PI检测试剂盒(上海晶美公司);CCK-8活细胞计数试剂盒(日本同仁化学研究所);化学合成siRNA EZH2(#1:5'-AGGAGGTGCAGACTAGCTGAA-3';#2:5'-GCTAAGACTCTGAATCCAGTT-3',上海生工生物工程有限公司);PCR上游/下游引物(上海博亚生物技术有限公司合成);蛋白免疫印迹化学显色试剂(上海锐谷生物科技有限公司);脂质体转染试剂Lipofectamine2000(美国Invitrogen公司)。
1.2 细胞培养和细胞转染 1.2.1 细胞培养人肾癌786-0和ACHN细胞接种 于含10%胎牛血清的RPMI 1640培养液中,人正常近端肾小管上皮细胞HK-2细胞接种于含15%胎牛血清的DMEM/F12培养液中,在37℃、5%CO2培养箱内培养,每隔2天更换新鲜培养液,待细胞贴壁生长至80%或完全融合成片状时,用0.25%胰酶消化传代或收集细胞提取蛋白。
1.2.2 转染实验参照Invitrogen Lipo2000脂质体 法操作进行细胞瞬时转染,转染前在孔板中进行无血清培养,转染分组为未转染组、序列打乱Siscrambled阴性对照组和siEZH2实验组。取对数生长期ACHN细胞加10%胎牛血清的DMEM培养液,置于37℃、5%CO2培养箱培养24 h;次日于转染前4 h换新鲜无血清DMEM培养液,置于37℃、5%CO2培养箱培养;制备转染复合物,分别向孔板中加入siRNA EZH2核酸脂质体复合物,加无血清DMEM培养液,每孔体积约为2 ml并摇匀;置于37℃、5%CO2培养箱培养4~6 h后,更换新鲜含10%胎牛血清DMEM培养液。
1.3 CCK-8法检测siEZH2对ACHN细胞增殖的影响细胞接种于96孔板,设空白对照孔(含CCK-8和培养液),按CCK-8试剂盒操作步骤,每隔24 h分别检测转染siEZH2后ACHN细胞在24、48和72 h的细胞增殖状况。
1.4 流式细胞术(FITC-AnnexinV/PI染色法)检测siEZH2对ACHN细胞凋亡的影响FITC-AnnexinV/PI染色法流式细胞仪分析检测转染siEZH2后ACHN细胞在24、48和72 h的细胞凋亡情况。接种细胞并转染siRNA EZH2核酸脂质体复合物,培养后收集并洗涤细胞,400 μl结合缓冲液悬浮细胞,加10 μl FITC-AnnexinV染液混匀,室温避光孵育15 min,加入5 μl PI染液混匀后冰上避光反应10 min,在1 h内用流式细胞仪检测细胞凋亡。
1.5 流式细胞术(PI单染法)检测siEZH2对ACHN细胞周期的影响PI单染色法流式细胞仪分析检测转染siEZH2后ACHN细胞在24、48和72 h的细胞周期分布。接种细胞并转染siRNA EZH2核酸脂质体复合物,培养后收集细胞,70%冰乙醇于4℃固定细胞过夜,洗涤细胞,加500 μl PBS溶液混匀后加入5 μl Rnase-A液室温反应45 min,细胞悬液加入浓度为1 mg/ml的PI染液5 μl,混匀于冰上避光反应30 min,流式细胞仪检测细胞周期。
1.6 Western blot检测EZH2蛋白表达脂质体介导siEZH2转染ACHN后培养48 h后收集细胞检测EZH2蛋白的表达情况。按照细胞蛋白提取试剂盒操作提取细胞总蛋白,Western blot检测EZH2蛋白表达。
1.7 统计学方法应用SPSS 13.0统计软件进行统计分析,数据以均数±标准差表示并进行单因素组间方差分析。P<0.05为差异有统计学意义。
2 结果 2.1 肾癌细胞系中EZH2蛋白的表达情况Western blot检测结果发现:HK-2细胞EZH2蛋白的表达量极低甚至不表达,而786-0和ACHN细胞中EZH2蛋白的表达水平较高,其中ACHN肾癌细胞株中EZH2蛋白的表达水平较786-0中略高,见图 1,说明EZH2在肾癌细胞中表达上调,可能与肾癌的发生或进展有关。
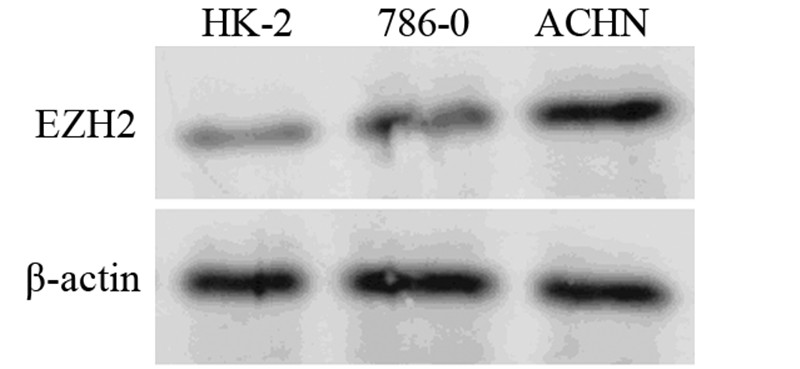
|
| 图 1 正常肾小管上皮细胞系和肾癌细胞系中EZH2蛋白的表达 Figure 1 EZH2 protein expression in human renal cell carcinoma(RCC) cell lines and normal human proximal kidney tubular epithelial cells HK-2 |
脂质体介导的siEZH2转染人肾癌ACHN细胞,培养48 h收集细胞提取蛋白,Western blot检测结果发现:与未转染ACHN细胞组相比,Si-scrambled阴性对照组ACHN细胞EZH2蛋白表达无明显变化,而siEZH2实验组ACHN细胞EZH2蛋白表达明显下调,见图 2。本实验结果表明siRNA-scrambled对肾癌ACHN细胞EZH2蛋白的表达无明显影响,而siEZH2可显著抑制ACHN细胞EZH2蛋白的表达。

|
| 1: non-transfected ACHN group; 2: Si-scrambled negative control group; 3: siEZH2 experimental group 图 2 siEZH2对ACHN肾癌细胞系EZH2蛋白表达的影响 Figure 2 EZH2 protein expression in RCC cell line ACHN transfected with siEZH2 |
siEZH2转染人肾癌ACHN细胞,培养24、48和72 h后行CCK-8检测siEZH2对ACHN细胞增殖的作用并绘制细胞增殖生长曲线,结果见图 3:未转染细胞组和Si-scrambled阴性对照组ACHN细胞生长差异无统计学意义(P=0.623),而siEZH2实验组ACHN细胞生长明显受抑制,其中在转染后48和72 h细胞增殖受抑制效应最显著(P<0.05);结果表明沉默EZH2基因表达可显著抑制肾癌ACHN细胞增殖生长。

|
| *: P<0.05,compared with non-transfected group and Si-scrambled negative control group 图 3 siEZH2对肾癌细胞系ACHN细胞生长的影响 Figure 3 Growth curves of RCC cell line ACHN transfected with siEZH2 |
siEZH2转染人肾癌ACHN细胞,培养24、48和72 h,并用流式细胞术(PI单染法)检测siEZH2对ACHN细胞周期的影响,结果见表 1和图 4:与对照组ACHN细胞相比,siEZH2实验组ACHN细胞周期中G1期细胞比例呈增加趋势,而S期和G2期细胞比例呈减少趋势,于转染后72 h趋于缓和;其中siEZH2转染ACHN细胞48 h后G1期细胞比例显著增加,而S期和G2期细胞比例明显下降(P<0.05)。结果表明,siEZH2转染ACHN细胞后,细胞周期阻滞于G1/S期,沉默EZH2基因表达可靶向肾癌细胞周期中G1/S限制点而阻滞细胞周期进展。

|
| A: non-transfected group; B: Si-scrambled group; C: siEZH2-48h group; D: siEZH2-72h group 图 4 siEZH2对肾癌ACHN细胞周期分布的影响 Figure 4 Cell cycle of RCC cell line ACHN transfected with siEZH2 |
siEZH2转染人肾癌ACHN细胞,培养24、48和72 h,用流式细胞术(FITC-AnnexinV/PI染色法)检测siEZH2对ACHN细胞凋亡的影响,结果见表 2和图 5:未转染细胞组和Si-scrambled阴性对照组ACHN细胞凋亡率无明显差异(P=0.745);与对照组ACHN细胞相比,siEZH2实验组ACHN细胞凋亡率随转染时间延长而呈增加趋势,且其凋亡率亦明显增加,其中在转染后48和72 h细胞凋亡率增加最显著,组间差异具有统计学意义(P<0.05),结果表明沉默EZH2基因表达可显著促进肾癌ACHN细胞凋亡。
 |

|
| A: non-transfected group; B: Si-scrambled group; C: siEZH2-48h group; D: siEZH2-72h group 图 5 siEZH2对肾癌ACHN细胞凋亡的影响 Figure 5 Cell apoptosis of RCC cell line ACHN transfected with siEZH2 |
恶性增殖是肿瘤的重要生物学行为特征,常不为正常机制所调控,而且可被许多因素诱发,包括肿瘤相关的癌基因可经过不同机制促进细胞增殖[4]。
近年来多项研究发现PcG基因家族中的EZH2在调控细胞周期、细胞增殖和调节肿瘤生长等过程中发挥着至关重要的作用,EZH2基因高表达促进肿瘤的生长,而靶向抑制EZH2基因表达可抑制肿瘤的生长[5]。Bracken等[6]研究发现,siRNA靶向沉默EZH2后人成纤维细胞TIG3中EZH2蛋白表达明显受抑制,同样在人肿瘤细胞株HeLa和U2OS中亦发现EZH2蛋白表达水平下降,而且细胞增殖明显受抑制,EZH2蛋白表达下调的细胞生长呈现出衰老的表型;进一步实验发现,人BJ1、U2OS和HeLa细胞转染EZH2 siRNA后DNA复制停止,通过流式细胞术分析发现转染后这三株细胞增殖停滞,细胞周期停滞在G1和G2期,而EZH2过表达后将诱导大量细胞进入S期和促进G2期细胞进入有丝分裂;同样EZH2也能促进原代细胞的增殖,表明EZH2作为细胞周期进程中的重要调节因子参与细胞周期的调控,并促进细胞增殖和肿瘤生长。同样Collett等[7]通过检查肿瘤组织增殖标志物Ki-67发现,EZH2与进展性乳腺癌肿瘤细胞高增殖率正相关,EZH2表达阳性的肿瘤细胞增殖率为21%,而表达阴性者肿瘤细胞增殖率仅为6%;更重要的是EZH2蛋白阳性表达引起的高增殖率肿瘤进展风险高,表明EZH2相关的细胞恶性增殖与肿瘤的预后相关[8]。因此靶向沉默EZH2有望抑制肿瘤细胞增殖而成为肿瘤基因治疗的新策略。
本研究发现肾癌细胞株EZH2蛋白较正常细胞株表达上调,表明EZH2可能与肾癌的发生有关。进一步我们采用由脂质体介导的siEZH2瞬时转染ACHN肾癌细胞,并检测转染后基因沉默效果和对细胞增殖、周期和凋亡的影响。结果显示RNA干扰后ACHN肾癌细胞株EZH2蛋白的表达水平显著下调,而且肾癌细胞增殖明显受抑制,随着转染时间效应的延长增殖率也呈下降趋势;细胞周期检测结果时发现,RNA干扰EZH2表达后ACHN肾癌细胞株G1期细胞比例增加,而S和G2期细胞比例下降,细胞周期阻滞于G1/S期。表明沉默EZH2基因表达可显著抑制肾癌ACHN细胞增殖生长,而且可靶向肾癌ACHN细胞周期中G1/S限制点而阻滞细胞周期进展。
已有研究证实转录抑制基因EZH2在许多肿瘤发生发展过程中扮演着癌基因的角色,除了与肿瘤细胞的异常增殖有关外,在肿瘤细胞凋亡过程中亦起着重要作用。Berezovska等[9]研究发现,RNA干扰介导的EZH2基因表达沉默后可诱导更新中的前列腺癌前体细胞发生凋亡。Wu等[2]在实验研究中发现,转录因子E2F1介导激活EZH2并能抑制E2F1介导的肿瘤细胞凋亡,同时通过表观遗传抑制Bim的表达,因此EZH2直接调控肿瘤细胞的凋亡过程。有研究结果发现,siRNA沉默EZH2基因表达后在DZNep介导的乳腺癌MCF-7细胞凋亡中发挥着重要的促凋亡作用,但是对人正常乳腺上皮MCF-10A细胞凋亡无影响[10];同样Tang等[11]研究发现,与正常成纤维细胞相比,成纤维肉瘤细胞EZH2蛋白表达水平明显上调;应用RNA干扰技术沉默EZH2基因表达,发现成纤维肉瘤细胞肿瘤克隆形成明显受抑制,而成纤维细胞的凋亡却无任何影响。
本研究结果显示RNA干扰EZH2基因表达后,ACHN肾癌细胞株的凋亡率显著增加,随着转染时间效应的延长凋亡率呈上升趋势,表明沉默EZH2基因表达可显著促进肾癌ACHN细胞的凋亡。因此,EZH2除了在前列腺癌和乳腺癌的肿瘤细胞凋亡过程中起调控作用外,亦参与肾癌的肿瘤细胞凋亡,而靶向敲减EZH2基因表达可促进肾癌细胞的凋亡。
综上,靶向沉默EZH2基因表达可抑制肾癌细胞增殖,阻滞细胞周期进程于G1/S限制点,并促进肿瘤细胞的凋亡。因此靶向EZH2沉默其表达为肾癌未来的基因治疗成为可能提供了理论基础和实验依据。
| [1] | Bergmann A, Steller H. Apoptosis, stem cells, and tissue regeneration[J]. Sci Signal, 2010, 3(145): re8. |
| [2] | Wu ZL, Zheng SS, Li ZM, et al. Polycomb protein EZH2 regulates E2F1-dependent apoptosis through epigenetically modulating Bim expression[J]. Cell Death Differ, 2010, 17(5): 801-10. |
| [3] | Bae WK, Hennighausen L. Canonical and non-canonical roles of the histone methyltransferase EZH2 in mammary development and cancer[J]. Mol Cell Endocrinol, 2014, 382(1): 593-7. |
| [4] | Roy S, Kaur M, Agarwal C, et al. p21 and p27 induction by silibinin is essential for its cell cycle arrest effect in prostate carcinoma cells[J]. Mol Cancer Ther, 2007, 6(10): 2696-707. |
| [5] | Gonzalez ME, Li X, Toy K, et al. Downregulation of EZH2 decreases growth of estrogen receptor-negative invasive breast carcinoma and requires BRCA1[J]. Oncogene, 2009, 28(6): 843-53. |
| [6] | Bracken AP, Pasini D, Capra M, et al. EZH2 is downstream of the pRB-E2F pathway, essential for proliferation and amplified in cancer[J]. EMBO J, 2003, 22(20): 5323-35. |
| [7] | Collett K, Eide GE, Arnes J, et al. Expression of enhancer of zeste homologue 2 is significantly associated with increased tumor cell proliferation and is a marker of aggressive breast cancer[J]. Clin Cancer Res, 2006, 12(4): 1168-74. |
| [8] | Saramaki OR, Tammela TL, Martikainen PM, et al. The gene for polycomb group protein enhancer of zeste homolog 2 (EZH2) is amplified in late-stage prostate cancer[J]. Genes Chromosomes Cancer, 2006, 45(7): 639-45. |
| [9] | Berezovska OP, Glinskii AB, Yang Z, et al. Essential role for activation of the Polycomb group (PcG) protein chromatin silencing pathway in metastatic prostate cancer[J]. Cell Cycle, 2006, 5(16): 1886-901. |
| [10] | Tan J, Yang X, Zhuang L, et al. Pharmacologic disruption of Polycomb-repressive complex 2-mediated gene repression selectively induces apoptosis in cancer cells[J]. Genes Dev, 2007, 21(9): 1050-63. |
| [11] | Tang X, Milyavsky M, Shats I, et al. Activated p53 suppresses the histone methyltransferase EZH2 gene[J]. Oncogene, 2004, 23(34): 5759-69. |
 2015, Vol. 42
2015, Vol. 42

