文章信息
- 毛丽丽,斯璐,王轩,盛锡楠,崔传亮,迟志宏,唐碧霞,连斌,鄢谢桥,李思明,郭军. 2015.
- MAO Lili, SI Lu, WANG Xuan, SHENG Xi’nan, CUI Chuanliang, CHI Zhihong, TANG Bixia, LIAN Bin, YAN Xieqiao, LI Siming, GUO Jun. 2015.
- 阿瑞匹坦对黑色素瘤患者顺铂治疗引起恶心呕吐的止吐作用
- Antiemetic Effect of Aprepitant for Cisplatin-induced Nausea and Vomiting in Melanoma Patients
- 肿瘤防治研究, 2015, 42(07): 712-715
- Cancer Research on Prevention and Treatment, 2015, 42(07): 712-715
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.07.015
-
文章历史
- 收稿日期:2014-09-10
- 修回日期:2015-01-29
化疗导致的恶心呕吐(chemotherapy induced nausea and vomiting,CINV)是严重影响肿瘤患者生活质量的不良反应之一,不仅影响患者接受化疗的依从性,严重的恶心呕吐还可能导致患者脱水、电解质紊乱、营养不良,甚至引起消化道黏膜损伤而发生出血、感染导致死亡。因此,如何降低CINV的发生率,提高患者的生活质量是多年来困扰肿瘤科医生的难题[1, 2, 3]。黑色素瘤是皮肤、黏膜黑色素细胞来源的恶性肿瘤,复发转移迅速,死亡率高。黑色素瘤的辅助治疗和姑息治疗中常用的化疗药物包括顺铂、达卡巴嗪、替莫唑胺(口服),均是具有高致吐性的药物,其中以顺铂的致吐作用最为显著。因此,止吐治疗对于黑色素瘤患者尤为重要。
阿瑞匹坦是一种新型的止吐药物,其作用机制不同于传统的5-HT拮抗剂。阿瑞匹坦是NK1受体的高选择性拮抗剂,可通过血脑屏障与脑NK1受体高水平结合,通过作用于中枢系统抑制呕吐[4, 5, 6, 7]。国外研究证实,在接受中、高度致吐药物治疗的患者中,阿瑞匹坦、5-羟色胺受体拮抗剂及地塞米松的三药联合可分别提高患者的完全缓解率(无呕吐且无需解救治疗)达20%和10%,并且在胃肠、肺、泌尿生殖等多个瘤种中均有显著的止吐作用,但在黑色素瘤患者中尚无相关报道[8, 9, 10, 11]。因此,本研究探讨接受含顺铂方案治疗的黑色素瘤患者中,阿瑞匹坦对恶心呕吐的疗效。
1 资料和方法 1.1 临床资料在北京大学肿瘤医院肾癌黑色素瘤内科接受含顺铂方案治疗的黑色素瘤患者,符合以下入组标准者纳入本临床研究。入组标准:(1)组织学证实的恶性黑色素瘤患者;(2) KPS评分≥60分;(3)良好的脏器功能;(4)骨髓及肝肾功能正常。排除标准:(1)既往接受顺铂治疗;(2)激素应用禁忌患者(未控制的高血压、溃疡病史、糖尿病患者等);(3)正在服用阿片类药物的患者;(4)未控制的脑转移患者或有症状的脑转移患者。参与此项研究的所有患者均签署知情同意书。
1.2 治疗方案根据化疗前的预防性止吐治疗将全组患者随机分入阿瑞匹坦组和对照组。阿瑞匹坦组的预防性止吐治疗:化疗前30 min给药,包括5-HT拮抗剂(昂丹司琼8 mg静脉注射,每日2次、甲基泼尼松龙20 mg静脉注射,每日1次、阿瑞匹坦125 mg口服第一天,80 mg口服第2、3天);对照组则采用昂丹司琼及甲基泼尼松龙止吐(昂丹司琼8 mg静脉注射,每日2次、甲基泼尼松龙40 mg静脉注射,每日1次)。全组患者顺铂总量按75 mg/m2进行计算,分为第1~3天静脉给药。
1.3 疗效评价顺铂给药后每24 h记录患者的恶心、呕吐不良反应,并根据常见不良反应评价标准(common terminology criteria for adverse events,CTC-AE 4.0版)进行分级。记录顺铂给药后的解救治疗(包括辅助性止吐药物:甲氧氯普胺、苯二氮卓类和抗组胺药),化疗后电解质紊乱情况。化疗前及化疗第7天采用呕吐生活功能指数(functional living index-emesis)问卷对患者进行生活质量评分。完全缓解(complete response,CR)定义为顺铂用药后无呕吐、无解救性用药。
1.4 统计学方法采用SPSS16.0软件进行统计分析,采用卡方检验、t检验对阿瑞匹坦组和对照组间等级资料、计量资料进行比较。采用多因素分析探索影响恶心、呕吐的危险因素。P值均为双侧检验,以P<0.05为差异有统计学意义。
2 结果 2.1 患者基本特征自2013年12月至2014年7月,共170例患者入组,其中阿瑞匹坦组85例,对照组85例,两组中各有一名患者因非消化道毒性中断顺铂治疗,因此共168例患者纳入最终结果分析。患者基本特征见表 1。阿瑞匹坦组和对照组患者的性别、年龄、原发部位、分期、有无肝转移、化疗方案等情况基本匹配(P>0.05)。全组患者均为初次接受顺铂治疗。迄今为止,两组患者完成顺铂方案治疗的平均周期数分别为3.4(阿瑞匹坦组)和3.1(对照组),两组间差异无统计学意义。
两组中各有84例患者纳入疗效分析。阿瑞匹坦组患者CR率为69%(58/84),显著高于对照组的44%(37/84)(χ2=10.683,P=0.001)。阿瑞匹坦组和对照组患者恶心的发生率分别为83%(70/84)和91%(76/84),差异无统计学意义(P=0.17)。阿瑞匹坦组和对照组患者的呕吐发生率分别为27%(23/84)和51%(43/84),阿瑞匹坦组显著优于对照组(χ2=9.982,P=0.002)。阿瑞匹坦组患者解救治疗发生率(25% vs.54%)显著低于对照组(χ2=10.683,P<0.001)。阿瑞匹坦组患者的生活质量评分为109,显著高于对照组的102分(P<0.001)。两组间的电解质紊乱发生率差异无统计学意义。
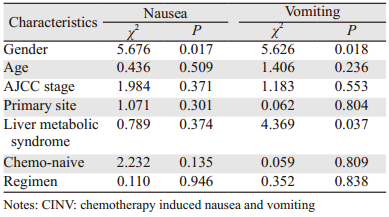
2.3 恶心呕吐的危险因素根据患者的基本临床特征[包括年龄(≥50岁;<50岁)、原发部位、肝转移状况、是否初治、化疗方案]进行分层分析,结果显示患者性别与恶心发生有关(P=0.017),性别、肝转移状况与呕吐发生有关(P值分别为0.018和0.037),见表 2。采用Logistic回归多因素分析对呕吐相关的影响因素(阿瑞匹坦用药、性别、肝转移状况)进行分析,结果显示阿瑞匹坦用药是影响患者呕吐反应的最主要因素,阿瑞匹坦治疗组患者无呕吐发生的概率是对照组的2.79倍(95% CI:1.441~5.407)。其中女性、肝转移是呕吐的危险因素,见表 3。
阿瑞匹坦组患者中未观察到与阿瑞匹坦明确相关的不良反应。
3 讨论阿瑞匹坦是首个上市的NK1受体拮抗剂,于2003年在美国上市。阿瑞匹坦、5-羟色胺受体拮抗剂加地塞米松的三药联合已被NCCN指南推荐用于高致吐性化疗药物的预防止吐治疗。
本研究探索了阿瑞匹坦在接受含顺铂方案治疗的黑色素瘤患者中的疗效,结果显示阿瑞匹坦组患者完全缓解率明显优于对照组,分别为69%和44%,并可显著降低患者呕吐的发生率(27% vs.51%)。阿瑞匹坦可减轻患者的消化道反应,改善生活质量,有利于治疗的完整施行。该结果与既往国内外报道的结果一致[10, 11, 12]。
本研究显示,阿瑞匹坦是控制呕吐的最重要因素,阿瑞匹坦治疗组患者无呕吐发生的概率是对照组的2.79倍,此外性别、肝转移也是影响患者呕吐反应的因素。研究发现,女性、肝转移是呕吐发生的危险因素。国外一项随机对照的Ⅲ期临床研究显示,阿瑞匹坦在男性和≥55岁的人群中有效率更高,但可能受到不同化疗方案的影响。在各个年龄、性别、地域分组中阿瑞匹坦组止吐疗效均优于无阿瑞匹坦组[13]。因此年龄、性别等因素究竟对阿瑞匹坦是否有影响还需要更多的研究结果。
本研究中采用顺铂40 mg连用3天的剂量方案,两组患者的恶心、呕吐反应均多见于第2~5日,解救治疗亦多发生于第2~5日,患者的迟发性呕吐是不容忽视的问题。但5-HT受体拮抗剂对迟发性呕吐疗效差,而国内在激素止吐方面应用往往不足,阿瑞匹坦的应用使这些问题得到了一定的解决。除用于顺铂等高致吐性化疗方案之外,国外学者已尝试在术后止吐、姑息治疗等领域应用阿瑞匹坦[14, 15],亦获得较好的疗效。已有体外研究结果显示,NK1受体拮抗剂具有抗黑色素瘤的作用,包括凋亡、抗黑色素瘤细胞迁移和抗血管生成[16];亦有研究提出阿瑞匹坦有延长肺癌患者PFS的趋势[12, 17],但上述结果还有待于大样本研究进一步确证。
在本研究中未观察到阿瑞匹坦相关不良反应,国外研究结果显示阿瑞匹坦的安全性良好[18],一项日本的研究指出阿瑞匹坦组的不良反应包括便秘和乏力,发生率均为3%,但未能进一步阐明上述不良反应是来源于阿瑞匹坦,还是来源于5-HT拮抗剂或化疗药物[19]。尽管阿瑞匹坦本身安全性良好,但阿瑞匹坦的主要代谢途径是经细胞色素P450同工酶CYP3A4,因此需注意阿瑞匹坦与其他同样经CYP3A4代谢药物间的相互作用。国外已有报道称阿瑞匹坦是CYP3A4的中度抑制剂,对激素的代谢有一定影响[20]。三联方案中阿瑞匹坦需要与地塞米松或甲基泼尼松龙联合应用,而后两者是CYP3A4的底物,因此在实验方案中我们将阿瑞匹坦组三联方案中的激素给药进行了相应调整(甲基泼尼松龙20 mg静脉注射,每日1次),但也有学者报道甲基泼尼松龙不受阿瑞匹坦影响[21]。目前已知阿瑞匹坦对环磷酰胺的药代动力学有影响[22],对高剂量马法兰、多西紫杉醇的药代动力学无影响[23, 24],但关于阿瑞匹坦与其他化疗药物相互作用的研究报道较少。本研究中主要涉及的化疗药物如达卡巴嗪、替莫唑胺与阿瑞匹坦是否存在药物相互作用还有待于进一步研究。
阿瑞匹坦的不足之处在于其为口服制剂,在治疗过程中,有呕吐反应的患者口服给药难以实现。开发阿瑞匹坦的静脉剂型,将有助于解决这一问题。福沙匹坦是阿瑞匹坦的前体药物,注射剂型,两者药效相当,注射后在体内迅速转化成阿瑞匹坦。2010年福沙匹坦已在美国获批上市,150 mg、第1天静脉注射,对于口服给药困难的患者而言会更加方便[25]。
综上所述,本研究结果表明,阿瑞匹坦可显著降低黑色素瘤患者中顺铂引起的呕吐反应,并改善化疗患者的生活质量。阿瑞匹坦安全性良好,但在给药前应熟知药物相互作用,对可能影响药代动力学的药物应适当调整剂量。
| [1] | Osoba D, Zee B, Pater J, et al. Determinants of postchemotherapy nausea and vomiting in patients with cancer. Quality of Life and Symptom Control Committees of the National Cancer Institute of Canada Clinical Trials Group[J]. J Clin Oncol, 1997, 15(1): 116-23. |
| [2] | Pollera CF, Giannarelli D. Prognostic factors influencing cisplatininduced emesis: definition and validation of a predictive logistic model[J]. Cancer, 1989, 64(5): 1117-22. |
| [3] | Booth CM, Clemons M, Dranitsaris G, et al. Chemotherapy-induced nausea and vomiting in breast cancer patients: a prospective observational study[J]. J Support Oncol, 2007, 5(8): 374-80. |
| [4] | Tattersall FD, Rycroft W, Francis B, et al. Tachykinin NK1 receptor antagonists act centrally to inhibit emesis induced by the chemotherapeutic agent cisplatin in ferrets[J]. Neuropharmacology, 1996, 35 (8): 1121-9. |
| [5] | Huskey SE, Dean BJ, Bakhtiar R, et al. Brain penetration of aprepitant, a substance P receptor antagonist, in ferrets[J]. Drug Metab Dispos, 2003, 31(6): 785-91. |
| [6] | Bergström M, Hargreaves RJ, Burns HD, et al. Human positron emission tomography studies of brain neurokinin 1 receptor occupancy by aprepitant[J]. Biol Psychiatry, 2004, 55(10): 1007-12. |
| [7] | Van Laere K, De Hoon J, Bormans G, et al. Equivalent dynamic human brain NK1-receptor occupancy following single-dose i.v. fosaprepitant vs. oral aprepitant as assessed by PET imaging[J]. Clin Pharmacol Ther, 2012, 92(2): 243-50. |
| [8] | Aapro MS, Schmoll HJ, Jahn F, et al. Cancer Treat Rev. Review of the efficacy of aprepitant for the prevention of chemotherapyinduced nausea and vomiting in a range of tumor types[J]. Cancer Treat Rev, 2013, 39(1):113-7. |
| [9] | Hesketh PJ, Grunberg SM, Gralla RJ, et al. The oral neurokinin-1 antagonist aprepitant for the prevention of chemotherapy-induced nausea and vomiting: a multinational, randomized, double-blind, placebo-controlled trial in patients receiving high-dose cisplatin- -the Aprepitant Protocol 052 Study Group[J]. J Clin Oncol, 2003, 1(22): 4112-9. |
| [10] | Poli-Bigelli S, Rodrigues-Pereira J, Carides AD, et al. Aprepitant Protocol 054 Study Group. Addition of the neurokinin 1 receptor antagonist aprepitant to standard antiemetic therapy improves control of chemotherapy-induced nausea and vomiting. Results from a randomized, double-blind, placebo-controlled trial in Latin-America[J]. Cancer, 2003, 97(12): 3090-8. |
| [11] | Warr DG, Hesketh PJ, Gralla RJ, et al. Efficacy and tolerability of aprepitant for the prevention of chemotherapy-induced nausea and vomiting in patients with breast cancer after moderately emetogenic chemotherapy[J]. J Clin Oncol, 2005, 23(12): 2822-30. |
| [12] | Hu W, Fang J, Nie J, et al. Addition of aprepitant improves protection against cisplatin-induced emesis when a conventional anti-emetic regimen fails[J]. Cancer Chemother Pharmacol, 2014, 73(6): 1129-36. |
| [13] | Uchino J, Hirano R, Tashiro N, et al. Efficacy of aprepitant in patients with advanced or recurrent lung cancer receiving moderately emetogenic chemotherapy[J]. Asian Pac J Cancer Prev, 2012, 3(8): 4187-90. |
| [14] | Rapoport BL. Efficacy of a triple antiemetic regimen with aprepitant for the prevention of chemotherapy-induced nausea and vomiting: effects of gender, age, and region[J]. Curr Med Res Opin, 2014, 30(9): 1857-81. |
| [15] | Gan, TJ, Apfel CC, Kovac A, et al. A randomized, double-blind comparison of the NK1 antagonist, aprepitant, versus ondansetron for the prevention of postoperative nausea and vomiting[J]. Anesth Analg, 2007, 104(5): 1082-9. |
| [16] | Muñoz M, Bernabeu-Wittel J, Coveñas R. NK-1 as a melanoma target[J]. Expert Opin Ther Targets, 2011, 15(7): 889-97. |
| [17] | Rangwala F, Zafar SY, Abernethy AP. Gastrointestinal symptoms in cancer patients with advanced disease: new methodologies, insights, and a proposed approach[J]. Curr Opin Support Palliat Care, 2012, 6(1): 69-76. |
| [18] | Ruhlmann CH, Herrstedt J. Safety evaluation of aprepitant for the prevention of chemotherapy-induced nausea and vomiting[J]. Expert Opin Drug Saf, 2011, 10(3): 449-62. |
| [19] | Takeshima N, Matoda M, Abe M, et al. Efficacy and safety of triple therapy with aprepitant, palonosetron, and dexamethasone for preventing nausea and vomiting induced by cisplatin-based chemotherapy for gynecological cancer: KCOG-G1003 phase Ⅱ trial[J]. Support Care Cancer, 2014, 22(11): 2891-8. |
| [20] | McCrea JB, Majumdar AK, Goldberg MR, et al. Effects of the neurokinin1 receptor antagonist aprepitant on the pharmacokinetics of dexamethasone and methylprednisolone[J]. Clin Pharmacol Ther, 2003, 74(1): 17-24. |
| [21] | Maie K, Okoshi Y, Takaiwa N, et al. Aprepitant does not alter prednisolone pharmacokinetics in patients treated with R-CHOP[J]. Ann Oncol, 2014, 25(1): 298-9. |
| [22] | Walko CM, Combest AJ, Spasojevic I, et al. The effect of aprepitant and race on the pharmacokinetics of cyclophosphamide in breast cancer patients[J]. Cancer Chemother Pharmacol, 2012, 69(5): 1189-96. |
| [23] | Egerer G, Eisenlohr K, Gronkowski M, et al. The NK receptor antagonist aprepitant does not alter the pharmacokinetics of highdose melphalan chemotherapy in patients with multiple myeloma [J]. Br J Clin Pharmacol, 2010, 70(6): 903-7. |
| [24] | Kaneta T, Fujita K, Akiyama Y, et al. No pharmacokinetic alteration of docetaxel following coadministration of aprepitant 3 h before docetaxel infusion[J]. Cancer Chemother Pharmacol, 2014, 74(3): 539-47. |
| [25] | Cocquyt V, Van Belle S, Reinhardt RR, et al. Comparison of L-758, 298, a prodrug for the selective neurokinin-1 antagonist, L-754, 030, with ondansetron for the prevention of cisplatininduced emesis[J]. Eur J Cancer, 2001, 37(7): 835-42. |
 2015, Vol. 42
2015, Vol. 42