文章信息
- 宋一民,王英姿,吕新全,薛金慧,李惠翔. 2015.
- SONG Yimin, WANG Yingzi, LV Xinquan, XUE Jinhui, LI Huixiang. 2015.
- 乳腺浸润性导管癌组织中ALDH1+/CD133+ 干细胞样细胞与血管生成的关系
- Relationship of ALDH1+/CD133+ Stem Cell-like Cells with Angiogenesis in Breast Invasive Ductal Carcinoma Tissues
- 肿瘤防治研究, 2015, 42(07): 706-711
- Cancer Research on Prevention and Treatment, 2015, 42(07): 706-711
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.07.014
-
文章历史
- 收稿日期:2014-08-04
- 修回日期:2015-02-28
2. 450052 郑州,郑州大学第一附属医院肾内科;
3. 450052 郑州,郑州市中心医院病理科
2. Department of Nephrology, The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China;
3. Department of Pathology, Zhengzhou Central Hospital, Zhengzhou 450052, China
乳腺癌是女性最常见的恶性肿瘤之一,并被认为是一种肿瘤干细胞(tumor stem cell,TSC)性疾病,TSC具有无限增殖和体内外形成肿瘤的能力,是肿瘤转移和复发的根源,但是对于其与肿瘤微血管生成的关系尚不清楚。最近研究表明,乳腺癌组织中高表达乙醛脱氢酶1(aldehyde dehydrogenase 1,ALDH1)的细胞亚群具有肿瘤干细胞的特性[1]。CD133是多种肿瘤干细胞的标志物,且有研究显示CD133阳性的胶质瘤干细胞可促进血管的生成[2],但在乳腺癌中尚无相关的报道。为探讨乳腺癌中TSC样细胞与肿瘤血管生成的关系,本研究应用免疫组织化学双染及单染法检测120例乳腺浸润性导管癌组织中ALDH1+/CD133+干细胞样细胞及血管性标记CD34、CD105、VEGF的表达情况,并分析其相关性。
1 资料与方法 1.1 标本资料收集2009年1月-2010年12月郑州大学第一附属医院乳腺癌患者手术切除组织标本120例,经病理学诊断均为乳腺浸润性导管癌。患者均为女性,平均年龄48.68±10.94(24~72)岁。浸润性乳腺癌组织学分级按照Bloom-Richardson系统Nottingham改良方案[3],其中,Ⅰ级21例、Ⅱ级78例、Ⅲ级21例;有淋巴结转移60例、无淋巴结转移60例;ER (+)74例、ER (-)46例;PR (+)43例、PR (-)77例;Her-2(0)22例、Her-2(+)36例、Her-2(++)28例、Her-2(+++)34例。
1.2 免疫组织化学 1.2.1 主要试剂兔抗人ALDH1单克隆抗体(美国EPITMICS公司,批号:YE112716,效价比1:150)。兔抗人CD133单克隆抗体(批号:11919605,即用型),鼠抗人CD105单克隆抗体(批号:11511302,效价比1:100),鼠抗人CD34单克隆抗体(批号:11202004,效价比1:100),兔抗人VEGF单克隆抗体(批号:11512A05,即用型),SP-9000试剂盒及DAB试剂盒均为北京中杉金桥生物技术有限公司产品。双染试剂盒为福州迈新生物技术开发有限公司产品。
1.2.2 检测方法ALDH1与CD133共染色采用免疫组织化学双染SP法,组织在pH8.0的EDTA修复液中进行高压抗原修复,染色方法依照说明书,先进行ALDH1染色,采用BCIP/NBT显色系统,阳性信号呈蓝黑色;然后进行CD133染色,采用AEC显色系统,阳性信号呈红色。CD34、CD105、VEGF为SP法单染,高压抗原修复,DAB显色,阳性信号呈棕黄色。
1.2.3 阳性结果判断ALDH1阳性细胞为细胞质蓝黑色,CD133阳性细胞为细胞膜红色,部分细胞质也呈阳性表达,根据ALDH1及CD133着色情况,将细胞分为以下四种表型:(1) ALDH1+/CD133+表型细胞表现为细胞质蓝黑色、细胞膜红色;(2) ALDH1+/CD133-表型为细胞质蓝黑色、细胞膜不着色;(3) ALDH1-/CD133+表型为细胞质不着色或红色、细胞膜红色;(4) ALDH1-/CD133-表型为细胞质及细胞膜均不着色。选取一张切片中的3个代表性视野,计数高倍视野(× 400)下的上述表型细胞数,取其平均值为本例的细胞密度。某一表型在所有组织中细胞密度的均值表示为:均数±标准差。
微血管密度:采用CD34、CD105蛋白单克隆抗体染色,CD34染色主要定位于内皮细胞膜和细胞质,CD105染色主要定位于细胞膜。凡染成棕色的单个内皮细胞或内皮细胞簇均作为一个血管计数。凡管腔直径大于8个红细胞大小,带有较厚肌层的血管均不计数。先用低倍显微镜(×40)扫视整个切片,寻找高血管密度区(Hot spot),然后在高倍镜下(×400)计数5个最高血管密度区域的血管条数,取平均值为该患者肿瘤的微血管条数。
VEGF染色主要定位于细胞质,染色呈棕黄色者为阳性,按Shimizu[4]评分标准进行半定量积分判断结果。按无着色、阳性细胞数小于1/3、1/3~2/3和大于2/3分别判定为0、1、2、3分;每张切片细胞的着色强度按无着色、着黄色、棕黄色和棕褐色分别判为0、1、2、3分,根据两项积分之和判断其结果,0~2分为阴性(-),3分为弱阳性(+),4~5分为中等阳性(++),6分为强阳性(+++)。积分之和≥3分判断该病例为VEGF阳性。
1.3 统计学方法采用SPSS17.0软件对实验结果进行统计学分析。ALDH1/CD133与临床病理指标的关系采用χ2检验;与血管生成指标之间的关系采用Pearson相关分析。计量资料以(x±s)表示,以α=0.05作为检验水准。
2 结果 2.1 ALDH1/CD133的表达情况120例乳腺浸润性导管癌组织中,ALDH1 +/CD133+、ALDH1+/CD133-、ALDH1-/CD133+、ALDH1-/CD133-四种表型的细胞在不同的病例表现为均存在、存在1~3种等不同方式。ALDH1+/CD133+表型细胞呈灶状分布,分布不均匀,见图 1A;ALDH1+/CD133-表型细胞呈零星分布,见图 1B;ALDH1-/CD133+和ALDH1-/CD133-表型的细胞呈片状或巢状分布见图 1C、1D,且不同病例间表达差异较大,见表 1。

|
| 图 1 乳腺浸润性导管癌组织中ALDH1/CD133各种表型细胞(SP×400) Figure 1 ALDH1/CD133 phenotypic cells in breast invasive ductal carcinoma tissues (SP×400) |
乳腺癌ALDH1+/CD133+、ALDH1-/CD133+两种表型细胞与ER表达有关(P<0.05),ALDH1-/CD133+表型细胞与肿瘤的分级有关(P<0.05),见表 2。对ALDH1+/CD133+表型细胞与ER的表达情况进行相关性分析,结果显示ALDH1+/CD133+表型细胞与ER阴性表达呈正相关(r=0.200),见表 3。
 |
 |
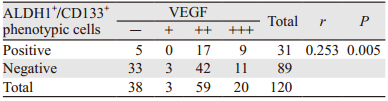
在120例乳腺浸润性导管癌组织中VEGF阳性表达82例,阴性表达38例,阳性表达率为68.33%(82/120)。对120例乳腺癌患者ALDH1+/CD133+表型细胞与VEGF表达的结果进行Spearman等级相关分析,结果显示ALDH1 +/CD133 +表型细胞与VEGF的表达呈高度正相关(r=0.253,P=0.005),见表 4。
 |
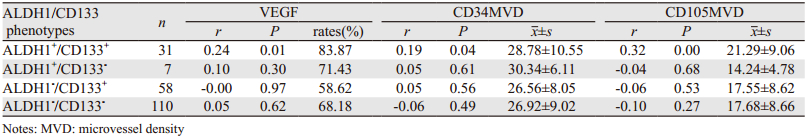
VEGF阳性细胞呈片状或巢状分布,见图 2A;CD34在正常组织及肿瘤组织中均有表达,在微小血管及大血管中均有较强表达,见图 2B;CD105在肿瘤组织中单个或成簇内皮细胞及微小血管中较强表达,新血管内皮细胞多排列不规则,管腔不明显,在大血管中染色不明显,在正常组织血管中无表达,见图 2C。在120例乳腺浸润性导管癌组织中CD34抗体标记的肿瘤微血管密度均值为26.93±9.02,CD105抗体标记的肿瘤微血管密度均值为17.63±8.59。对上述各项指标的计数结果进行Pearson相关分析,结果显示仅ALDH1+/CD133+表型细胞与VEGF的表达、CD105 MVD及CD34MVD之间呈正相关(P<0.05),尤其与前两者的关系为密切(P≤0.01),见表 5。

|
| 图 2 VEGF、CD34和CD105在乳腺浸润性导管癌组织中的阳性表达(SP ×200) Figure 2 Positive expression of VEGF, CD34 and CD105 in breast invasive ductal carcinoma tissues (SP ×200) |
 |
根据患者组织中有无ALDH1+/CD133+表型细胞,将120例乳腺浸润性导管癌组织分为两组,分别计算VEGF、CD105 MVD表达量的均值,计算结果显示两组VEGF表达量的差异具有统计学意义(P <0.05);两组CD105 MVD均值之间差异有统计学意义(P<0.05)。且结果显示存在ALDH1+/CD133+表型细胞的组织中VEGF和CD105 MVD的表达量明显高于不存在此表型细胞的组织,见图 3、见表 6。

|
| 图 3 乳腺浸润性导管癌ALDH1+/CD133+表型细胞中VEGF的表达(SP) Figure 3 Expression of VEGF in ALDH1+/CD133+ phenotypic cells in breast invasive ductal carcinoma tissues (SP) |
 |
肿瘤干细胞是存在于肿瘤组织的一小部分具有干细胞特性的细胞群,具有自我复制、增殖的能力,是肿瘤形成、复发、转移及耐药的根源[5]。肿瘤的生长和转移依赖于新血管的生成,但是目前关于肿瘤干细胞与血管生成之间的关系还不十分清楚。
ALDH1存在于几乎所有哺乳动物的组织中,是一种新近发现的肿瘤干细胞标志物。CD133是多种肿瘤干细胞的标志物,在乳腺癌、肝癌、结肠癌等[6-8]多种肿瘤研究中发挥重要作用,是分离、鉴定肿瘤干细胞的特异分子标志物。Wright等[6]在乳腺肿瘤干细胞的研究中发现CD133+乳腺癌细胞具有干细胞特性。
肿瘤的生长需要足够的氧气及营养供应[9],但细胞的快速生长常导致肿瘤内部处于缺氧状态,而新血管的生成则可为肿瘤不断提供生长所需的氧气和营养。肿瘤干细胞标记CD133的表达在缺氧的情况下增高[10]。Bao等[11]从胶质瘤中分选出CD133+胶质瘤干细胞(glioma stem cells,GSCs),且与CD133-GSCs相比,无论在缺氧还是常氧条件下均分泌高水平的VEGF,在缺氧条件下分泌的VEGF的量高于常氧条件下。缺氧不但可维持肿瘤干细胞的表型,促进肿瘤干细胞的自我更新,还可以抑制其向成熟的肿瘤细胞分化[12, 13]。Ping等[14]研究结果显示CD133+ GSCs定位于毛细血管周围,CD133+GSCs表达通过激活PI3K/AKT信号途径,诱导CD133+GSCs产生VEGF,促进新血管生成。Soeda等[13]研究结果也显示在抑制PI3KAKT或ERK1/2信号后,缺氧引起的CD133表达减少,提示此信号通路可能在调节干细胞对缺氧的反应中起作用。Silva等[15]的研究结果显示仅需11个ALDH+/CD133+卵巢癌干细胞就可以在小鼠体内形成肿瘤,而需要1 000个ALDH+/CD133-卵巢癌干细胞才可在小鼠体内形成肿瘤,说明ALDH+/CD133+卵巢癌干细胞具有更高的成瘤能力。目前关于ALDH1阳性细胞与血管形成的关系尚未见报道。
本研究统计了ALDH1/CD133各表型细胞与临床病理因素的关系,结果显示ALDH1+/CD133+表型细胞与E R表达有关,且进一步研究显示ALDH1+/CD133+表型细胞与ER阴性表达呈正相关。Morimoto等[16]研究也显示在乳腺癌中ALDH1与ER的阴性表达呈正相关;刘晓斌等[17]研究发现ER阴性的乳腺癌表现的侵袭性行为更强;这与肿瘤干细胞的特性相符。为探讨乳腺浸润性导管癌肿瘤干细胞样细胞与新血管的生成之间的关系,本研究观察了不同表型干细胞样细胞的组织中VEGF的表达情况,结果显示仅ALDH1+/CD133+表型的细胞与VEGF的表达有关;统计ALDH1+/CD133+表型细胞与VEGF不同程度表达之间的相关性,结果显示呈正相关;且含有ALDH1+/CD133+表型细胞的组织中VEGF的表达量明显高于不存在此表型细胞的组织,由此推测在乳腺癌组织中ALDH1+/CD133+干细胞样细胞与VEGF的表达有关,其可能通过促进VEGF表达的方式促进肿瘤新血管的生成。本研究对肿瘤血管的标记选用CD34、CD105两种标志物,CD34是泛血管内皮标志物之一,其相应抗体对血管内皮细胞具有普遍结合的特性,缺乏对肿瘤血管内皮细胞的特异性[18]。CD105(endoslin),是一种新生血管内皮细胞特异性标志物,仅在增殖状态的新生血管内皮细胞中表达,而在正常组织血管内皮细胞不表达或微弱表达,对肿瘤的诊断、治疗及判断预后有重要作用[19]。研究结果显示乳腺浸润性导管ALDH1+/CD133+干细胞样细胞与CD34 MVD、CD105 MVD呈正相关,且与CD105 MVD的关系更密切;含有ALDH1+/CD133+表型细胞的组织中CD105 MVD的均值明显高于不存在此表型细胞的组织,提示乳腺浸润性导管癌组织中ALDH1+/CD133+干细胞样细胞可能通过提高VEGF表达的方式促进新血管的生成,致微血管密度增加。Takase等[20]研究也证明与CD34相比,CD105对标记肿瘤新生血管更具有特异性。
本研究结果显示,乳腺癌干细胞与肿瘤血管生成之间存在密切的关系,可能通过上调VEGF表达促进血管生成,但其机制还有待于进一步研究。该研究结果为探讨肿瘤的生长与转移机制提供了新的思路。
| [1] | Ginestier C, Hur MH, Charafe-Jauffret E, et al. ALDH1 is a marker of normal and malignant human mammary stem cells and apredictor of poor clinical outcome[J]. Cell Stem Cell, 2007, 1(5): 555-67. |
| [2] | Wang R, Chadalavada K, Wilshire J, et al. Glioblastoma stem-like cells give rise to tumor endothelium[J]. Nature, 2010, 468(7325): 829-33. |
| [3] | Hui YZ. Ackerman’s Surgical Pathology Volume Two[M]. Peking University Medical Press, 2006:1825. Rosai J original.[回允中.阿克曼外科病理学下册[M].北京大学医学出版社, 2006, 1825.[罗塞(Rosai.J.)原著.] |
| [4] | Shimizu M, Saitoh Y, Itoh H. Immunohistochemical staining of Ha-ras ongene product in normal, benign, and malignant Human pancreatic tissues[J]. Hum Pathol, 1990, 21(6): 607-12. |
| [5] | Gil J, Stembslska A, Pesz KA, et al. Cancer stem cells: the theory and perspectives in cancer therapy[J]. J Appl Genet, 2008, 49(2): 193-9. |
| [6] | Wright MH, Calcagno AM, Salcido CD, et al. Brcal breast tumors contain distinct CD44+CD24- and CD133+ cells with cancer stem cell characteristics[J]. Breast Cancer Res, 2008, 10(1): R10. |
| [7] | Yang ZF, Ngai P, Ho DW, et al. Identification of local and circulating cancer stem cells in human liver cancer[J]. Hepatology, 2008, 47(3): 919-28. |
| [8] | O’Brien CA, Pollett A, Gallinger S, et al. A human colon cancer cell capable of initiating tumor growth in immunodeficient mice[J]. Nature, 2007, 445(7123): 106-10. |
| [9] | Moeller BJ, Cao Y, Li CY, et al. Radiation activates HIF-1to regulate vascular radiosensitivity in tumors role of reoxygenation, free radicals, and stress granules[J]. Cancer Cell, 2004, 5(5): 429-41. |
| [10] | Platet N, Liu SY, Atifi ME, et al. Influence of oxygen tension on CD133 phenotype in human glioma cell cultures[J]. Cancer Lett, 2007, 258(2): 286-90. |
| [11] | Bao S, Wu Q, Sathornsumetee S, et al. Stem cell-like glioma cells promote tumor angiogenesis through vascular endothelial growth factor[J]. Cancer Res, 2006, 66(16): 7843-8. |
| [12] | Panchision DM. The role of oxygen in regulating neural stem cells in development and disease[J]. J Cell Physiol, 2009, 220(3): 562-8. |
| [13] | Soeda A, Park M, Lee D, et al. Hypoxia promotes expansion of the CD133-positive glioma stem cells through activation of HIF-1 alpha[J]. Oncogene, 2009, 28(45): 3949-59. |
| [14] | Ping YF, Yao XH, Jiang JY, et al. The chemokine CXCL12 and its receptor CXCR4 promote glioma stem cell-mediated VEGF production and tumor angiogenesis via PI2K/AKT signaling[J]. J Pathol, 2011, 224(3): 344-54. |
| [15] | Silva IA, Bai S, McLean K, et al. Aldehyde dehydrogenase in combination with CD133 defines angiogenic ovarian cancer stem cells that portend poor patient survival[J]. Cancer Res, 2011, 71(11): 3991-4001. |
| [16] | Morimoto K, Kin SJ, Tanei T, et al. Stem cell marker aldechyde dehydroenase 1-positive breast cancers are characterized by negative estrogen receptor, positive human epidermal growth factor receptor type 2, and high Ki67 expression[J]. Cancer Sci, 2009, 100(6): 1062-8. |
| [17] | Liu XB, Yuan ZY, Li RY, et al. Analysis of the clinicopathologic characteristics and prognosis of breast cancer patients with ER or PR single-positive status[J]. Zhongguo Zhong Liu Lin Chuang, 2010, 37(7): 381-4.[刘晓斌,袁智勇,李瑞英,等. ER PR单阳性表达乳腺癌患者临床病理特征和预后分析[J].中国肿瘤临床, 2010, 37(7): 381-4.] |
| [18] | Fanelli M, Locopo N, Gattuso D, et al. Assessment of tumor vaseularlzation: immunohistochemieal and non-invasive methods[J]. Int J Biol Markers, 1999, 14(4): 218-31. |
| [19] | Pufe T, Harde V, Petersen W, et al. Vascular endothelial growth factor(VEGF) induces matrix metalloproteinase in immortalized chondrocytes[J]. J Pathol, 2004, 202(3): 367-74. |
| [20] | Takase Y, Kai K, Masuda M, et al. Endoglin (CD105) expression and angiogenesis status in small cell lung cancer[J]. Pathol Res Pract, 2010, 206(11): 725-30. |
 2015, Vol. 42
2015, Vol. 42