文章信息
- 黄芳,姜达,李颖,郑飞,崔彦芝. 2015.
- HUANG Fang, JIANG Da, LI Ying, ZHENG Fei, CUI Yanzhi. 2015.
- 晚期肺腺癌化疗方案的优化
- Optimized Chemotherapy Scheme for Advanced Lung Adenocarcinoma Patients
- 肿瘤防治研究, 2015, 42(07): 687-692
- Cancer Research on Prevention and Treatment, 2015, 42(07): 687-692
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.07.010
-
文章历史
- 收稿日期:2014-08-12
- 修回日期:2014-12-26
根据2014年非小细胞肺癌NCCN指南推荐,对于表皮生长因子受体(epithelial growth factor receptor,EGFR)突变阴性或者未知EGFR基因状态者,化疗的意义重大。NCCN还指出,非小细胞肺癌的组织学类型对于化疗方案的选择至关重要。可见化疗在治疗非小细胞肺癌过程中必不可少。
培美曲塞为一种多靶点抗叶酸制剂,因其有效性和良好的耐受性,在2008年9月被美国食品药品管理局(FDA)批准用于治疗晚期非小细胞肺癌。奈达铂是新一代铂剂,尚未纳入NCCN指南,但已有多项研究表明其治疗非小细胞肺癌有效。本研究通过对比三种不同化疗方案一线治疗晚期肺腺癌的疗效、不良反应及患者预后情况,从而为临床优化选择化疗方案提供依据。
1 资料与方法 1.1 资料来源收集2011年1月至2014年1月就诊于河北医科大学第四医院的141例ⅢB期或Ⅳ期初治肺腺癌患者的临床病例资料。141例患者均经病理学证实,且均存在影像学资料以提供可测病灶。临床资料包括:性别、年龄、吸烟史、慢性病史、确诊途径、首诊转移部位、化疗方案、用药途径及剂量、EGFR突变状态、化疗相关生化检查、疗效评价等。通过电话随访、收集住院复查病例进行随访。随访截止日期为2014年1月30日。
1.2 分组根据不同化疗方案分为培美曲塞+奈达铂、培美曲塞+顺铂/卡铂组、三代化疗药+顺铂/卡铂治疗组,其中三代化疗药包括:紫杉醇、多烯紫杉醇、长春瑞滨、吉西他滨。
1.3 患者情况患者年龄均大于18岁;不具有手术、放疗、分子靶向治疗指征或拒绝手术、放疗、分子靶向治疗;PS评分≤2分;化疗前化验血常规、肝肾功能、心功能均无明显异常。
1.4 给药剂量及途径所有药物均根据体表面积计算给药剂量。培美曲塞500 mg/m2,第1天,21天为1周期,并给予叶酸、VitB12和地塞米松。奈达铂80~100 mg/m2,第1天,21天为1周期,用药结束后给予1000 ml液体水化。顺铂75 mg/m2,分3~5天输注,21天为1周期,输注前后给予水化。卡铂AUC=5,第1天,21天为1周期。三代化疗药:(1)吉西他滨1 000~1 250 mg/m2第1、8天;多烯紫杉醇75 mg/m2,第1天;紫杉醇135~175 mg/m2,第1天,长春瑞滨25 mg/m2,第1、8天;所有三代化疗药均为21天1周期。(2)于输注多烯紫杉醇或紫杉醇前给予口服地塞米松。化疗期间给予药物减轻消化道反应、过敏反应,同时给予对症支持治疗。
1.5 评价标准所有患者至少进行同一化疗方案2~3周期后依据RECIST实体瘤近期疗效评价标准,对可测病灶进行疗效评价:完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD)。
1.6 观测指标客观缓解率(ORR)根据CR+PR计算。疾病控制率(DCR)根据CR+PR+SD计算。无进展生存期(PFS)指患者确诊至疾病第一次进展或死亡时间。通过对比三组方案的ORR、DCR及PFS,以分析三组方案的疗效情况。根据年龄、性别、吸烟史、器官转移数目、有无脑转移、有无慢性病(高血压、糖尿病、冠心病)、EGFR突变状态等几方面进行组内和组间亚组分析,从而了解影响药物疗效的因素。患者每周期化疗结束,下一周期化疗开始前化验血常规、肝肾功能、尿便常规、心电图和心脏彩超以评估不同方案的血液学毒性、肝肾毒性、心脏毒性等。若患者出现严重的骨髓抑制或肝肾损害,则给予相应对症治疗,重新进行化疗前评估后再开始下一周期化疗用药。根据WHO化疗不良反应分级标准记录每位患者每周期不良反应情况,最终采用患者在所有周期评估中最严重的分级进行数据分析,来对比不同化疗方案的不良反应发生率。
1.7 统计学方法应用SPSS13.0统计软件进行统计分析,比较不同药物疗效、影响疗效的因素分析、药物不良反应分析采用χ2检验或Fisher确切概率法。患者生存情况用Kaplan-Meier方法分析,用Log rank检验比较生存率。所得数据以P < 0.05为差异具有统计学意义。
2 结果 2.1 临床病例资料特点141例晚期肺腺癌患者,培美曲塞+奈达铂组共收集病例20例,培美曲塞+顺铂/卡铂组共40例,三代化疗药+顺铂/卡铂组共81例。发病年龄在30~77岁之间,中位年龄57岁。三组在器官转移数目构成比差异有统计学意义,在其他方面三组差异均无明显统计学意义,见表 1。
 |
141例晚期肺腺癌患者中,CR0例、PR32例、SD88例、PD21例,总ORR为22.7%,总DCR为77.3%。培美曲塞+奈达铂组患者最多完成5周期化疗,中位化疗周期数为3周期,CR0例、PR7例、SD11例、PD2例,ORR为35%,DCR为90%;培美曲塞+顺铂/卡铂组最多完成7周期化疗,中位化疗周期数为4周期,CR0例、PR10例、SD23例、PD7例,ORR为25%,DCR为82.5%;三代化疗药+顺铂/卡铂组最多完成8周期化疗,中位化疗周期数为4周期,CR0例、PR15例、SD54例、PD12例,ORR为18.52%,DCR为85.19%。培美曲塞+奈达铂治疗组ORR、DCR均明显高于其余两组,但三组治疗组间ORR、DCR对比差异无统计学意义。培美曲塞+奈达铂组与培美曲塞+顺铂/卡铂组对比ORR、DCR差异无统计学意义;培美曲塞+顺铂/卡铂组与三代化疗药+顺铂/卡铂组对比ORR前者高于后者,DCR相反,但差异均无统计学意义(P均>0.05),见表 2。
对三组患者的DCR分别根据性别、年龄、吸烟史、有无慢性病、器官转移数目、有无脑转移的情况进行分层分析,结果提示培美曲塞+奈达铂组内比较以及三组间分层分析DCR差异均无统计学意义,说明上述因素均不影响药物对患者治疗的疗效。
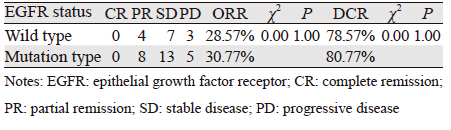
对应用培美曲塞联合铂剂治疗的60例患者病例资料进行统计,其中40例具有明确的EGFR突变检测结果,将此40例分为EGFR突变组和EGFR野生组,突变组患者拒绝口服EGFR-TKIs一线治疗。野生组患者的ORR为28.57%,DCR为78.57%;突变组患者的ORR为30.77%,DCR为80.77%。两组的ORR与DCR比较,差异均无统计学意义,但培美曲塞对突变型患者的疗效显示出稍好趋势,见表 3。
三个治疗组的主要不良反应均为血液学毒性,其中培美曲塞+奈达铂组白细胞减低、贫血、血小板减低发生率较其他两组明显减低,且主要为Ⅰ~Ⅱ度,三个治疗组间白细胞减低发生率差异具有统计学意义;培美曲塞+奈达铂组与培美曲塞+顺铂/卡铂组白细胞减低发生率间差异存在统计学意义;培美曲塞+顺铂/卡铂组白细胞减低发生率较三代化疗药+顺铂/卡铂组低,但两组间差异无统计学意义。培美曲塞+奈达铂方案的其余不良反应较其他两组的发生率也较低,但三组间对比、组间两两比较差异均无统计学意义,见表 4。
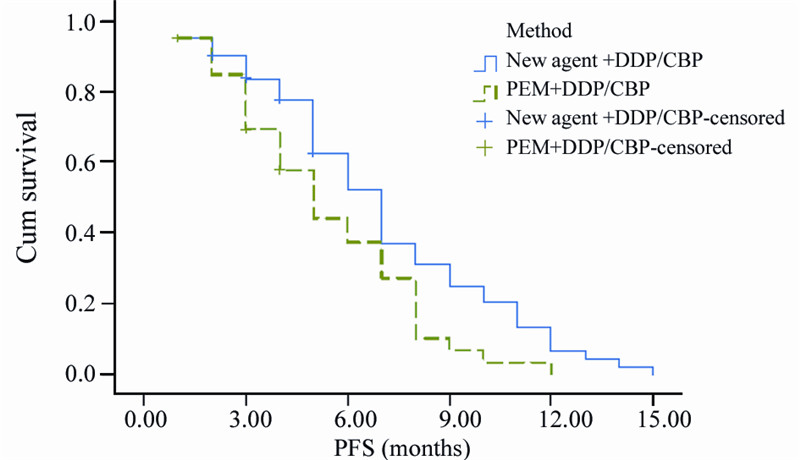
本研究随访至2014年1月30日,随访率为95.04%。培美曲塞+奈达铂治疗组中位PFS为8月,培美曲塞+顺铂/卡铂治疗组中位PFS为5月,三代化疗药+顺铂/卡铂治疗组中位PFS为7月,见表 5~6。培美曲塞+奈达铂组比培美曲塞+顺铂/卡铂组在中位PFS方面存在优势,差异具有统计学意义(P=0.027),见图 1。培美曲塞+顺铂/卡铂组与三代化疗药+顺铂/卡铂组间中位PFS比较,差异亦存在统计学意义(P=0.013),见图 2。
 |
 |

|
| 图 1 培美曲塞+奈达铂组与培美曲塞+顺铂/卡铂组间生存分析 Figure 1 Comparision of average PFS between Pemetrexed+Nedaplatin and Pemetrexed+Cisplatin/Carboplatin groups |
|
| 图 2 培美曲塞+顺/卡铂组与三代药+顺铂/卡铂组间生存分析 Figure 2 Comparision of average PFS between Pemetrexed+Cisplatin/Carboplatin and New agent+Cisplatin/Carboplatin groups |
肺腺癌占肺癌的40%,目前其发病率上升速度已明显快于鳞癌。肺腺癌早期诊断困难,发现肿瘤时患者多已出现远处转移,5年生存率低。
培美曲塞(Pemetrexed,PEM)是抗叶酸代谢类抗肿瘤药物。它通过抑制叶酸代谢过程中所需的3个关键酶(TS、DHFR、GARFT),多条途径抑制DNR和RNA的合成,从而抑制细胞增殖来抑制肿瘤生长[1]。奈达铂(Nedaplatin,NDP)是顺铂类似物,具有广谱抗瘤作用,水溶性是顺铂的100倍,肾毒性及消化道反应小,已被临床广为应用。目前尚无大型相关临床试验来证实培美曲塞联合奈达铂应用对非小细胞肺癌尤其是肺腺癌的疗效与安全性,本研究对此作一定观察以为临床医师选择治疗方案提供参考。
培美曲塞最初由FDA批准联合顺铂治疗恶性胸膜间皮瘤。2008年,JMDB研究结果提示对于非鳞NSCLC患者培美曲塞组PFS长于吉西他滨组(5.3月vs.4.7月,P>0.05);对于腺癌患者,培美曲塞组OS显著长于吉西他滨组(12.6月vs.10.9月,P=0.03)[2]。同年,培美曲塞联合顺铂方案即被FDA批准为治疗晚期非鳞癌的NSCLC一线方案。
我国胡兴胜等[3]进行了培美曲塞及吉西他滨分别联合顺铂治疗初治晚期NSCLC安全性和有效性的随机对照研究。研究发现,腺癌亚组培美曲塞组ORR为29.79%,吉西他滨组为17.05%,P=0.036;非鳞癌患者两组PFS分别为6.6月和5.1月,但PFS在两组差异均无统计学意义。另一由黄岩等[4]进行的类似研究:培美曲塞联合顺铂对比吉西他滨联合顺铂一线治疗晚期非鳞非小细胞肺癌显示出相似结果。其分析得出:PP组与GP组患者的ORR分别为24.4%和14.2%,P=0.06;中位PFS分别为5.6月和4.7月,P=0.16。以上两个研究结果说明,培美曲塞联合顺铂治疗晚期肺腺癌患者,其疗效均显示出优于三代化疗药的倾向。
本研究和上述两个研究相比,培美曲塞+顺铂/卡铂组相比三代化疗药物+顺铂/卡铂组在ORR方面存在一定优势趋势,三个研究的结果基本一致。在PFS方面,上述我国两个大型研究结果[3, 4]与JMDB结果基本一致,但本研究与之相反,表现为培美曲塞+顺铂/卡铂组较三代化疗药+顺铂/卡铂组的PFS短。考虑可能与以下因素相关:(1)本研究中培美曲塞+顺铂/卡铂与三代化疗药+顺铂/卡铂组中顺铂与卡铂在本组内所占比例不同。(2)培美曲塞+顺铂/卡铂组器官转移数目>4的患者构成比高于三代化疗药+顺铂/卡铂组,即培美曲塞+顺铂/卡铂组病例转移部位多;(3)本研究为回顾性小样本研究,纳入病例总数偏少,各组病例数不完全均等。
奈达铂于1995年在日本上市以来,临床已应用于多种实体瘤的治疗。有关奈达铂在肺癌方面的应用,国内外许多学者对其进行了临床研究。蔡友鹏等[5]将(紫杉醇+顺铂,TP)与(紫杉醇+奈达铂,TN)治疗晚期NSCLC进行对比观察。结果提示两组的ORR、PFS差异均无统计学意义,奈达铂治疗晚期NSCLC的有效率不低于顺铂。Yang等[6]将吉西他滨分别联合奈达铂(GN)与卡铂(GC)对进展期NSCLC疗效和安全性进行比较,GN组ORR为37.5%、PFS为6月;GC组ORR为24%、PFS为5月,虽然两组ORR与PFS差异无统计学意义,但可以大体看出奈达铂相对于卡铂在疗效及生存方面具有更好的趋势。
廖国清等[7]对比培美曲塞+奈达铂与多西他赛+奈达铂方案对晚期肺腺癌的治疗效果。分别入组109例与116例晚期肺腺癌患者,给予2~3周期相应方案化疗评价疗效,结果显示:两组ORR分别为42.20%和33.62%,DCR分别为77.06%和63.79%,差异均有统计学意义。本研究中培美曲塞+奈达铂方案的ORR与DCR分别35%与90%,与廖国清等的研究在ORR方面相似,在DCR上明显优于其结果,可能是因为本研究均为肺腺癌晚期初治病例,患者一般情况良好,而上述研究未明确区分入组患者的既往治疗情况。
有许多研究表明,EGFR突变状态会对培美曲塞治疗晚期肺腺癌的效果及预后产生影响,但现有数据尚未提供统一结论。Wu等[8]对156例进展期肺腺癌患者EGFR突变状态与应用培美曲塞治疗疗效相关性进行分析,结果表明突变型较野生型具有更好的缓解率及更长的生存期,差异存在统计学意义。Giovannetti等[9]的研究表明不同NSCLC细胞系的TS基因表达水平不同,存在EGFR突变的H1650细胞系其TS基因表达水平低于EGFR野生型NSCLC细胞系。由此可能推断,EGFR突变的NSCLC细胞可能对培美曲塞更为敏感。本研究对应用培美曲塞联合铂剂一线化疗的病例进行分析,结果表明突变型患者一线应用培美曲塞的疗效存在优于野生型的倾向,与上述研究结论基本相似。
JMDB研究[2]中培美曲塞+顺铂组的3/4度中性粒细胞减少、贫血和血小板减少、脱发等不良反应的发生率较吉西他滨+顺铂明显降低,恶心呕吐等消化道反应两组发生率相当。胡兴盛、黄岩等[3, 4]研究结果与JMDB基本一致。由此可见,培美曲塞治疗晚期肺腺癌较其他三代化疗药不仅在疗效上显示出优势,在不良反应方面其安全性也更好。铂剂方面,蔡友鹏等[5]将紫杉醇+顺铂与紫杉醇+奈达铂对比,后者在恶心呕吐、肾功能异常及肌肉酸痛方面发生率更低(P < 0.05)。Yang等[6]对比吉西他滨+卡铂与吉西他滨+奈达铂治疗NSCLC的不良反应后发现两组主要不良反应均为血液学毒性,次要不良反应为恶心、中性粒细胞减少性发热及脱发,但两组差异均无统计学意义。廖国清等[7]在对比培美曲塞+奈达铂与多西他赛+奈达铂治疗晚期肺腺癌的研究中得出:不良反应发生率较高的是白细胞下降、贫血和血小板下降,而肝肾功能损害较为少见,恶心、呕吐和食欲不振的发生率较低,但两组差异无统计学意义。本研究中,培美曲塞+奈达铂主要不良反应为血液学毒性,与其结果一致。
本研究从客观有效率、疾病控制率、无进展生存期、药物影响因素及不良反应几方面对培美曲塞+奈达铂、培美曲塞+顺铂/卡铂、三代化疗药+顺铂/卡铂三个治疗组病例资料进行统计分析,可以得出培美曲塞+奈达铂方案治疗ⅢB期或Ⅳ期肺腺癌患者效果显示出更好的倾向,不良反应相对轻微,生存期存在优势。对于一般情况差的患者,如条件允许,临床医师可以酌情首选此方案进行治疗。但本研究存在纳入病例数偏少、病例分组不均匀、随访时间短等不足,尚需要多中心大样本临床研究,为临床医师提供更确凿的证据。
| [1] | Schuette WH, Gröschel A, Sebastian M, et al.A randomized phase Ⅱ study of pemetrexed in combination with cisplatin or carboplatin as first-line therapy for patients with locally advanced or metastatic non-small-cell lung cancer[J]. Clin Lung Cancer, 2013, 14(3):215-23. |
| [2] | Scagliotti GV, Parikh P, von Pawel J, et al.PhaseⅢ study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer[J]. J Clin Oncol, 2008, 26(21):3543-51. |
| [3] | Hu XS, Jiao SC, Zhang SC, et al.Efficacy and toxicity of pemetrexed or gemcitabine combined with cisplatin in the treatment of patients with advanced non-small cell lung cancer[J]. Zhongguo Fei Ai Za Zhi, 2012, 15(10):569-75.[胡兴胜,焦顺昌,张树才,等.培美曲塞及吉西他滨分别联合顺铂治疗初治晚期非小细胞肺癌安全性和有效性的随机对照研究[J].中国肺癌杂志, 2012, 15(10):569-75.] |
| [4] | Huang Y, Liu YP, Zhou JY, et al.A Randomized, controlled, uulticenter clinical trial comparing pemetrexed/cisplatin and gemcitabine/cisplatin as first-line treatment for advanced nonsquamous non-small cell lung cancer[J]. Zhongguo Fei Ai Za Zhi, 2012, 15(10):576-82.[黄岩,刘云鹏,周建英,等.培美曲塞联合顺铂对比吉西他滨联合顺铂一线治疗晚期非鳞非小细胞肺癌的随机、对照、多中心临床研究[J].中国肺癌杂志, 2012, 15(10):576-82.] |
| [5] | Cai YP, Xu S, Lin SJ.Comparison of outcomes of Taxol+Cisplatin and Taxol+Nedaplatin chemotherapy regimens for advanced non-small cell lung cancer[J]. Zhonghua Zhong Liu Za Zhi, 2010, 32(1):74-5.[蔡友鹏,许慎,林淑君.紫杉醇和顺铂与紫杉醇和奈达铂治疗晚期非小细胞肺癌的对比观察[J].中华肿瘤杂志, 2010, 32(1):74-5.] |
| [6] | Yang JJ, Zhou Q, Liao RQ, et al.Nedaplatin/gemcitabine versus carboplatin/gemcitabine in treatment of advanced non-small cell lung gancer:a randomized clinical trial[J]. Chin J Cancer Res, 2012, 24(2):97-102. |
| [7] | Liao GQ, Liu PH, Wang HM, et al.Clinical observation of efficacy of pemetrexed plus nedaplatin in treatment of patients with advanced lung adenocacinoma[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2012, 19(4):300-2.[廖国清,刘鹏辉,王红梅,等.培美曲塞二钠联合奈达铂治疗晚期肺腺癌的临床研究[J].中华肿瘤防治杂志, 2012, 19(4):300-2.] |
| [8] | Wu SG, Yang CH, Yu CJ, et al.Good response to pemetrexed in patients of lung adenocarcinoma with epidermal growth factor receptor (EGFR) mutations[J]. Lung Cancer, 2011, 72(3):333-9. |
| [9] | Giovannetti E, Lemos C, Tekle C, et al.Molecular mechanisms underlying the synergistic interaction of erlotinib, an epidermal growth factor receptor tyrosine kinase inhibitor, with the multitargeted antifolate pemetrexed in non-small-cell lung cancer cells[J]. Mol Pharmacol, 2008, 73(4):1290-300. |
 2015, Vol. 42
2015, Vol. 42