文章信息
- 刘龙静,李桂生,陈海辉. 2015.
- LIU Longjing, LI Guisheng, CHEN Haihui. 2015.
- XRCC1单核苷酸多态性与鼻咽癌铂类化疗敏感度的相关性
- Correlation of DNA Repair Gene XRCC1 Single Nucleotide Polymorphism with Sensitivity of Nasopharyngeal Carcinoma Patients to Platinum Chemotherapy
- 肿瘤防治研究, 2015, 42(07): 681-686
- Cancer Research on Prevention and Treatment, 2015, 42(07): 681-686
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.07.009
-
文章历史
- 收稿日期:2014-05-07
- 修回日期:2014-09-04
鼻咽癌(nasopharyngeal cancer,NPC)是我国常见的恶性肿瘤之一。对于局部晚期鼻咽癌,单纯放疗基础上加化疗,可使患者死亡风险降低18%,5年生存率比单纯放疗提高4%~6%[1, 2, 3],虽然可使局部控制率和远处转移率明显改善[1, 3, 4, 5],但仍有一部分患者不能从以铂类为基础的化疗中获益。
X射线交错互补修复基因1(X-ray repair crosscomplementing gene 1,XRCC1)广泛参与DNA损伤后的单链断裂修复和碱基切除修复[6],研究表明:DNA修复基因的单核苷酸多态性(single nucleotide polymorphism,SNP)能显著影响不同个体对药物治疗的敏感度[7]。DNA修复基因的SNP与细胞的DNA修复和细胞周期的调控相关,并影响其修复效率,显著影响肿瘤患者的治疗效果[8, 9, 10, 11]。有研究证明[12],肿瘤组织中DNA损伤修复基因呈低水平表达,能够减少铂类药物和DNA复合物的接触,增强化疗的敏感度。目前国内外针对鼻咽癌铂类化疗疗效与XRCC1基因多态性的研究甚少。因此我们设计了这项前瞻性研究,分析SNP与鼻咽癌铂类诱导化疗敏感度之间的关系,甄选出携带对铂类敏感的基因型患者,为鼻咽癌患者的个体化治疗提供一定的理论依据。
1 资料与方法 1.1 病例资料收集2012年9月1日至2013年12月31日在广西医科大学第四附属医院肿瘤科住院的初治鼻咽癌患者资料。对符合入选条件的患者,记录性别、年龄、TNM分期(采用中国鼻咽癌分期委员会制定的2008年鼻咽癌分期标准)、临床疗效。所有入组患者首次化疗前抽取2 ml静脉血置于EDTA抗凝管中,-80℃低温箱保存备用。
1.1.1 病例入选标准(1)局部晚期(Ⅲ/Ⅳa期)鼻咽癌;(2)鼻咽病理组织学诊断为未分化型非角化性鼻咽癌患者;(3)活检前均未进行放疗或化疗;(4)所有患者均接受2周期PF方案诱导化疗;(5) PS≤2分或者Karnofsky≥70分;预计生存期≥3月;(6)至少有1个可经CT或MRI测量的肿瘤病灶;(7)无明显的主要器官功能损害;(8)无其他恶性肿瘤病史;(9)年龄≥18岁。
1.1.2 病例排除标准(1)治疗前即有远处转移;(2)合并严重内科疾病;(3)双重癌;(4)曾接受放化疗;(5)无法满足随访;(6)数据大量缺失或不全。
1.2 治疗方法 1.2.1化疗方案及疗效评价入组患者均接受2周期顺铂(Cisplatin,DDP)+5-Fu方案(PF方案)诱导化疗,诱导化疗前未行任何其他抗肿瘤治疗。化疗药物具体用量:DDP (75 mg/m2)静脉滴注d1,5-Fu (500 mg/m2)静脉滴注d1~5 21天为1周期。2周期化疗后即放疗前,复查鼻咽部及颈部MRI平扫+增强,参照RICEST 1.1实体瘤疗效评定标准评价疗效,分为4种结果:完全缓解(complete response,CR)、部分缓解(partial response,PR)、稳定(stable disease,SD)和进展(progressive disease,PD)。CR+PR为治疗敏感组,SD+PD为治疗不敏感组。
1.2.2 XRCC1基因检测分型采用限制性片段长度多态性聚合酶链反应(polymerasechain reaction-restriction fragment length polymorphism,PCR-RFLP)技术进行基因分型。引物由上海生工生物工程股份有限公司合成。聚合酶链式反应(polymerase chain reaction,PCR)分别扩增含XRCC1 codon194和codon399多态位点的DNA片段。前者的引物为5'-GCCAGGGCCCCTCCTTCAA-3'和5'-TACCCT CAGACCCACGAGT-3',后者的引物为5'-TCCT CCACCTTGTGCTTTCT-3'和5'-AGTAGTCTGCT GGCTCTGGG-3'。PCR反应体系:25 μl PCR混合液中含0.1 μg模板DNA、0.4 μmol/L各引物、0.1 mmol/L dNTP、1.5 mmol/L MgCl2、1.0 U Taq聚合酶及其1×反应缓冲液。PCR条件:95℃预变性5 min后,于95℃ 30 s,61℃ 30 s和72℃ 45 s进行35个循环,最后72℃延伸10 min。分别取5 μl XRCC1 codon194或codon399的PCR产物与限制性核酸内切酶PvuⅡ或NciⅠ于37℃温育过夜。取6 μl PCR产物加入2.0%琼脂糖凝胶胶孔,并在第一孔中加入5 μl 50 bp DNA Ladder Marker作为标准参照物,将凝胶放在l×TBE电泳缓冲液中,120 V恒压条件下水平电泳40 min。电泳结束后,取出琼脂糖凝胶置于紫外光观察仪下观察、摄片并记录基因分型结果。XRCC1 194位点密码子Arg→Trp突变后可被限制性核酸内切酶PvuⅡ识别,酶切产物有396 bp和89 bp两个片段;杂合子则产生485 bp、396 bp和89 bp三个片段;而野生型只有485 bp一个片段。含399位点的PCR产物经限制性核酸内切酶NciⅠ切后产生384 bp和133 bp两个片段;Arg→Gln突变后失去酶切位点只有517 bp一个片段;杂合子则含517 bp、384 bp和133 bp三个片段。从标本中随机抽取各基因型PCR产物各3例,送上海生工生物工程技术服务有限公司行PCR产物测序,验证是否为目的基因及PCR-RFLP技术分型的准确性。
1.3 统计学方法采用SPSS17.0软件进行统计学处理。以χ2检验比较各基因型化疗敏感度的差异,以比值比(Odds ratio,OR)及其95%可信区间(95% CI)表示相对危险度,P < 0.05为差异有统计学意义,以拟合优度χ2检验明确各个基因型是否符合群体遗传学Hardy-Weinberg平衡,P < 0.1为差异有统计学意义,以上均为双侧检验。
2 结果 2.1 病例最终入组情况共收集符合条件的鼻咽癌患者158例,剔除未完成2周期化疗、合并严重内科疾病、双重癌共5例,入组病例为153例,对其进行临床病理资料登记并随访至2014年1月31日,共随访153例并获完整资料,建立患者临床资料Excel数据库。入组患者年龄18~67岁(中位年龄47岁),患者临床资料见表 1。
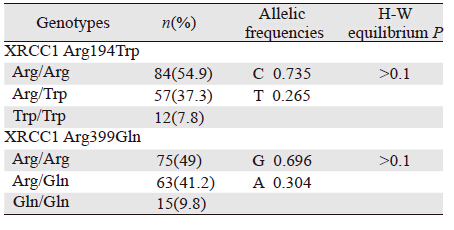
153例患者基因分型均明确,见表 2,电泳图见图 1。基因型分布均符合群体遗传学Hardy-Weinberg平衡(P>0.1)。

|
| M: DNA marker; 1: Arg/Arg homozygote; 2: Arg/Trp heterozygote; 3: Trp/Trp homozygote; 4: Arg/Arg homozygote; 5: Gln/Gln homozygote; 6: Arg/Gln heterzygote; A: The three fragments of XRCC1 codon194 incised by PvuⅡ restriction enzyme were 485bp, 396bp, 89bp, respectively; B: the three fragments of XRCC1 codon399 incised by Nci Ⅰ restriction enzyme were 517bp, 384bp, 133bp, respectively 图 1 PCR产物经限制性酶切后琼脂糖凝胶电泳图谱 Figure 1 Agarose gel electrophoretogram of XRCC1 genotypes using PCR-RFLP |
XRCC1 codon194和codon399的SNP与铂类化疗敏感度的关系,见表 3、4。进一步分析可见:XRCC1 194Arg/Arg、Arg/Trp、Trp/Trp基因型两两比较,化疗敏感度差异无明显统计学意义(P>0.05),XRCC1 codon399 Gln/Gln基因型化疗敏感度明显高于Arg/Arg基因型,其化疗敏感度为Arg/Arg基因型的3.500倍(P < 0.05,95% CI=1.021~11.997)。不含Arg基因型(Gln/Gln)化疗敏感度为含Arg基因型(Arg/Arg和Arg/Gln)的3.274倍(P < 0.05,95% CI:0.994~10.787)。
 |
 |
鼻咽癌是我国南方常见的肿瘤,在临床实践中,诱导化疗主要用于局部晚期鼻咽癌患者[13, 14]。随着近年来药物遗传学研究的快速进展,在一些肿瘤中发现,产生药物敏感度的差异与所用药物代谢相关基因的多态性和相关酶在人体内活性水平差异有关,因此在临床上表现出治疗效果的明显不同[15, 16]。提示我们可以从药物基因组学的角度去检测不同患者之间的药物敏感度的差异,寻找可靠的药物敏感度预测指标可指导临床个体化的治疗。
个体DNA损伤修复能力的差异可能是决定铂类药物敏感度的重要因素,如果肿瘤细胞修复能力强,这类药物的疗效则差,反之疗效则好[17]。目前发现,DNA修复基因的SNP可导致相应的DNA修复蛋白数量或活性改变,引起不同个体对肿瘤易感性的差异。因此个体间DNA修复功能的差异一定程度上取决于DNA修复基因的SNP。XRCC1是第一个分离到的影响细胞对电离辐射敏感度的哺乳动物基因。XRCC1作为脚手架蛋白,通过直接与聚合酶β、DNA连接酶Ⅲ和多聚ADP核糖聚合酶形成复合物[18],广泛参与离子辐射和化学诱变剂所致DNA损伤后的单链断裂修复(single strand break repair,SSBR)和碱基切除修复。目前在XRCC1中主要报道的3个位点,分别位于第6、9和10外显子中,依次为C26304T、G27466A和G28152A,其SNP分别导致相应氨基酸残基的改变(Arg194Trp、Arg280His、Arg399Gln)[19],这些变异可能影响XRCC1蛋白的活性,可能是导致个体间修复能力的差异原因。一些研究报告显示XRCC1 codon399位点的SNP不仅与非小细胞肺癌[20]、乳腺癌[21]、皮肤癌[22]、尿路上皮癌[23]等多种肿瘤的高风险有关联,还与铂类药物对多种肿瘤疗效有关。但目前研究显示,在不同肿瘤中甚至同一种肿瘤中其对化疗疗效的影响也存在研究结果不一致的情况。Cui等[24]对肺癌患者研究显示:携带XRCC1 399 Arg/Arg基因型患者对铂类化疗反应率高于携带399 Arg/Gln和Gln/Gln基因型患者。Kalikaki等[25]对晚期非小细胞肺癌研究显示,XRCC1 399位点单核苷酸多态性与铂类化疗反应率无关。Stoehlmacher等[26]分析了XRCC1 Arg399Gln基因多态对奥沙利铂加5-Fu治疗晚期结肠癌疗效的影响,发现Arg/Arg基因型的患者对化疗敏感,而Gln/Gln或Gln/Arg基因型对化疗不敏感。2013年Chen等[27]针对101例接受铂类治疗的复发或者转移鼻咽癌患者进行研究,激光解析/电离飞行时间质谱分析检测SNP,发现:XRCC1 Arg399 Gln和XRCC1 Arg280His与反应率、疾病进展及缓解无关。2006年Quintela-Fandino等[28]报道:103例头颈部鳞癌患者接受以顺铂为基础的化疗方案,PCR-RFLP检测XRCC1 codon399 SNP,结果显示头颈部鳞癌中XRCC1 codon399携带Gln的基因型者化疗有效率更高、生存期更长。本研究显示:XRCC1 codon399 Gln/Gln基因型化疗有效率明显高于Arg/Arg基因型,不含Arg基因型(Gln/Gln)化疗有效率高于含Arg基因型(Arg/Arg和Arg/Gln),与Quintela-Fandino等研究结论一致,但与Chen结论不符合,考虑产生差异的原因为:Chen等的研究对象为晚期或者复发鼻咽癌患者。复发患者既往接受过治疗,且采用4种不同的含有铂类的化疗方案,以上干扰因素可影响化疗结果准确性。本研究入组人群为局部晚期鼻咽癌患者,采用统一化疗方案,相对前者干扰因素更少。本研究结果与Cui、Kalikaki、Stoehlmache等研究结果不一致。考虑差异产生原因为肿瘤类型、人群选择、基因检测方法、化疗方案差异所致,目前关于鼻咽癌铂类化疗敏感度同类研究数量不多,有待更大规模研究进一步证实。
目前有关XRCC1 codon194位点的研究显示在不同肿瘤中甚至同一种肿瘤中其对化疗疗效的影响也存在结果不一致的情况。Hong等[29]研究结果显示,非小细胞肺癌XRCC1 codon194 SNP与非小细胞肺癌患者铂类化疗药物的敏感度相关。Wang等[30]研究显示:194Arg/Trp或Trp/Trp基因型化疗有效率明显高于Arg/Arg基因型。2006年Ruzzo等[31]使用顺铂+5-Fu方案对175例进展期胃癌行姑息化疗,PCR-RFLP方法检测XRCC1 codon194位点SNP,发现化疗疗效与SNP无明显相关性。2012年Cui等[24]关于肺癌的Meta分析显示:XRCC1 codon194中携带C/T (Arg/Trp)、T/T (Trp/Trp)基因型者较C/C (Arg/Arg)型对以顺铂为基础的化疗反应率更高。目前鼻咽癌中未见有相同研究。本研究发现XRCC1 codon194位点SNP各基因型间铂类近期化疗敏感度差异无统计学意义(P>0.05)。与Ruzzo等研究结果相符合。虽然两个研究使用的化疗方案、SNP检测方法相同,但两者为不同部位肿瘤,鼻咽癌以鳞癌多见,胃癌以腺癌多见,可比性不强。本研究结论与Wang、Cui等研究结论不一致的原因考虑为:针对两种不同部位的肿瘤,化疗方案不一致,故对比性不强。结论差异可能来自本实验本身样本量较小,试验方法不够精确有关,亦有待更大样本进一步验证。
综上所述,XRCC1 codon399单核苷酸多态性与局部晚期鼻咽癌铂类化疗敏感度之间存在关联,携带Gln/Gln基因型的患者有更高的化疗敏感度。XRCC1 codon399单核苷酸多态性有可能成为鼻咽癌铂类化疗敏感度的预测因子。XRCC1 codon194单核苷酸多态性与局部晚期鼻咽癌铂类化疗敏感度之间无明显相关性。由于本研究样本量较小,且不能完全排除氟尿嘧啶对化疗效果的影响。有必要进一步扩大样本量、排除其他干扰因素,使研究结果更准确,为鼻咽癌个体化治疗提供更有力的理论支持。
| [1] | Chen Y, Liu MZ, Liang SB, et al.Preliminary results of a prospective randomized trial comparing concurrent chemoradiotherapy plus adjuvant chemotherapy with radiotherapy alone in patients with locoregionally advanced nasopharyngeal carcinoma in endemic regions of China[J]. Int J Radiat Oncol Biol Phys, 2008, 71(5):1356-64. |
| [2] | Baujat B, Audry H, Bourhis J, et al.Chemotherapy in locally advanced nasopharyngeal carcinoma:an individual patient data meta-analysis of eight randomized trials and 1753 patients[J]. Inter J Radiat Oncol Biol Phys, 2006, 64(1):47-56. |
| [3] | Lee AW, Tung SY, Chua DT, et al.Randomized trial of radiotherapy plus concurrent-adjuvant chemotherapy vs radiotherapy alone for regionally advanced nasopharyngeal carcinoma[J]. J Natl Cancer Inst, 2010, 102(15):1188-98. |
| [4] | Wee J, Tan EH, Tai BC, et al.Randomized trial of radiotherapy versus concurrent chemoradiotherapy followed by adjuvant chemotherapy in patients with American Joint Committee on Cancer/International Union against cancer stage Ⅲ and Ⅳ nasopharyngeal cancer of the endemic variety[J]. J Clin Oncol, 2005, 23(27):6730-8. |
| [5] | Lee AW, Lau WH, Tung SY, et al.Preliminary results of a randomized study on therapeutic gain by concurrent chemotherapy for regionally-advanced nasopharyngeal carcinoma:NPC-9901 Trial by the Hong Kong Nasopharyngeal Cancer Study Group[J]. J Clin Oncol, 2005, 23(28):6966-75. |
| [6] | Fang Q, Inanc B, Schamus S, et al.HSP90 regulates DNA repair via the interaction between XRCC1 and DNA polymerase beta[J]. Nature Communications, 2014, 5:5513. |
| [7] | Weinshilboum R.Inheritance and drug response[J]. N Engl J Med, 2003, 348(6):529-37. |
| [8] | Jiang J, Liang J, Yao R, et al.Polymorphisms of ERCC1, XPD, XRCC1 and XPG predict clinical outcome in advanced gastric cancer patients receiving oxaliplatin-based chemotherapy in Chinese population[J]. Clin Oncol Cancer Res, 2009, 6(5): 328-36. |
| [9] | Wei SZ, Zhan P, Shi MQ, et al.Predictive value of ERCC1 and XPD polymorphism in patients with advanced non-small cell lung cancer receiving platinum-based chemotherapy:a systematic review and meta-analysis[J]. Med Oncol, 2011, 28(1):315-21. |
| [10] | Liu L, Yuan P, Wu C, et al.Assessment of XPD Lys751Gln and XRCC1 T-77C polymorphisms in advanced non-small-cell lung cancer patients treated with platinum-based chemotherapy[J]. Lung Cancer, 2011, 73(1):110-5. |
| [11] | Artac M, Bozcuk H, Pehlivan S, et al.The value of XPD and XRCC1 genotype polymorphisms to predict clinical outcome in metastatic colorectal carcinoma patients with irinotecan-based regimens[J]. J Cancer Res Clin Oncol, 2010, 136(6):803-9. |
| [12] | Gurubhagavatula S, Liu G, Park S, et al.XPD and XRCC1 genetic polymorphisms are prognostic factors in advanced non-small-cell lung cancer patients treated with platinum chemotherapy[J]. J Clin Oncol, 2004, 22(13):2594-601. |
| [13] | Kong L, Zhang YW, Hu CS, et al.Neoadjuvant chemotherapy followed by concurrent chemoradiation for locally advanced nasopharyngeal carcinoma[J]. Chin J Cancer, 2010, 29(5):551-5. |
| [14] | Airoldi M, Gabriele P, Gabriele AM, et al.Induction chemotherapy with carboplatin and taxol followed by radiotherapy and concurrent weekly carboplatin+taxol in locally advanced nasopharyngeal carcinoma[J]. Cancer Chemother Pharmacol, 2011, 67(5):1027-34. |
| [15] | Lu X, Xiao S, Jin C, et al.ERCC1 and XPD/ERCC2 polymorphisms'predictive value of oxaliplatin-based chemotherapies in advanced colorectal cancer has an ethnic discrepancy:a meta-analysis[J]. J Clin Lab Anal, 2012, 26(1): 10-5. |
| [16] | Panczyk M.Pharmacogenetics research on chemotherapy resistance in colorectal cancer over the last 20 years[J]. World J Gastroenterol, 2014, 20(29):9775-827. |
| [17] | Jayachandran G, Ueda K, Wang B, et al.NPRL2 sensitizes human non-small cell lung cancer (NSCLC) cells to cisplatin treatment by regulating key components in the DNA repair pathway[J]. PloS One, 2010, 5(8):e11994. |
| [18] | Caldecott KW, Aoufouchi S, Johnson P, et al.XRCC1 polypeptide interacts with DNA polymerase beta and possibly poly (ADPribose) polymerase, and DNA ligase Ⅲ is a novel molecular'nicksensor' in vitro[J]. Nucleic Acids Res, 1996, 24(22):4387-94. |
| [19] | Shen MR, Jones IM, Mohrenweiser H.Nonconservative aminoacid substitution variants exist at polymorphic frequency in DNA repair genes in healthy humans[J]. Cancer Res, 1998, 58(4):604-8. |
| [20] | Du Y, He Y, Mei Z, et al.Association between genetic polymorphisms in XPD and XRCC1 genes and risks of non-small cell lung cancer in East Chinese Han population[J]. Clin Respir J, 2014.[Epub ahead of print] |
| [21] | Ramadan RA, Desouky LM, Elnaggar MA, et al.Association of DNA repair genes XRCC1(Arg399Gln), (Arg194Trp) and XRCC3(Thr241Met) polymorphisms with the risk of breast cancer:a case-control study in Egypt[J]. Genet Test Mol Biomarkers, 2014, 18(11):754-60. |
| [22] | Surdu S, Fitzgerald EF, Bloom MS, et al.Polymorphisms in DNA repair genes XRCC1 and XRCC3, occupational exposure to arsenic and sunlight, and the risk of non-melanoma skin cancer in a European case-control study[J]. Environ Res, 2014, 134:382-9. |
| [23] | Chiang CI, Huang YL, Chen WJ, et al.XRCC1 Arg194Trp and Arg399Gln polymorphisms and arsenic methylation capacity are associated with urothelial carcinoma[J]. Toxicol Appl Pharmacol. 2014, 279(3):373-9. |
| [24] | Cui Z, Yin Z, Li X, et al.Association between polymorphisms in XRCC1 gene and clinical outcomes of patients with lung cancer: a meta-analysis[J]. BMC Cancer, 2012, 12:71. |
| [25] | Kalikaki A, Kanaki M, Vassalou H, et al.DNA repair gene polymorphisms predict favorable clinical outcome in advanced non-small-cell lung cancer[J]. Clin Lung Cancer, 2009, 10(2): 118-23. |
| [26] | Stoehlmacher J, Ghaderi V, Iobal S, et al.A polymorphism of the XRCC1 gene predicts for response to platinum based treatment in advanced colorectal cancer[J]. Anticancer Res, 2001, 21(4B): 3075-9. |
| [27] | Chen C, Wang F, Wang Z, et al.Polymorphisms in ERCC1 C8092A predict progression-free survival in metastatic/recurrent nasopharyngeal carcinoma treated with cisplatin-based chemotherapy[J]. Cancer Chemother Pharmacol, 2013, 72(2): 315-22. |
| [28] | Quintela-Fandino M, Hitt R, Medina PP, et al.DNA-repair gene polymorphisms predict favorable clinical outcome among patients with advanced squamous cell carcinoma of the head and neck treated with cisplatin-based induction chemotherapy[J]. J Clin Oncol, 2006, 24(26):4333-9. |
| [29] | Hong CY, Xu Q, Yue Z, et al.Correlation of the sensitivity of NP chemotherapy in non-small lung cancer with DNA repair gene XRCC1 polymorphism[J]. Ai Zheng, 2009, 28(12):1291-7.[洪成雨, 徐倩, 岳峥, 等.非小细胞肺癌NP方案化疗敏感性与DNA修 复基因XRCC1多态性的关系[J]. 癌症, 2009, 28(12):1291-7.] |
| [30] | Wang ZH, Miao XP, Tan W, et al.Single nucleotide polymorphisms in XRCC1 and clinical response to platin-based chemotherapy in advanced non-small cell lung cancer[J]. Ai Zheng, 2004, 23(8):865-8.[王中华, 缪小平, 谭文, 等.XRCC1 单核苷酸多态与晚期非小细胞肺癌对铂类药物化疗敏感性的相关性[J]. 癌症, 2004, 23(8):865-8.] |
| [31] | Ruzzo A, Graziano F, Kawakami K, et al.Pharmacogenetic profiling and clinical outcome of patients with advanced gastric cancer treated with palliative chemotherapy[J]. J Clin Oncol, 2006, 24(12):1883-91. |
 2015, Vol. 42
2015, Vol. 42