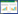文章信息
- 高剑坤,龙波,曾彬,唐旭. 2015.
- GAO Jiankun, LONG Bo, ZENG Bin, TANG Xu. 2015.
- 出核因子CRM1抑制剂KPT-185对人前列腺癌细胞生长的影响
- Effect of CRM1 Inhibitor KPT-185 on Growth of Human Prostate Cancer Cells
- 肿瘤防治研究, 2015, 42(07): 676-680
- Cancer Research on Prevention and Treatment, 2015, 42(07): 676-680
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.07.008
-
文章历史
- 收稿日期:2014-07-21
- 修回日期:2014-09-06
2. 621000 绵阳,绵阳市404医院感染科
2. Section of Infectious Diseases, Mianyang 404 Hospital, Mianyang 621000, China
核内蛋白输出,对于保持核质中各种转录因子、信号分子以及细胞周期调控因子的恰当分布起着关键作用,是所有真核细胞的基本功能,核蛋白主要由出核因子(chromosome maintenance region1,CRM1)也被称为exportin1或Xpo1进行调节[1, 2, 3, 4, 5],经核孔复合体从核内转运到核外。CRM1是核转运受体中的输入因子β超家族的成员,能识别富含亮氨酸的核输出序列(nuclear export sequence,NES)的蛋白质[6]。CRM1/exportin1既是低等真核细胞又是高等真核细胞NES的受体,对于抑癌蛋白如p53、p21、FOXO等的核质运输起着重要作用[7]。多种抑癌蛋白需要在核内才具有抑癌活性或对化疗药物作出应答。阻断这些蛋白的核输出能抑制肿瘤细胞的生长或诱导凋亡,可作为一种肿瘤治疗策略[8]。因此,CRM1可作为治疗靶标用以设计抗癌药物。本文将介绍运用结构设计和高通量筛选而合成的新型CRM1抑制剂:KPT-185[9]的体外抗前列腺癌特性及其可能的分子机制。
1 材料与方法 1.1 材料人前列腺癌细胞株PC-3和DU-145购于美国ATCC细胞库,培养在含10% FBS的RPMI 1640培养液中。p53和p21抗体购于美国Cell signaling公司。二抗购于美国Sigma公司。KPT-185由美国Karyopharm Therapeutic公司设计、合成并纯化。
1.2 方法 1.2.1 生长抑制检测分别将1×106个PC-3和DU-145细胞种植于100 mm培养皿,培养过夜后加入不同浓度的KPT-185,48 h后对存活细胞计数。同时采用MTT法检测KPT-185对前列腺癌细胞的体外生长抑制。以5×103个/孔密度将PC-3和DU-145接种于96孔培养板,培养24 h后加入不同浓度KPT-185处理细胞,另设空白对照组,72 h后每孔加入10 μl,5 mg/ml溶于PBS的MTT (Sigma)试剂。37℃、5% CO2孵箱孵育2 h,每个浓度设3个复孔。使用TECAN酶标仪(TECAN,Switzerland)595 nm测量荧光值[9]。此外,还采用了细胞集落形成能力测定法检测KPT-185对前列腺癌细胞的生长影响。
1.2.2 细胞集落形成能力测定分别将PC-3和DU-145细胞种植于6孔板,每孔种植3×105个细胞。培养过夜后加入不同浓度的KPT-185,72 h后将不同浓度KPT-185处理后的细胞种植入100 mm培养皿,每个培养皿种植3 000个细胞。细胞在37℃、5% CO2培养箱孵育21天后,用2%结晶紫染色并计量集落。
1.2.3 划痕愈合实验划痕愈合实验用于检测细胞的迁徙能力。分别将PC-3和DU-145细胞种植于6孔板,每孔种植3×105个细胞。当细胞长至90%~95%融合时用枪头在6孔板底面划线。划痕用PBS清洗3遍以确保没有松散细胞粘连。细胞分别在含KPT-185或不含KPT-185的培养液中培养20 h后用显微相机(Nikon)拍照。
1.2.4 流式细胞仪检测细胞周期分别将1×106个PC-3和DU-145细胞种植于100 mm培养皿,培养过夜之后换无血清培养液培养24 h。培养液中加入KPT-185或DMSO后培养72 h后收集细胞,用70%(v/v)冰冷的乙醇固定24 h,以3000 g离心5 min,细胞经PBS清洗后重悬于含50 μg/ml的PI (propidium iodide,碘化丙啶)和100 μg/ml DNase-free RNase的PBS溶液中。样品在37℃放置15 min后用流式细胞仪(BD,San Jose,CA)测定DNA含量[9]。
1.2.5 人组蛋白(Histone)/DNA酶联免疫法检测细胞凋亡用酶联免疫细胞凋亡检测试剂盒(Roche Applied Science,Indianapolis,IN)检测前列腺癌细胞的凋亡。分别将PC-3和DU-145细胞种植于6孔板,每孔种植3×105个细胞。培养24 h,用不同浓度KPT-185处理细胞72 h。采用人组蛋白(Histone)/DNA酶联免疫法检测细胞凋亡,溶解细胞后,提取胞质组蛋白/DNA片段,孵育于包被有抗组蛋白抗体的微量滴定板中,在使用ABTS显色前加入过氧化物酶结合的DNA抗体,最后用TECAN's酶标仪检测样品在405 nm的吸光值。
1.2.6 膜联蛋白V-FITC/PI双染法流式细胞术检测细胞凋亡使用膜联蛋白V-FITC (BioVision research,CA,USA)凋亡检测试剂盒检测细胞凋亡。PC-3和DU-145在KPT-185存在或缺失的培养液中培养72 h。离心收集1×105~5×105个细胞,用500 μl 1倍的结合缓冲液重悬细胞之后加入5 μl的膜联蛋白V-FITC和5 μl的PI。使用流式细胞仪检测样品。
1.2.7 蛋白质的提取和免疫印迹检测蛋白表达使用NE-PER细胞核与细胞质提取试剂(Thermo Scientific,Rockford,IL)抽提细胞质和细胞核蛋白,使用BCATM蛋白检测试剂IL检测蛋白质浓度[9]。
1.3 统计学方法采用GraphPad StatMate软件(GraphPad Software,Inc.,San Diego,CA)进行数据分析。图中纵轴所示数据为绝对值或实验组与对照组数据的百分比,以(x±s)表示。实验组与对照组的比较采用t检验,P < 0.05为差异具有统计学意义。
2 结果 2.1 KPT-185对前列腺癌细胞存活力的影响经KPT-185处理48和72 h后前列腺癌细胞的存活情况,见图 1A和1B。研究表明KPT-185对前列腺癌细胞PC-3和DU-145均具有浓度依赖的抑制作用。为进一步确认KPT-185对细胞生长的影响,进行了细胞集落形成能力测定实验,图 1C显示与对照相比,KPT-185阻碍了细胞集落形成。细胞集落形成能力测定的结果与细胞计数法和MTT法测定的结果一致,再次证明KPT-185对于人前列腺癌细胞PC-3和DU-145具有生长抑制作用。
|
| A: cell viability of human prostate cancer cell lines PC-3(*: P=0.0026, **: P=0.0007, compared with control group) and DU-145(*: P=0.0012, **: P=0.0006, compared with control group); B: viable cell number determined using MTT assay; C: cell survival of human prostate cell lines PC-3 and DU-145 图 1 KPT-185对前列腺癌细胞生长的影响 Figure 1 Effect of KPT-185 on prostate cancer cell growth |
本文采用划痕愈合实验检测了KPT-185对前列腺癌细胞PC-3及DU-145迁徙及浸润能力的影响,见图 2。KPT-185能抑制前列腺癌细胞PC-3和DU-145迁徙,抑制具有剂量依赖性,从而说明KPT-185能使前列腺癌细胞的迁徙能力下降。

|
| 图 2 KPT-185抑制细胞迁徙 Figure 2 KPT-185 inhibited cell migration |
采用流式细胞仪检测KPT-185对前列腺癌细胞周期的影响。将PC-3和DU-145细胞用KPT-185处理72 h后分析细胞周期阻滞情况,见图 3,阻滞于G0~G1期的细胞随着KPT-185浓度的增加而增多。KPT-185对细胞周期的影响进一步证实KPT-185是抗前列腺癌的有效候选药物。

|
| X axis: DNA content; Y axis: nuclei number 图 3 KPT-185使细胞周期阻滞于G0~G1期 Figure 3 KPT-185 induced cell cycle arrest at G0-G1 phase |
本文假设前列腺癌细胞生长抑制的原因是产生了细胞凋亡。图 4A证实KPT-185能导致PC-3和DU-145细胞凋亡,并与剂量相关。膜联蛋白V-FITC/PI双染法结果也证明了KPT-185能导致PC-3和DU-145细胞凋亡,图 4B显示出经150 nmol/L浓度的KPT-185处理后膜联蛋白V-FITC/PI双染法检测到的凋亡细胞的相对数量。经KPT-185处理后PC-3和DU-145凋亡细胞的增加差异均具有统计学意义。

|
| A: PC-3 and DU-145 cells were exposed to different concentrations of KPT-185 for 72 h. Apoptosis was determined by histone/DNA ELISA. PC-3 100 and 150nmol/L: **: P=0.0033 compared with control group, DU-145 150nmol/L: *: P=0.0322, compared with control group; B: PC-3 and DU-145 cells were treated with 150 nmol/L of KPT-185 for 72 h. Apoptosis of both cell lines was determined by Annexin V-FITC 图 4 KPT-185对前列腺癌细胞凋亡的影响 Figure 4 Induction effect of KPT-185 on apoptosis of PC cells |
为进一步了解KPT-185抗前列腺癌作用的分子机制,本文对相关的细胞信号转导通路进行了检测。由于p53和p21均为包括前列腺癌在内的重要抑癌分子,本文考察了KPT-185是否能通过抑制CRM1而上调p53和p21。提取经KPT-185处理后的PC-3和DU-145细胞的核蛋白,并进行免疫印迹分析,证实KPT-185具有抑制前列腺癌中p53和p21的核输出的活性,见图 5,与对照相比,随着KPT-185浓度增加,显著地上调核内的p53和p21,提示KPT-185阻碍了PC-3和DU-145两种前列腺癌细胞的细胞核p53和p21输出。
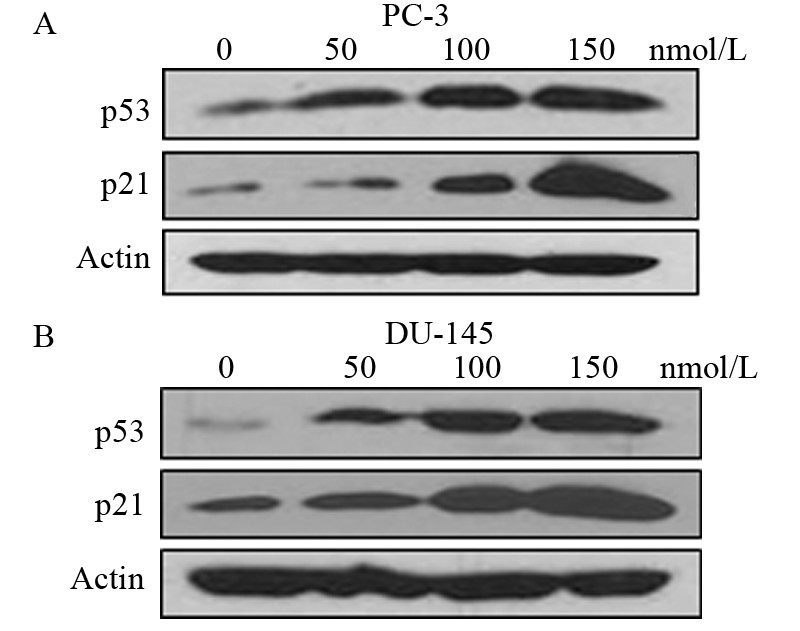
|
| The protein levels of p53 and p21 were detected by Western blot in prostate cancer cell lines PC-3 and DU-145 treated with KPT-185 for 72h 图 5 KPT-185对p53和p21表达的影响 Figure 5 Effect of KPT-185 on the expression of p53 and p21 |
前列腺癌是男性最常罹患的恶性肿瘤之一,发现新的治疗前列腺癌的靶标迫在眉睫。本文目的在于研究KPT-185对前列腺癌细胞的体外抑制特性及其分子机制。选用两株人前列腺癌细胞PC-3和DU-145进行实验。通过MTT和细胞集落形成能力检测发现,KPT-185能极大地抑制细胞的生长。此外,KPT-185能导致细胞凋亡。实验结果同时证明KPT-185引起的细胞生长抑制和凋亡是通过其抑制CRM1的核输出,使前列腺癌抑癌蛋白p53和p21保留于核内而发挥作用的。本文展示了新型小分子CRM-1抑制剂KPT-185抑制前列腺癌的抑癌活性。
众所周知,抑癌基因p53在细胞周期、凋亡、DNA修复及衰老中扮演重要角色[10, 11, 12, 13]。此外,作为细胞周期依赖激酶抑制剂p21能调节诸如细胞周期阻滞、DNA复制与修复,细胞分化、衰老及凋亡等细胞进程[14, 15, 16, 17]。p21作用于G1检测点对阻滞细胞周期起着重要作用[18, 19]。p21也是包括p53在内的肿瘤抑制基因的主要下游靶标[20]。本研究发现,KPT-185能增加p53和p21的表达量,提示可能是因为p53和p21增加而抑制了肿瘤细胞的生长[21]。本文利用划痕愈合实验进一步检测了上调p53对PC-3和DU-145细胞迁徙的影响,发现,上调p53可阻碍肿瘤细胞的迁徙。由于p53与癌细胞迁徙密切相关[22],提示KPT-185可能是因为上调p53而抑制癌细胞迁徙。
总之,本研究结果表明,作为一种新型的CRM1抑制剂,KPT-185能通过抑制CRM1而减少p53和p21的核输出,是一种可用于治疗前列腺癌的新型抗癌候选药物。本文为治疗前列腺癌提供了新的策略。同时,由于KPT-185还可能对其他核内抑癌蛋白产生影响,因此需要进一步研究KPT-185与其他抑癌核蛋白的作用,以及这些蛋白与p53、p21之间的关系。| [1] | Fox AM, Ciziene D, McLaughlin SH, et al.Electrostatic interactions involving the extreme C terminus of nuclear export factor CRM1 modulate its affinity for cargo[J]. J Biol Chem, 2011, 286(33): 29325-35. |
| [2] | Fornerod M, Ohno M, Yoshida M, et al.CRM1 is an export receptor for leucine-rich nuclear export signals[J]. Cell, 1997, 90(6):1051-60. |
| [3] | Kutay U, Izaurralde E, Bischoff FR, et al.Dominant-negative mutants of importin-beta block multiple pathways of import and export through the nuclear pore complex[J]. EMBO J, 1997, 16(6):1153-63. |
| [4] | Stade K, Ford CS, Guthie C, et al.Exportin 1(Crm1p) is an essential nuclear export factor[J]. Cell, 1997, 90(6):1041-50. |
| [5] | Strambio-De-Castillia C, Niepel M, Rout MP.The nuclear pore complex:bridging nuclear transport and gene regulation[J]. Nat Rev Mol Cell Biol, 2010, 11(7):490-501. |
| [6] | Hutten S, Kehlenbach RH.CRM1-mediated nuclear export:to the pore and beyond[J]. Trends Cell Biol, 2007, 17(4):193-201. |
| [7] | Sakakibara K, Saito N, Sato T, et al.CBS9106 is a novel reversible oral CRM1 inhibitor with CRM1 degrading activity[J]. Blood, 2011, 118(14):3922-31. |
| [8] | Turner JG, Sullivan DM.CRM1-mediated nuclear export of proteins and drug resistance in cancer[J]. Curr Med Chem, 2008, 15(26):2648-55. |
| [9] | Gao J, Azmi AS, Aboukameel A, et al.Nuclear retention of Fbw7 by specific inhibitors of nuclear export leads to Notch1 degradation in pancreatic cancer[J]. Oncotarget, 2014, 5(11): 3444-54. |
| [10] | Levine AJ.p53, the cellular gatekeeper for growth and division[J]. Cell, 1997, 88(3):323-31. |
| [11] | Vogelstein B, Lane D, Levine AJ.Surfing the p53 network[J]. Nature, 2000, 408(6810):307-10. |
| [12] | Vousden KH, Lu X.Live or let die:the cell's response to p53[J]. Nat Rev Cancer, 2002, 2(8):594-604. |
| [13] | Fridman JS, Lowe SW.Control of apoptosis by p53[J]. Oncogene, 2003, 22(56):9030-40. |
| [14] | Vurusaner B, Poli G, Basaga H.Tumor suppressor genes and ROS: complex networks of interactions[J]. Free Radic Biol Med, 2012, 52(1):7-18. |
| [15] | Dotto GP.p21(WAF1/Cip1):more than a break to the cell cycle?[J]. Biochim Biophys Acta, 2000, 1471(1):M43-56. |
| [16] | Gartel AL, Tyner AL.The role of the cyclin-dependent kinase inhibitor p21 in apoptosis[J]. Mol Cancer Ther, 2002, 1(8): 639-49. |
| [17] | Li R, Waga S, Hannon GJ, et al.Differential effects by the p21 CDK inhibitor on PCNA-dependent DNA replication and repair[J]. Nature, 1994, 371(6497):534-7. |
| [18] | Harper JW, Adami GR, Wei N, et al.The p21 Cdk-interacting protein Cip1 is a potent inhibitor of G1 cyclin-dependent kinases[J]. Cell, 1993, 75(4):805-16. |
| [19] | Xiong Y, Hannon GJ, Zhang H, et al.p21 is a universal inhibitor of cyclin kinases[J]. Nature, 1993, 366(6456):701-4. |
| [20] | el-Deiry WS, Tokino T, Velculescu VE, et al.WAF1, a potential mediator of p53 tumor suppression[J]. Cell, 1993, 75(4):817-25. |
| [21] | Liu R, Wang L, Chen G, et al.FOXP3 up-regulates p21 expression by sitespecific inhibition of histone deacetylase 2/histone deacetylase 4 association to the locus[J]. Cancer Res, 2009, 69(6): 2252-9. |
| [22] | Roger L, Gadea G, Roux P.Control of cell migration:a tumour suppressor function for p53?[J]. Biol Cell, 2006, 98(3):141-52. |
 2015, Vol. 42
2015, Vol. 42