文章信息
- 周元昆,赵逵,金海,刘玉娟. 2015.
- LI Zechao, ZHOU Yong, LUO Shiqiao. 2015.
- 阿司匹林对人结肠癌细胞株SW480、HT29中VEGF、β-catenin表达的影响
- Effects of Aspirin on VEGF, β-catenin Expression in Colon Cancer Cell Lines SW480 and HT-29
- 肿瘤防治研究, 2015, 42(07): 671-675
- Cancer Research on Prevention and Treatment, 2015, 42(07): 671-675
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.07.007
-
文章历史
- 收稿日期:2014-09-19
- 修回日期:2014-12-04
阿司匹林是世界上应用最广泛的解热、镇痛和抗炎药,最新研究发现,在结肠癌的发生、发展过程中,其具有抗癌作用,且成为预防结肠癌的主要药物[1]。结直肠癌发病率较高,每年新增患者近百万,且主要以60~80岁的老年人为主[2]。有科研人员在肿瘤转移、侵袭的研究中发现,β-连接蛋白(β-catenin)和血管内皮生长因子(vascular endothelial growth factor,VEGF)起着极为重要的作用[3]。本实验采用阿司匹林对人结肠癌细胞株SW480和HT-29的干预,在了解其对上述细胞株生长增殖影响的同时,检测β-catenin、VEGF mRNA和蛋白的表达变化,探讨阿司匹林预防、治疗结直肠癌的可能机制。
1 材料与方法 1.1 材料人结肠癌细胞株HT-29(中科院细胞研究所,上海)、SW480(第三军医大学,重庆);阿司匹林、MTT、胰蛋白酶、Mcoy's 5a培养液、Proglumide Sodium Salt (美国Sigma公司);DNA MarkerⅠ、5*Loading Buffer (大连宝生物工程有限公司);WIP组织细胞裂解液、BCA法蛋白定量试剂盒(博奥森生物技术有限公司,北京);二甲基亚砜(DMSO)(贵阳恒因生物);特级胎牛血清(德国Biochrom公司);Trizol Reagent (北京Invitrogen公司);VEGF引物、β-catenin引物、β-actin引物、RT-PCR试剂盒(上海生工生物工程有限公司);VEGF多克隆抗体(小鼠来源)(Code#TA-58,北京中杉金桥公司);β-catenin多克隆抗体(山羊来源)(上海Santa Cruz公司);免疫印迹鲁米诺试剂(上海Santa Cruz公司)。
1.2 方法 1.2.1 细胞的培养HT-29、SW480采用Mcoy's 5a (含10%胎牛血清)的培养液,置于37℃、5% CO2和100%湿度的培养箱中培养,观察细胞生长,当贴壁达80%~90%融合时,以EDTA混合液消化、传代后继续培养。实验取对数生长期的细胞进行。
1.2.2 MTT法检测细胞的生长增殖取对数生长期的HT-29、SW480细胞,实验组分为量效、时效组,分别设空白组、阴性对照组、实验组,调整细胞浓度为每毫升2×106个细胞,接种于96孔板,实验组分别加入2、4、6、8、10、12、14、16 mmol/L的阿司匹林溶液各200 μl,各设五个复孔,对照组加入培养液,培养48 h后将20 μl MTT溶液(含0.5% MTT)加入各孔,继续培养4 h,各孔再加入200 μl的DMSO,摇床上轻摇10 min,酶标仪读取A490值,细胞生长抑制率(%)=(1-用药组A值/对照组A值)×100%,利用SPSS 13.0计算出IC50。时效组种板同量效组,加药以IC50为参照,将相同浓度的阿司匹林加入96孔板,分测药物在干预6、12、24、48 h的MTT,得到相应的吸光度值。所有实验均重复三次。
1.2.3 Real-time PCR法检测VEGF、β-catenin mRNA的表达用对数生长期的SW480、HT-29细胞,然后各传代5瓶,当细胞贴壁生长达到80%~90%融合后,以1瓶为阴性对照,余4瓶分别加入5 ml以IC50为参照浓度的阿司匹林培养液,在培养至48、24、12、6 h时后将培养液倒掉,按照TRIzol试剂盒说明书提取细胞总的RNA,紫外分光光度计法定量RNA,据反转录试剂盒说明合成cDNA,RT反应体系20 μl,从GenBank查出相关引物序列,由生工生物工程(上海)有限公司合成,见表 1;根据PCR试剂盒说明书,梯度稀释模版cDNA制作标准曲线,Real-time PCR反应体系为20 μl,反应条件:预变性95℃ 30 s,1个循环;PCR反应95℃ 5 s,60℃ 20 s,40个循环;溶解曲线分析65℃ 10 s,80个循环;结果分析处理采用相对定量法。
取对数生长期的HT-29、SW480细胞,培养的方法、分组与Real-time PCR实验相一致,收集标本后,提取蛋白质,依据BCA法蛋白定量试剂盒说明,进行蛋白定量,电泳,电转,依次加入一抗,二抗,发光,X片显影,定影,分析结果。
1.3 统计学方法 实验数据的收集、整理按照完全随机对照设计的原则,所有数据以均数±标准差(x±s)表示,同一处理因素多组间的比较采用单因素方差分析,采用SPSS13.0软件进行处理,P < 0.05为差异有统计学意义。 2 结果 2.1 阿司匹林对SW480、HT-29细胞的抑制作用在不同浓度的阿司匹林干预下,SW480、HT-29细胞的生长增殖均受到抑制,且抑制率随着浓度的变化也逐渐增加,具有一定的量效关系,见图 1。随着药物浓度增加,对细胞的抑制率逐渐增大,由SPSS13.0求得阿司匹林对HT-29的IC50为8.56 mmol/L,对SW480的IC50为8.32 mmol/L。根据IC50选取8 mmol/L进行时效实验,发现抑制率随着时间的延长也逐渐增加,具有一定的时效关系,见图 2。显示阿司匹林对SW480和HT-29中的生长增殖具有显著的抑制作用,并且具有一定的量效和时效关系。

|
| 图 1 不同浓度阿司匹林对HT-29、SW480细胞增殖的抑制 Figure 1 Inhibitory effect of asipirin at different concentrations on HT-29 and SW480 cells |

|
| 图 2 阿司匹林作用不同时间对HT-29、 SW480细胞增殖的 抑制 Figure 2 Inhibitory effect of aspirin at different time on HT-29 and SW480 cells |
Real-time PCR检测的结果显示,8 mmol/L的阿司匹林作用于SW480及HT-29细胞后,除6 h干预组外,VEGF、β-catenin mRNA在12、24、48 h干预组中表达降低,与对照组相比,差异均具有统计学意义(P < 0.05),见图 3、4。显示阿司匹林能够降低SW480和HT-29中VEGF、β-catenin mRNA的表达。
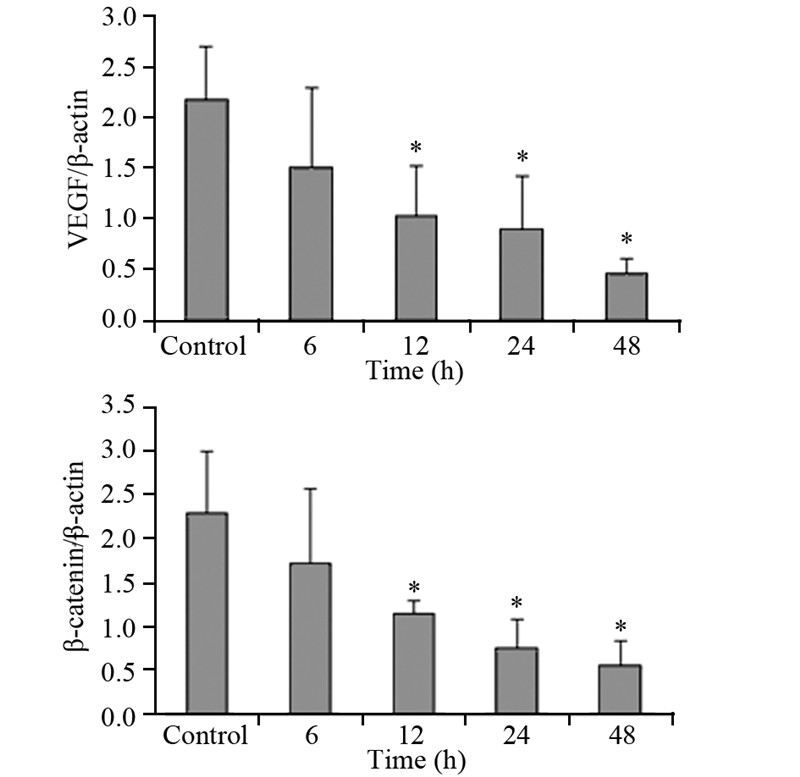
|
| *: P < 0.05, compared with control group; VEGF: vascular endothelial growth factor 图 3 阿司匹林对HT-29细胞中VEGF、β-catenin mRNA表 达的影响 Figure 3 Effect of aspirin on mRNA expression of VEGF and β-catenin in HT-29 cells |

|
| *: P < 0.05, compared with control group 图 4 阿司匹林对SW480细胞中VEGF、β-catenin mRNA表 达的影响 Figure 4 Effect of aspirin on mRNA expression of VEGF and β-catenin in SW480 cells |
Western blot显示,VEGF、β-catenin蛋白分别在26 kD、92 kD出现荧光条,均以β-actin (43 kD)为内参。图像分析系统分析,与对照组比较,予8 mmol/L阿司匹林干预后,除6 h组外,余各组蛋白表达均明显减少,差异具有统计学意义(P < 0.05),见图 5、6。显示阿司匹林能够降低SW480和HT-29中VEGF、β-catenin的蛋白表达水平。

|
| *: P < 0.05, compared with control group 图 5 HT-29、SW480细胞中VEGF蛋白的表达 Figure 5 Expression of VEGF protein in HT-29 and SW480 cells |

|
| *: P < 0.05, compared with control group 图 6 HT-29、SW480细胞中β-catenin蛋白的相对表达 Figure 6 Expression of β-catenin protein in HT-29 and SW480 cells |
最近研究发现,传统药物阿司匹林对人卵巢癌[4]、宫颈癌[5]、肝癌[6]等多种肿瘤细胞具有显著抗癌作用,且阿司匹林在结肠癌的预防中,已成为主要药物[1]。一项追踪研究发现[7],患者在诊断为结直肠癌之前,与不用者比较,已使用非甾体抗炎药(nonsteroidal antiinflammatory drugs,NSAIDs)者死亡率下降20%。本实验中,阿司匹林显著抑制了HT-29、SW480细胞的生长增殖,并随着剂量的增加、时间的延长而逐渐增强,具有一定的时效和剂量关系,这与Tárraga等[8]发现长期口服阿司匹林后,可降低罹患结直肠癌的风险和死亡率是一致的,而希罗达(CAP)与草酸铂(OX)联合低剂量的阿司匹林可延长老年转移性结肠癌患者生存期[9],也表明阿司匹林对结直肠癌的预防和治疗具有一定的时间和剂量关系。
VEGF在结直肠癌中是一个极为重要的因子[10],参与其发生、发展和转移[11],也是其预后的重要指标[12]。徐阳等[13]研究发现,VEGF对结直肠癌的形成、转移、侵袭具有重要作用;相关研究还发现VEGF mRNA在结肠癌患者外周血中的表达,比在健康者、结肠良性肿瘤患者中的表达明显升高[14]。而Etulain等[15]发现,阿司匹林能够通过抑制VEGF的活性来抑制血管的生长。本实验在阿司匹林的干预下,HT-29、SW480细胞中VEGF mRNA的活性以及蛋白的表达均明显下降,表明阿司匹林可能是通过抑制结直肠癌中VEGF的表达而抑制了肿瘤血管的生成,这与Ouyang等[16]研究结果基本一致。
有研究还发现Wnt信号通路可能起着重要的作用,特别是在结直肠癌发展的早期[17]。β-catenin是确认的与肿瘤相关的Wnt信号通路中的枢纽因子,也是其重要的传递子,对多种肿瘤的发生发展有着重要作用,是近年研究热点[18]。β-catenin在正常结直肠黏膜中的异常率仅1.67%,而在结直肠癌中异常率达75%[19],直肠癌术后β-catenin的减少可显著提高患者的生存率[20],因此Sebio等[21]认为β-catenin是结直肠癌潜在而具有前途的治疗靶点。而有研究发现SW480细胞是研究大肠癌与Wnt/β-catenin信号通路比较理想的细胞[22]。本实验阿司匹林不仅降低了人结肠癌细胞SW480中β-catenin mRNA的活性和蛋白的表达,同时对HT-29也有着类似的作用,与杨雨等[23]研究穗花杉双黄酮、舒林酸能分别诱导SW480、HT-29结肠癌细胞的凋亡、表达与β-catenin有关相似,表明阿司匹林对SW480、HT-29的抑制作用可能也与对β-catenin的抑制有关,且进一步显示了阿司匹林对结直肠癌的抑制作用可能也与对β-catenin的抑制相关。
本实验还发现,在阿司匹林的干预下,不仅HT-29、SW480中VEGF mRNA和蛋白的表达显著下降,而且β-catenin的表达也同时显著下降,显示阿司匹林在抑制β-catenin的同时可能也干预了VEGF的表达。相关研究表明,VEGF的转录激活有赖于β-catenin[24],同时Easwaran等[25]也发现突变型的β-catenin使得VEGF mRNA在相对未转染前,可有280%的增长,而Zhang等[26]对结直肠癌的研究也发现VEGF的表达能够通过Wnt信号通路来调节。所以,在结直肠癌的发生、发展、侵袭和转移过程中,VEGF和β-catenin均起着重要的作用,而笔者认为阿司匹林可能是通过抑制β-catenin后,进一步调节VEGF的表达来抑制肿瘤的发生、发展和转移,但两者之间的作用关系有待于进一步研究。
综上所述,阿司匹林作为全球使用最广泛的药物之一,价格低廉、来源广泛,虽有一定的不良反应,作用机制暂不明确,但对多种肿瘤均有预防和治疗作用,是研究肿瘤预防和靶点治疗的重点药物之一。本研究在阿司匹林对结直肠癌的预防和治疗中的作用,提供了一定的理论依据。
| [1] | Brown CJ, Gallinger S, Church J, et al.Long-term effects of aspirin on colorectal cancer[J]. J Am Coll Surg, 2012, 214(6):1023-6. |
| [2] | Siegel R, Naishadham D, Jemal A.Cancer statistics, 2013[J]. CA Cancer J Clin, 2013, 63(1):11-30. |
| [3] | Sakoguchi-Okada N, Takahashi-Yanaga F, Fukada K, et al. Celecoxib inhibits the expression of survivin via the suppression of promoter activity in human colon cancer cells[J]. Biochem Pharmacol, 2007, 73(9):1318-29. |
| [4] | Uddin S, Ahmed M, Hussain A, et al.Cyclooxygenase-2 inhibition inhibits PI3K/AKT kinase activity in epithelial ovarian cancer[J]. Int J Cancer, 2010, 126(2):382-94. |
| [5] | Xiang S, Sun Z, He Q, et al.Aspirin inhibits ErbB2 to induce apoptosis in cervical cancer cells[J]. Med Oncol, 2010, 27(2): 379-87. |
| [6] | Hossain MA, Kim DH, Jang JY, et al.Aspirin enhances doxorubicin-induced apoptosis and reduces tumor growth in human hepatocellular carcinoma cells in vitro and in vivo[J]. Int J Oncol, 2012, 40(5):1636-42. |
| [7] | Coghill AE, Newcomb PA, Campbell PT, et al.Prediagnostic nonsteroidal anti-inflammatory drug use and survival after diagnosis of colorectal cancer[J]. Gut, 2011, 60(4):491-8. |
| [8] | Tárraga López PJ, Albero JS, Rodríguez-Montes JA.Primary and secondary prevention of colorectal cancer[J]. Clin Med Insights Gastroenterol, 2014, 7:33-46. |
| [9] | Zuo XN, Ding JH, Zou GH.Clinical observation of Capox regimen combined with aspirin in the treatment of elderly patients with metastatic colon cancer[J]. Zhonghua Lin Chuang Yi Shi Za Zhi (Dian Zi Ban), 2013, 7(6):74-6.[左新年, 丁江华, 邹国辉. Capox方案联合阿司匹林治疗老年转移性结肠癌的临床观察[J]. 中华临床医师杂志(电子版), 2013, 7(6):74-6.] |
| [10] | Qian J, Chen WS, Wen KN, et al.Expression of Slug and E-cadherin in colorectal carcinoma and its clinical significance[J]. Zhongguo Lao Nian Xue Za Zhi, 2012, 32(13):2683-5.[钱江, 陈 旺盛, 文坤明, 等.Slug和E-cadherin在结直肠癌组织中的表达及临床意义[J]. 中国老年学杂志, 2012, 32(13):2683-5.] |
| [11] | Beştaş R, Kaplan MA, Işikdoğan A.The correlation between serum VEGF levels and known prognostic risk factors in colorect alcarcinoma[J]. Hepatogastroenterology, 2014, 61(130):267-71. |
| [12] | Wang Y, Yao X, Ge J, et al.Can vascular endothelial growth factor and microvessel density be used as prognostic biomarkers for colorectal cancer?a systematic review and meta-analysis[J]. Scientific World J, 2014, 2014:102736. |
| [13] | Xu Y.The expression of VEGF-C, VEGF-D and VEGFR-3 in colorectal carcinoma and its clinical significance[J]. Zhongguo Lao Nian Xue Za Zhi, 2013, 33(18):4432-3.[徐阳.VEGF-C, VEGF-D和VEGFR-3在结直肠癌组织中的表达及临床意义[J]. 中国老年学杂志, 2013, 33(18):4432-3.] |
| [14] | Li LH, Liu H, Jiang MW, et al.The relationship between the expression of VEGF-C and CK20 of mRNA and lymph node in the peripheral blood of patients with colon cancer[J]. Wei Chang Bing Xue He Gan Bing Xue Za Zhi, 2012, 21(2):126-8.[李林海, 刘辉, 江明万, 等.结肠癌患者外周血VEGF-C和CK20 mRNA的表达与淋巴转移的关系[J]. 胃肠病学和肝病学杂志, 2012, 21(2):126-8.] |
| [15] | Etulain J, Fondevila C, Negrotto S, et al.Platelet-mediated angiogenesis is independent of VEGF and fully inhibited by aspirin[J]. Br J Pharmacol, 2013, 170(2):255-65. |
| [16] | Ouyang N, Williams JL, Rigas B, et al.NO-donating aspirin inhibits angiogenesis by suppressing VEGF expression in HT-29 human colon cancer mouse xenografts[J]. Carcinogenesis, 2008, 29(9):1794-8. |
| [17] | MacDonald BT, Tamai K, He X.Wnt/beta-catenin signaling: components, mechanisms, and diseases[J]. Dev Cell, 2009, 17(1): 9-26. |
| [18] | Liu F, Millar SE.Wnt/beta-catenin signaling in oral tissue development and disease[J]. J Dent Res, 2010, 89(4):318-30. |
| [19] | Liu J, Ou YR, Jin GY, et al.Expression of β-catenin and E-cadherin in colorectal carcinoma and its clinical significance[J]. Zhongguo Zu Zhi Hua Xue Yu Xi Bao Hua Xue Za Zhi, 2013, 22(3):234-9.[刘娟, 欧玉荣, 景桂英, 等.β-catenin和E-cadherin在结直肠癌中的表达及其临床意义[J]. 中国组织化学与细胞化学杂志, 2013, 22(3):234-9.] |
| [20] | Gomez-Millan J, Perez L, Aroca I, et al.Preoperative chemoradiotherapy in rectal cancer induces changes in the expression of nuclear β-catenin:prognostic significance[J]. BMC Cancer, 2014, 14:192. |
| [21] | Sebio A, Kahn M, Lenz H.The potential of targeting Wnt/ β-catenin in colon cancer[J]. Expert Opin Ther Targets, 2014, 18(6):611-5. |
| [22] | Herbst A, Jurinovic V, Krebs S, et al.Comprehensive analysis of β-catenin target genes in colorectal carcinoma cell lines with deregulated Wnt/β-catenin signaling[J]. BMC Genomics, 2014, 15:74. |
| [23] | Yang Y, Xu W, Peng K, et al.Amentoflavone induces apoptosis in SW480 human colorectal cancer cells via regulating β-catenin and caspase-3 expressions[J]. Nan Fang Yi Ke Da Xue Xue Bao, 2014, 34(7):1035-8.[杨雨, 徐文娟, 彭康, 等.穗花杉双黄酮通过影响 caspase-3和β-catenin表达诱导结肠癌细胞SW480凋亡[J]. 南方医科大学学报, 2014, 34(7):1035-8.] |
| [24] | Hwang I, Kim J, Jeong S.β-Catenin and peroxisome proliferatoractivated receptor-δ coordinate dynamic chromatin loops for the transcription of vascular endothelial growth factor A gene in colon cancer cells[J]. J Biol Chem, 2012, 287(49):41364-73. |
| [25] | Easwaran V, Lee SH, Inge L, et al.beta-Catenin regulates vascular endothelial growth factor expression in colon cancer[J]. Cancer Res, 2003, 63(12):3145-53. |
| [26] | Zhang X, Gaspard JP, Chung DC.Regulation of vascular endothelial growth factor bythe Wnt and K-ras pathways in colcnic neoplasia[J]. Cancer Res, 2001, 61(16):6050-4. |
 2015, Vol. 42
2015, Vol. 42



