文章信息
- 李新建,陈保华,姚斌,毛英. 2015.
- LI Xinjian, CHEN Baohua, YAO Bin, MAO Ying. 2015.
- 下调UHRF1的表达在抑制肝癌进展中的作用
- Down-regulating UHRF1 Expression could Inhibit Progression of Hepatocellular Carcinoma
- 肿瘤防治研究, 2015, 42(07): 666-670
- Cancer Research on Prevention and Treatment, 2015, 42(07): 666-670
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.07.006
-
文章历史
- 收稿日期:2014-08-08
- 修回日期:2014-11-18
原发性肝细胞癌(hepatocellular carcinoma,HCC)是最常见的恶性肿瘤之一,每年全世界新增约63万例肝癌患者[1]。HCC的发生发展过程涉及到癌基因、肿瘤抑制基因、凋亡调节基因和DNA修复调节基因等多种基因的异常[2, 3]。泛素样含PHD和环指域1(ubiquitin-like with PHD and ring finger domains 1,UHRF1)是一种与细胞生长有关的核蛋白基因,参与了细胞增殖、周期调控和细胞凋亡等重要的生物学过程[4, 5]。近年来研究表明UHRF1在多种肿瘤细胞中异常高表达,和乳腺癌、膀胱癌以及前列腺癌等的浸润和转移密切相关[6, 7, 8],但UHRF1基因在肝癌中的作用还不清楚。本研究探讨UHRF1在肝癌发生发展中的作用机制。
1 材料和方法 1.1 标本和细胞株20例肝癌标本来自江西省鹰潭市第一八四医院和鹰潭市人民医院2010年12月-2013年12月普外科行肝癌根治术的住院患者。HepG2、SMMC7721、MHCC97L和HCCLM3细胞均来自武汉大学细胞典藏中心。
1.2 实验材料TRIzol (美国Invitrogen公司);反转录试剂盒FSQ-101(日本Toyobo公司);荧光定量PCR试剂盒(美国Bio-Rad公司);DMEM高糖培养液、胎牛血清(美国Hyclone公司);control siRNA、UHRF1 siRNA、UHRF1抗体和甘油醛-3-磷酸脱氢酶(GAPDH)抗体(美国Santa Cruz公司);Lipofectamine 2000(美国Invitrogen公司);Opti-MEM培养液(美国Gibco公司);蛋白裂解液(美国Thermo公司);Bax和BCL-2(美国CST公司);MTT试剂(美国Sigma公司);DMSO (美国Amresco公司)。
1.3 qRT-PCR检测UHRF1基因的表达按TRIzol试剂盒的说明书提取RNA,取收集的肝癌组织及癌旁正常肝组织标本,在液氮中碾碎至粉末,加入1 ml TRIzol裂解细胞10 min,提取总RNA。按反转录试剂盒说明书将总RNA转录成cDNA。反应条件:37℃ 15 min;98℃ 5 min。qRT-PCR反应体系:1 μl反转的cDNA (终溶度为5 ng)、2×SYBR Premix Ex TaqTM Ⅱ Mix 10 μl,上游引物0.5 μmol/L,下游引物0.5 μmol/L,DEPC H2O 8 μl,总体积为20 μl。反应条件:95℃ 30 s;95℃ 5 s;60℃ 15 s;72℃ 20 s;扩增35个循环。以GAPDH为内参,采用2-ΔΔCT法对结果进行分析。引物序列见表 1。
Western blot检测UHRF1基因以及凋亡相关基因的表达按蛋白提取试剂盒说明书提取组织或者肿瘤细胞总蛋白,BCA蛋白浓度测定法对蛋白样品进行定量。取40 μg总蛋白于10%的聚丙烯酰胺凝胶中电泳。用半干式电印迹将蛋白转移至硝酸纤维素膜,5%脱脂牛奶封闭40 min后,分别加入相应一抗(用含5%脱脂奶粉的TBST配制;1:1 000稀释),4℃过夜,第二天室温平衡40 min,洗膜后分别加入辣根过氧化物酶标记的二抗,37℃孵育1 h,洗膜后加增强化学发光试剂(ECL),将膜放入X线片暗盒、压片、显影、定影,以GAPDH的表达作为参照,目的条带的灰度值与内参条带的灰度值比较。
1.5 肝癌细胞株及体外培养人肝癌细胞株Hep G2、SMMC 7721、MHCC97L和HCCLM3,用含10%胎牛血清及1%的青霉素和1%链霉素的高糖型DMEM培养液培养于37℃、5% CO2、饱和湿度的培养箱中。
1.6 siRNA转染抑制肿瘤细胞中UHFR1基因的表达对数生长期的HCCLM3细胞分别接种于6孔、24孔和96孔培养板中,培养过夜至细胞融合度约70%时转染,设空白对照组(Blank control)、转染试剂对照组(Lip-2000)、阴性siRNA对照组(siRNA Neg)和UHFR1 siRNA干扰组,每组设重复3孔。转染步骤简述如下:细胞1×105/ml接种于培养板中(6孔板2 ml,24孔板1 m,96孔板100 μl);无抗生素Opti-MEM培养液中培养过夜至细胞融合度约70%时,转染细胞,siRNA的最终浓度为20 pmol/ml (6孔板加入总体积100 μl的siRNA-转染试剂混合物,24孔板50 μl,96孔板15 μl);转染6 h后换成完全培养液,培养至相应的时间用于后续相关指标检测。
1.7 MTT检测细胞增殖取5×103个细胞接种于96孔板,分组及转染方法同1.6,每组设5个复孔。分别于转染24、48、72 h后,弃去培养液,PBS缓冲液冲洗2次,每孔加入0.5% MTT溶液,置细胞培养箱中培养4 h后取出,每孔加入200 μl DMSO,低速振荡10~15 min,待结晶物充分溶解后,酶标仪上于490 nm波长处测量各孔的吸光度值(OD值)。按生长抑制率(%)=(1-实验组平均OD值/空白对照组平均OD值)×100%,计算转染后细胞生长抑制率。
1.8 流式细胞技术分析细胞周期分布和细胞凋亡取5×104个细胞接种于24孔板,分组及转染方法同1.6,每组设3个复孔。收集转染48 h后的各组细胞,用PBS洗涤2次,1000 g离心5 min。弃上清液,缓慢加入-20℃预冷的75%乙醇,4℃保存。取细胞悬液,PBS洗涤,2000 g离心5 min后,弃上清液。PI染液1.0 ml染30 min,488 nm激发波长测定样品,620 nm带通滤片检测PI荧光。每样本收集多于10 000个荧光信号,得出各期细胞数占细胞总数的百分率。
1.9 统计学方法采用SPSS12.0统计软件进行分析。实验数据以均数±标准差(x±s)表示,两组间均数比较采用t检验;多组均数间比较采用单因素方差分析,以P < 0.05为差异有统计学意义。
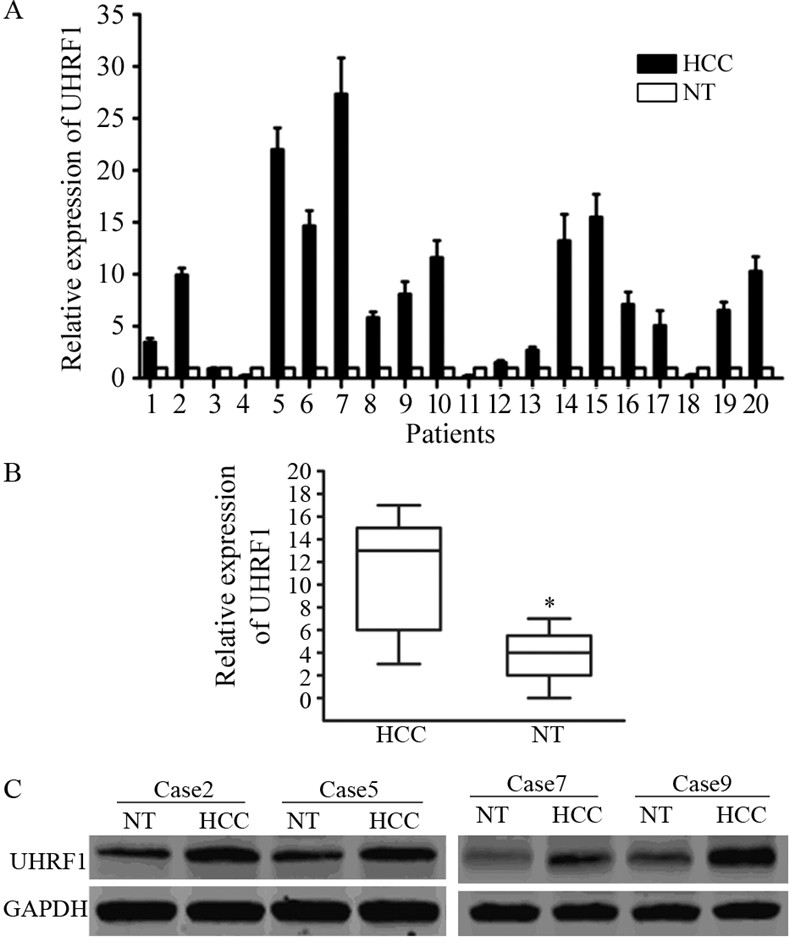
2 结果 2.1 UHFR1在肝癌组织中的表达情况qRT-PCR结果显示,在20例人肝癌组织中UHFR1的表达量较癌旁正常肝组织明显上调(P < 0.05),见图 1A、1B。Western blot结果亦显示HCC组织的UHFR1表达量增高,条带灰度增强,提示UHFR1可能参与肝癌的病理过程,见图 1C。
|
| A: real-time PCR analysis of relative UHRF1 mRNA level in 20 HCCs and the corresponding non-tumorous liver tissues after normalization for the endogenous control; B: Quantification of UHRF1 mRNA expression in HCC tissues and non-tumorous tissues; C: Western blot analysis of UHRF1 protein in 9 HCC specimens and the corresponding non-tumorous liver tissues; GAPDH was used as a loading control; HCC: hepatocellular carcinoma tissues; NT: non-tumorous tissues 图 1 人HCC组织和癌旁组织中UHRF1的表达 Figure 1 The expression of UHRF1 in HCC tissues and adjacent non-tumorous tissues |
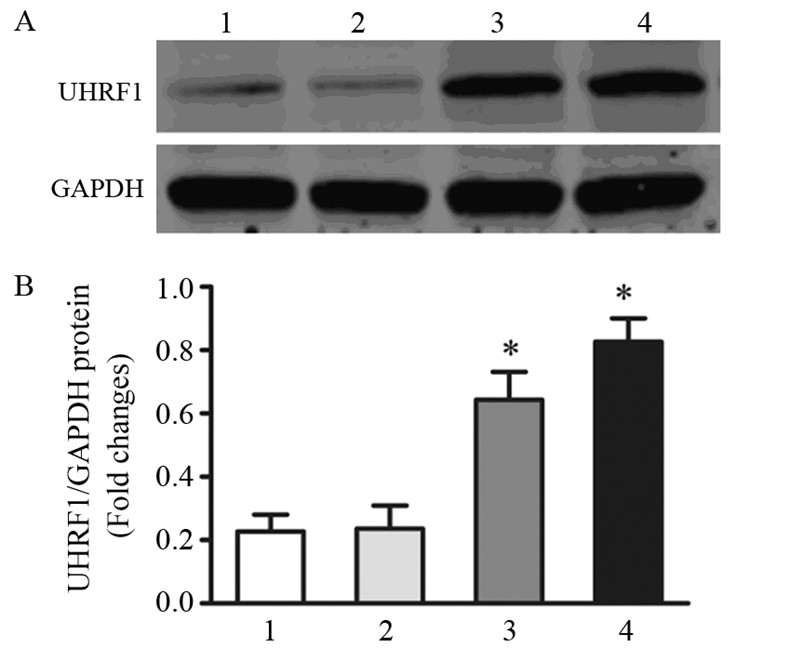
为了验证UHFR1在肝癌细胞中的表达模式,Western blot方法检测UHFR1在不同转移潜能的肝癌细胞中的表达。结果显示UHFR1在肝癌高转移潜能细胞系MHCC97L和HCCLM3中的表达水平较低转移潜能细胞系HepG2和SMMC7721中的表达水平明显上调(P < 0.05),见图 2。
|
| 1: HepG2; 2: SMMC7721; 3: MHCC97L; 4: HCCLM3; A: UHFR1 expression was evaluated in the indicated HCC cell lines by Western blot. GAPDH was used as a loading control; B: average relative gray of R1 expressions in four groups of HCC cells; *: P < 0.05, compared with HepG2 图 2 不同转移潜能肝癌细胞系中UHFR1的表达情况 Figure 2 UHFR1 expression in HCC cells with different metastasis potency |
转染后48、72 h,干扰组OD值明显低于对照组的OD值,差异具有统计学意义(P < 0.05)。干扰组细胞生长受到抑制,生长抑制率在转染后48、72 h分别为58.25%和66.78%,见表 2。实验结果提示肝癌组织中高表达的UHFR1可能促进了肿瘤细胞的增殖。
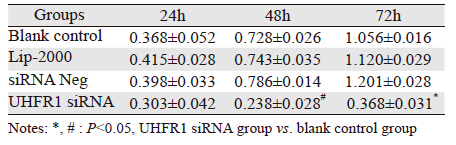 |
FCM结果显示,转染UHFR1 siRNA 48 h后,四个组之间细胞周期各时相细胞数的差异无统计学意义(P=0.0653)。但是观察到UHRF1 siRNA对HCCLM3细胞有促凋亡作用,与对照组相比,干扰组的细胞凋亡率显著升高,差异具有统计学意义(P=0.0326)。实验结果提示抑制UHFR1的表达可诱导HCCLM3细胞发生凋亡,见表 3。
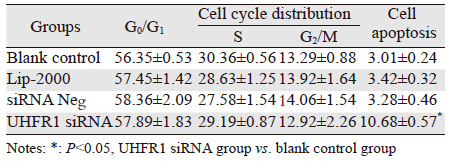 |
Western blot检测到UHFR1-siRNA干扰组细胞中,抑凋亡蛋白BCL-2表达明显下调,而空白对照组,Lip-2000组,阴性siRNA对照组BCL-2表达无明显改变。同时,UHFR1-siRNA处理干扰的HCCLM3细胞中,促凋亡蛋白BAX的表达却明显增加,见图 3。这些结果进一步说明在HCCLM3细胞系中UHFR1下调能导致细胞凋亡的增加。
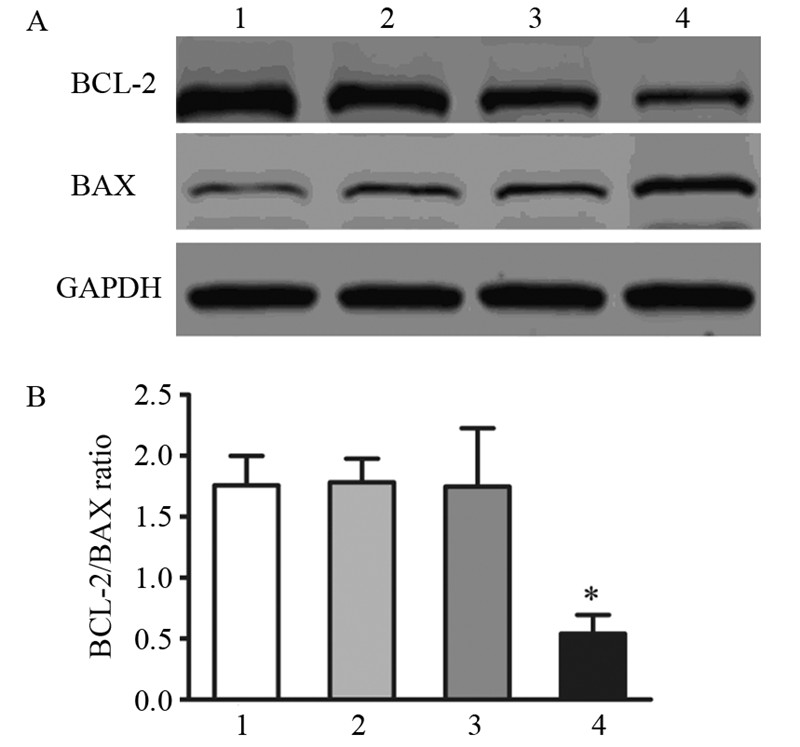
|
| 1: Blank control; 2: Lip-2000; 3: siRNA Neg; 4: UHRF1 siRNA; A: expressions of BCL-2 and BAX in blank control, Lip-2000, siRNA Neg and UHRF1-iRNA groups detected by Western blot assay; GAPDH as a loading control; B: average relative gray of BCL-2 and expressions in 4 groups of HCC cells; *: P=0.0412 图 3 下调UHRF1对BCL-2、BAX表达的影响 Figure 3 Effects of down-regulating UHRF1 expression on BCL-2 and BAX expression |
肝癌的发病机制涉及到多个肿瘤相关基因的异常表达及其参与的多个信号通路的异常[9]。UHFR1是近年来新发现的一个癌基因,其异常表达与多种肿瘤的进展密切相关。我们研究发现,肝癌组织中UHFR1的表达明显上调,并且高表达的UHFR1可能参与了肝癌的发生发展。为进一步验证UHFR1表达下调是否抑制肝癌的进展,我们进行了一系列细胞功能实验。
我们利用Western blot检测不同转移潜能肝癌细胞系表达情况,UHFR1在高转移潜能MHCC97L、HCCLM3细胞中的表达水平较低转移潜能HepG2、SMMC7721明显上调,差异具有统计学意义,说明UHFR1表达上调促进肝癌细胞侵袭转移能力增加。为进一步明确UHFR1在肝细胞肝癌中的具体作用机制,本研究在UHFR1高表达的肝癌细胞HCCLM3中,采用UHFR1 siRNA下调其表达,并观察细胞生物学行为改变。通过MTT法检测细胞增殖,发现干扰组细胞增殖受到明显抑制,转染72 h后抑制率达66.78%。证实了肝细胞肝癌中UHFR1下调能抑制肿瘤细胞生长,与肺癌[10]和胃癌[11]中的结果相一致。
在肿瘤发生和发展过程中,细胞不仅发生了异常增殖,更重要的是其发生凋亡的能力和倾向降低了。本研究利用流式细胞术分析细胞周期发现,抑制UHFR1表达48 h后,各组细胞在细胞周期各时相的分布无明显差别,但是干扰组的凋亡细胞比例显著增加。这些结果表明UHFR1细胞中,UHFR1表达下调导致细胞生长抑制的主要机制是通过促进细胞凋亡而非细胞周期阻滞来实现的。在细胞凋亡的两个进化保守的信号转导途径中,Bcl-2家族成员的构成比例是凋亡调控的关键因素,尤其是BCL-2/BAX比率是启动细胞凋亡的"分子开关"[12, 13]。在多数肿瘤中,BCL-2表达水平升高,而BAX表达下降[14]。下调BCL-2或上调BAX能促进多种因素诱导的肿瘤细胞凋亡[15]。本研究发现,UHFR1沉默后,肿瘤细胞中BCL-2的表达明显下降,而BAX的表达显著上调。这些结果表明UHFR1表达下调导致肝癌细胞凋亡的增高可能与BCL-2/BAX比率降低有关。
综上所述,我们的结果提示UHFR1沉默通过促进肝癌细胞凋亡而抑制肝癌细胞生长。这一研究发现有助于阐明肝癌的发生机制,并可望为肝癌的防治提供新的靶标。
| [1] | Yuen MF, Hou JL, Chutaputti A, et al.Hepatocellular carcinoma in the Asia pacific region[J]. J Gastroenterol Hepatol, 2009, 24(3): 346-53. |
| [2] | Hussain SP, Schwank J, Staib F, et al.TP53 mutations and hepatocellular carcinoma:insights into the etiology and pathogenesis of liver cancer[J]. Oncogene, 2007, 26(15):2166-76. |
| [3] | Yang YA, Zhang GM, Feigenbaum L, et al.Smad3 reduces susceptibility to hepatocarcinoma by sensitizing hepatocytes to apoptosis through downregulation of Bcl-2[J]. Cancer Cell, 2006, 9(6):445-57. |
| [4] | Unoki M, Nishidate T, Nakamura Y.ICBP90, an E2F-1 target, recruits HDAC1 and binds to methyl-CpG through its SRA domain[J]. Oncogene, 2004, 23(46):7601-10. |
| [5] | Jeanblanc M, Mousli M, Hopfner R, et al.The retinoblastoma gene and its product are targeted by ICBP90:a key mechanism in the G1/S transition during the cell cycle[J]. Oncogene, 2005, 24(49): 7337-45. |
| [6] | Geng Y, Gao Y, Ju H, et al.Diagnostic and prognostic value of plasma and tissue ubiquitin-like, containing PHD and RING finger domains 1 in breast cancer patients[J]. Cancer Sci, 2013, 104(2): 194-9. |
| [7] | Unoki M, Kelly JD, Neal DE, et al.UHRF1 is a novel molecular marker for diagnosis and the prognosis of bladder cancer[J]. Br J Cancer, 2009, 101(1):98-105. |
| [8] | Babbio F, Pistore C, Curti L, et al.The SRA protein UHRF1 promotes epigenetic crosstalks and is involved in prostate cancer progression[J]. Oncogene, 2012, 31(46):4878-87. |
| [9] | Iakova P, Timchenko L, Timchenko NA.Intracellular signaling and hepatocellular carcinoma[J]. Semin Cancer Biol, 2011, 21(1): 28-34. |
| [10] | Daskalos A, Oleksiewicz U, Filia A, et al.UHRF1-mediated tumor suppressor gene inactivation in nonsmall cell lung cancer[J]. Cancer, 2011, 117(5):1027-37. |
| [11] | Zhou L, Zhao X, Han Y, et al.Regulation of UHRF1 by miR-146a/b modulates gastric cancer invasion and metastasis[J]. FASEB J, 2013, 27(12):4929-39. |
| [12] | Nicholson DW, Thornberry NA.Apoptosis:life and death decisions[J]. Science, 2003, 299(5604):214-5. |
| [13] | Rossé T, Olivier R, Monney L, et al.Bcl-2 prolongs cell survival after Bax-induced release of cytochromec[J]. Nature, 1998, 391(6666):496-9. |
| [14] | Alsabeh R, Wilson CS, Ahn CW, et al.Expression of bcl-2 by breast cancer:A possible diagnostic application[J]. Modern Pathology, 1996, 9(4):439-44. |
| [15] | Leahy DT, Mulcahy HE, O'Donoghue DP, et al.Bcl-2 protein expression is associated with better prognosis in colorectal cancer[J]. Histopathology, 1999, 35(4):360-7. |
 2015, Vol. 42
2015, Vol. 42