文章信息
- 杨歆睿,王刚,吉立宾,王海燕. 2015.
- YANG Xinrui, WANG Gang, JI Libin, WANG Haiyan. 2015.
- 雪灵芝提取物对H22肝癌荷瘤小鼠免疫功能的影响
- Effects of Arenaria Kansuensis Aqueous Extract on Immune Function of H22 Tumorbearing Mice
- 肿瘤防治研究, 2015, 42(07): 662-665
- Cancer Research on Prevention and Treatment, 2015, 42(07): 662-665
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.07.005
-
文章历史
- 收稿日期:2014-12-16
- 修回日期:2015-01-22
原发性肝癌是常见的恶性肿瘤之一,在我国尤以肝细胞癌常见,占各种恶性肿瘤死亡率的第二位[1]。药物治疗是其主要治疗手段之一。在治疗的同时,机体的免疫功能会受到不同程度的影响。祖国的传统医学中,常选用植物作为药物来调节机体的免疫功能,有着很好的效果。目前,对藏药的药用价值和药用成分的进一步发掘研究正在兴起。其中,从藏药植物中筛选出高效、安全的抗肿瘤新药,具有深远的意义。藏药雪灵芝,为青藏高原特有的石竹科蚤缀属雪灵芝亚属埑状草本植物,生长于青藏高原海拔4 000米以上雪线地带。国内研究表明,雪灵芝具有抗炎、抗氧化、促消化以及对二乙基亚硝胺诱发大鼠肝癌具有预防作用[2, 3, 4]。我们的前期研究显示,藏药雪灵芝水提物在一定的浓度范围内,对体外培养的MGC-803胃癌细胞系具有增殖抑制作用,对体外培养的小鼠脾淋巴细胞增殖及其分泌Th1型细胞因子的表达具有促进作用[5, 6]。
小鼠(H22)模型作为一种重要的肿瘤移植性模型[7],可在多个近交或远交系小鼠体内生长、繁殖、接种于皮下呈结节状增长,移植于腹腔呈腹水型增长,既是实体瘤又是腹水瘤,易于体内外传代培养,是国内广泛用于基础研究和药物筛选中动物肿瘤造模的一种细胞株[8, 9]。
本研究希望通过观察雪灵芝水提物对H22荷瘤小鼠免疫功能的影响,探索雪灵芝是否具有激活体内抗肿瘤免疫的作用。
1 材料与方法 1.1 材料小鼠腹水型肝癌细胞株由中国科学院上海细胞库建立;昆明种小鼠,雄性,体质量18~20g,青海省地方病研究所实验动物中心提供;注射用环磷酰胺(CTX),江苏恒瑞医药股份有限公司生产,批号11013121;雪灵芝水提物冻干粉剂由本实验室制备,蒸馏水溶解;RPMI1640培养液为美国Gibco公司产品;胎牛血清购自中国Hyclone公司;ELISA试剂盒购于深圳市达科为生物技术有限公司;细胞培养箱(HF-90型,美国Forma公司);酶标仪(Rayto RT-6000型,深圳雷杜生命科学股份有限公司)。
1.2 方法 1.2.1 皮下移植瘤模型的建立将腹水型小鼠肝癌细胞H22用含10% FBS的RPMI1640培养液培养,取最佳生长状态的细胞,调整浓度为5×106/ml,无菌条件下注入小鼠腹腔0.2毫升/只,6~7 d后用于皮下移植瘤的接种,用0.9%氯化钠溶液稀释成含量为1×107/ml的细胞悬液,按每只0.2 ml接种于小鼠右侧腋窝部皮下,接种后随机将动物分为5组;对照组、环磷酰胺组(20 mg/kg)、AKAE高剂量组(800 mg/kg)、中剂量组(400 mg/kg)及低剂量组(200 mg/kg)。每组5只,对照组每日给予蒸馏水0.5 ml灌胃;环磷酰胺组腹腔注射3.25 mg/ml浓度的环磷酰胺0.2 ml;AKAE高、中、低剂量组分别给予不同浓度的雪灵芝水提物0.5 ml灌胃,1次/天,连续给药10 d。
1.2.2 胸腺及脾脏指数测定称重后断头处死小鼠,无菌条件下分离小鼠胸腺和脾脏,称重并分别计算胸腺和脾脏指数:胸腺指数=胸腺质量(mg)/体质量(g);脾脏指数=脾脏质量(mg)/体质量(g)。
1.2.3 荷瘤小鼠脾淋巴细胞悬液制备无菌条件下分离脾脏,置皿中剔除脂肪和结缔组织,将脾组织研碎后用0.9%氯化钠溶液混悬,经200目滤网过滤,收集滤液,1 000 r/min离心5 min后弃上清液,加入3倍体积红细胞裂解液,置冰上裂解1 min,4℃离心弃上清液后重复裂解一次,用Hank's液洗涤离心细胞两次,用1 ml完全培养液重悬,锥虫蓝染色,计数活细胞数,调整细胞密度为2×106/ml。
1.2.4 荷瘤小鼠脾淋巴细胞增殖活性检测于96孔培养板接种荷瘤小鼠脾淋巴细胞悬液100微升/孔,各样本设刺激孔及对照孔(各设3复孔),刺激孔加入含Con A (终浓度1 μg/ml)培养液80 μl,对照孔加入等量培养液80 μl。37℃、5% CO2培养44 h,每孔加20 μl MTT (5 mg∕ml),继续培养4 h。吸弃上清液,各孔加入150 μl DMSO,振荡溶解10 min,酶标仪检测490 nm波长OD值,结果以刺激指数(SI)表示:SI=(OD刺激孔-OD对照孔)/OD对照孔×100%。
1.2.5 细胞毒性T淋巴细胞(cytotoxic T lymphocytes,CTL)的细胞杀伤活性检测无菌条件下取各组小鼠脾脏,置于无菌100目钢筛网中轻轻捻碎,加PBS液冲洗,并再用200目钢筛网滤过,于无菌离心管中,1 000 r/min离心10 min,弃上清液,加细胞裂解液于4℃冰箱作用10 min,去除红细胞,1 000 r/min离心5 min,弃上清液,用无血清RPMI1640培养液洗细胞2次,1 000 r/min离心5 min,弃上清液,加含ConA 1 μg/ml、100 u/ml青霉素的完全培养液重悬,调整细胞密度至5×106/ml,接种于96孔板中,每孔180 μl。置于37℃、5% CO2培养箱48 h后,按效:靶为25:1的比例加入H22靶细胞20 μl,同时设效应细胞对照孔、靶细胞对照孔,各设3复孔。培养20 h后,加入20 μl MTT,继续培养4 h后,置平板离心机1 000r/min离心4 min,弃上清液,每孔加入DMSO 200 μl,振荡溶解10 min,酶标仪490 nm波长处测定吸光度(OD值),按下列公式计算CTL细胞杀伤活性:CTL细胞杀伤活性=[1-(OD效-靶细胞-OD效应细胞)/OD靶细胞]×100%。
1.2.6 荷瘤小鼠血清中白细胞介素2(interleukin 2,IL-2)及干扰素γ(interferon-γ,IFN-γ)水平检测荷瘤小鼠血清中IL-2及IFN-γ的ELISA检测严格按试剂盒说明书操作。
1.3 统计学方法采用SPSS17.0统计学软件进行分析,数据以均数±标准差(x±s)表示,组间比较采用单因素方差分析,以LSD法进行显著性检验,检验水准(α=0.05)。
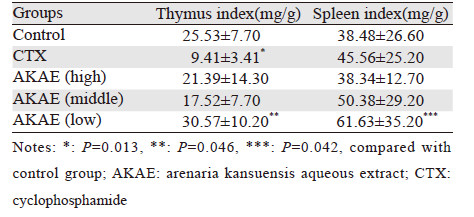
2 结果 2.1 AKAE对荷瘤小鼠胸腺和脾脏指数的影响AKAE低剂量组胸腺指数及脾脏指数均高于对照组,见表 1。
 |
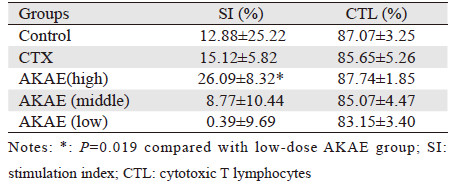
MTT法对H22荷瘤小鼠脾淋巴细胞增殖指数(SI)及CTL杀伤活性检测结果显示,AKAE高剂量组脾淋巴细胞增殖刺激指数(SI)较对照组有所升高,同时AKAE高剂量组明显高于AKAE低剂量组;各组CTL杀伤活性无明显差异,见表 2。
 |
ELISA检测结果显示,AKAE高剂量组IL-2水平较对照组有所升高;而AKAE低剂量组IFN-γ水平明显升高(P=0.015),见图 1。

|
| 1:Control group;2:CTX group;3:AKAE (high);4:AKAE (middle);5:AKAE (low);*:P=0.015,compared with control group;IFN-γ:interferon-γ;IL-2:interleukin 2 图 1 AKAE对荷瘤小鼠血清中IL-2及IFN-γ的影响 Figure 1 Effect of AKAE on IL-2 and IFN-γ in serum of tumor-bearing mice |
雪灵芝藏药名"阿仲嘎保",意为"采天地灵气之人间仙草",以全草或以其根入药。据藏医药古籍《四部医典》和《秘诀遗补》记载雪灵芝具有"治疗胃肠之溃疡、膨胀、癌症、瘰疬并能健胃助消"。近年来环肽类物质因其具有多种生物活性,如抗肿瘤、抗病原体、抗菌及免疫调节等功能,使之逐渐成为石竹科蚤缀属植物药用化学方面的研究热点。本实验发现雪灵芝水提物可以促进小鼠脾淋巴细胞增殖以及小鼠脾淋巴细胞中Th1型细胞因子的表达。
雪灵芝水提物在0.025~0.2 mg/ml浓度范围,对小鼠脾淋巴细胞增殖具有浓度依赖性的促进作用,其中0.05~0.4 mg/ml浓度范围是雪灵芝激活淋巴细胞增殖、促进Th1型细胞因子表达的最佳效应浓度范围。其结果与国内学者的观点一致[9]。雪灵芝的药用研究始于上世纪末,国内研究者进行的植化研究显示,雪灵芝含有多糖、皂甙、β-咔波啉生物碱及环肽等活性物质[10]。雪灵芝对肝癌细胞增殖影响方面的药理研究也见诸于报道[11]。李凤文等[12]研究报道,雪灵芝具有促进小鼠脾细胞增殖、增强小鼠迟发性变态反应、提高小鼠抗体生成细胞数和小鼠血清溶血素水平以及增强小鼠腹腔巨噬细胞吞噬能力等免疫作用。
本课题组在之前进行的体外研究基础上,开展了雪灵芝激活荷瘤小鼠免疫功能方面的体内研究,分别从免疫器官、免疫细胞及免疫因子三个方面进行了研究。本实验发现AKAE在一定浓度范围内具有增加胸腺指数和脾指数的作用,提示AKAE具有一定的延缓荷瘤动物免疫器官衰退的作用;药物处理后的荷瘤小鼠脾淋巴细胞IL-2和IFN-γ分泌量相对于对照组明显升高,并且AKAE在一定的浓度范围内可明显改善IL-2和IFN-γ分泌能力,使荷瘤小鼠的机体免疫功能增强,在一定的药物浓度范围内有刺激作用,说明药物成分中含有促进淋巴细胞作用的靶向作用成分,然而AKAE高剂量组脾淋巴细胞增殖刺激指数较对照组有所升高,同时AKAE高剂量组明显高于AKAE低剂量组,但对CTL细胞活性未观察到明显改变,尚有待深入研究。
综上所述,本研究结果初步证实,AKAE对H22荷瘤小鼠体内与抗肿瘤免疫相关的免疫器官的重量、免疫细胞的增殖及免疫细胞因子的表达具有一定的促进作用,为更深入地开展此方面的研究提供了线索。
| [1] | Jiang SH, Zhou YQ. Mechanism and experimental study of chinese medicine prevention of liver cancer[J]. Zhongguo Zhong Yi Ji Chu Yi Xue Za Zhi, 2003, 9(4): 69-71.[蒋时红, 周宜强. 中医药 防治肝癌机理及实验研究[J]. 中国中医基础医学杂志, 2003, 9(4): 69-71.] |
| [2] | Fu X, Chen W, Duan XQ, et al. Free radical scavenging and antilipoperoxidant properties of Arenaria kansuensis extracts[J]. Zhongguo Zhong Yi Yao Xin Xi Za Zhi, 2010, 17(7): 35-6.[付翔, 陈薇, 段小群, 等. 雪灵芝提取物清除羟自由基和抑制脂质过氧 化作用[J]. 中国中医药信息杂志, 2010, 17(7): 35-6.] |
| [3] | Yao SY, Zhao P, Liu RZ, et al. Experiment study on effect of Tibetan A. kansuensis facilitating digestion[J]. Zhongguo Ying Yong Sheng Li Xue Za Zhi, 2007, 23(3): 332-3, 364.[姚思宇, 赵 鹏, 刘荣珍, 等. 西藏雪灵芝促进消化作用实验研究[J]. 中国应 用生理学杂志, 2007, 23(3): 332-3, 364.] |
| [4] | Zhao P, Yao SY, Wang YW, et al. Effect of A. kansuensis on inhibiting liver cancer induced by diethylnitrosamine in rats[J]. Zhongguo Zu Zhi Gong Cheng Yan Jiu Yu Lin Chuang Kang Fu, 2007, 11(38): 7553-5.[赵鹏, 姚思宇, 王彦武, 等. 雪灵芝对二乙 基亚硝胺诱导大鼠肝癌组织细胞的抑制作用[J]. 中国组织工程 研究与临床康复, 2007, 11(38): 7553-5.] |
| [5] | Wang G, Zhang H, Yang XR, et al. Effects of arenaria kansuensis aqueous extract on proliferation and cell cycle of human gastric cancer cell line MGC-803[J]. Zhong Liu Fang Zhi Yan Jiu, 2013, 40(9): 821-5.[王刚, 张华, 杨歆睿, 等. 雪灵芝水提物对人胃癌 MGC-803细胞增殖及细胞周期的影响[J]. 肿瘤防治研究, 2013, 40(9): 821-5.] |
| [6] | Rao ZL, Zheng JL, Huang W, et al. Immune function indicators and effect of cyclophosphamide on H22 solid tumor-bearing mice[J]. Shi Yan Dong Wu Ke Xue, 2013, 30(3): 10-5, 18, back insert 2.[饶子亮, 郑佳琳, 黄威, 等. H22实体瘤小鼠的免 疫功能指标及环磷酰胺的影响[J]. 实验动物科学, 2013, 30(3): 10-5, 18, 后插页2.] |
| [7] | Hu WJ, Liu BR, Qian XP, et al. Effects of chonglou fufang(CLFF) on anti-tumor and immune regulation action in bearing H22 neoplasm mice[J]. Xian Dai Zhong Liu Yi Xue, 2011, 19(11): 2174-8.[胡文静, 刘宝瑞, 钱晓萍, 等. 重楼复方对荷H22小鼠抑 瘤及免疫功能的影响[J]. 现代肿瘤医学, 2011, 19(11): 2174-8.] |
| [8] | Wei J, Chen X, Li Q, et al. ELR-CXC chemokine antagonism and cisplatin co-treatment additively reduce H22 hepatoma tumor progression and ameliorate cisplatin-induced nephrotoxicity[J]. Oncol Rep, 2014, 31(4): 1599-604. |
| [9] | Wang G, Wang HY, Zhang H, et al. Effects of arenaria kansuensis aqueous extract on lymphocytes proliferation and Th1 cytokine production[J]. Zhongguo Mian Yi Xue Za Zhi, 2013, 29(9): 905-9.[王刚, 王海燕, 张华, 等. 雪灵芝水提物对淋巴细胞增殖 及Th1型细胞因子表达的影响[J]. 中国免疫学杂志, 2013, 29(9): 905-9.] |
| [10] | Lei N, Du SS, Li L, et al. Chemical constituents from a Tibetan medicine Arenariakansuensis Ⅰ[J]. Zhongguo Zhong Yao Za Zhi, 2007, 32(10): 918-20.[雷宁, 杜树山, 李林, 等. 藏药甘肃蚤缀的 化学成分研究Ⅰ[J]. 中国中药杂志, 2007, 32(10): 918-20.] |
| [11] | Liu XX, Wan ZJ, Deng XB, et al. In vitro bioactivity of different extracts from arenaria kansuensis maxim[J]. Ying Yong Yu Huan Jing Sheng Wu Xue Bao, 2010, 16(5): 642-5.[刘笑笑, 万振江, 邓小波, 等. 雪灵芝不同提取物的生物活性[J]. 应用与环境生物 学报, 2010, 16(5): 642-5.] |
| [12] | Li FW, Zhao P, Liu RZ, et al. Experimental study of arenaria kansuensis regulate immune function in mice[J]. Zhongguo Re Dai Yi Xue, 2007, 7(11): 1999-2000, 2020.[李凤文, 赵鹏, 刘荣珍, 等. 雪灵芝调节小鼠免疫作用的实验研究[J]. 中国热带医学, 2007, 7(11): 1999-2000, 2020] |
 2015, Vol. 42
2015, Vol. 42


