文章信息
- 许凯,成薇婷,胡作为,王珊. 2015.
- XU Kai, CHENG Weiting, HU Zuowei, WANG Shan. 2015.
- 丹参酮ⅡA抑制奥沙利铂诱发周围神经病变大鼠神经生长因子的表达
- Tanshinone ⅡA Inhibits Nerve Growth Factor Expression in Rats with Oxaliplatininduced Peripheral Neuropathy
- 肿瘤防治研究, 2015, 42(07): 648-651
- Cancer Research on Prevention and Treatment, 2015, 42(07): 648-651
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.07.002
-
文章历史
- 收稿日期:2014-08-31
- 修回日期:2014-10-13
2.430022武汉,武汉市第一医院肿瘤科
2.Department of Oncology,Wuhan No.1 Hospital,Wuhan 430022,China Corresponding Author:CHENG Weiting
奥沙利铂(Oxaliplatin,OXA)是一种具有低毒、高效、不良反应少的草酸铂类化疗药,但它引起的外周神经病变是其限制性不良反应之一,常表现神经病理性疼痛(触诱发痛),目前还没有找到切实有效的方法预防和治疗[1]。临床上发现丹参酮ⅡA具有较好的外周神经保护作用,但其机制尚不清楚。神经生长因子是一种神经活性因子,能促进外周神经生长和分化、保护神经元免受损伤并阻止神经元退行性变[2]。本研究旨在探讨丹参酮ⅡA对奥沙利铂诱导外周神经毒性大鼠模型中神经毒性神经生长因子的调控作用。
1 材料与方法 1.1 材料与主要试剂健康雌性Wistar大鼠30只,由华中科技大学同济医学院实验动物中心提供,生产许可证号:SCXK (鄂)2010-0009。动物实验室使用许可证号:SYXK (鄂)2010-0057。8周龄,150~200 g,自由摄食饮水,室温条件并普通饲料喂养。注射用奥沙利铂,批号:H20000686,规格:每瓶50 mg,由南京制药厂公司提供;丹参酮ⅡA磺酸钠注射液,批号:H31022558,规格:每支40 mg,由上海第一生化药业公司提供;药物均以5%葡萄糖溶解,现配现用。
1.2 分组并造模参照Jamieson等[3]的造模方法,将30只健康Wistar大鼠随机分成3组,对照组、模型组、丹参酮防治组,每组10只。根据奥沙利铂临床成人常用剂量(130 mg/m2),按照动物种属与用药转换公式,换算出大鼠的用药剂量为20 mg/kg。对照组予以5%葡萄糖5 ml腹腔注射,其余各组均予以奥沙利铂20 mg/kg腹腔注射造模。丹参酮ⅡA以0.9%氯化钠溶液稀释,防治组按照25 mg/kg剂量给药,每日1次,在造模前给药3天及造模后7天持续给药。
1.3 一般情况观察分别观察造模前、造模后6、24、72 h和7 d大鼠的一般情况,包括:精神、皮毛、饮食、排便、体重等。
1.4 机械性痛阈的测定各项数据均于造模前、造模后24、72 h和7 d测定机械性痛阈。大鼠适应环境15 min后,用Von Frey纤维(North Coast Medical公司,加拿大)垂直刺激大鼠后肢足底中部,使之稍成S形,持续6~8 s。大鼠在刺激时间内或在移开Von Frey纤维时立即出现快速的抬足反应,记为阳性反应,而身体活动所引起的抬足反应不记作阳性反应。每隔5 min测一次,连续3次,测定各组大鼠机械缩足反射阈值(mechanical withdrawal threshold,MWL),Von Frey纤维对应的压力值取平均值作为痛阈值。
1.5 神经生长因子检测分别于造模前、造模后24、72 h及7 d收集大鼠静脉血清2 ml,采用常规方法离心分离,参照大鼠NGF酶联免疫吸附法(ELISA)试剂盒(厦门慧佳生物科技公司)利用分光光度计(450 nm)检测各组大鼠血清中的NGF含量,每个样本重复三次。 1.6 脊髓背角神经元神经生长因子的表达检测
在造模后7 d时处死大鼠,经麻醉后,快速取L4~6节段脊髓背根神经节,-80℃冻存待检测。BCA法测定标本中蛋白浓度,取样50 μg进行SDS聚丙烯酰胺凝胶电泳,湿转膜法(300 mA,2 h)将蛋白转移到PVDF膜上,5%脱脂牛奶进行封闭,1:400的NGF兔抗鼠抗体(美国Santa Cruz公司)4℃孵育过夜,后续使用1:5 000的羊抗兔二抗(美国Santa Cruz公司)室温下继续孵育1 h后,ECL发光试剂盒暗室显像。用灰度扫描仪检测出相应NGF条带的平均灰度值,以代表NGF的相对表达量。
1.7 统计学方法应用SPSS 13.0统计软件,在检验水准≤0.05的基础上,组间对比采用方差分析,各组均数间采用q检验,p < 0.05为差异有统计学意义。
2 结果 2.1 一般情况造模成功后的大鼠24 h出现烦躁、撕咬、精神异常,进食及饮水明显减少,伴有大便次数增加,腹泻明显,72 h及7 d时体力及体重较对照组有明显下降,与临床表现相近。毛发未见明显脱落,未见明显血便、血尿等不良反应。
2.2 机械性痛阈模型组与防治组造模成功后,与对照组相比,机械性痛阈明显降低,在24~72 h内24 h下降幅度最为显著,72 h下降幅度最大(p < 0.05),造模后第7 d,机械性痛阈接近低水平稳定;予以丹参酮ⅡA注射后,大鼠痛阈值较模型组明显升高(p < 0.05)。其中,防治组在24 h时痛阈与模型组差异具有统计学意义(p < 0.05)。随着观察时间的推移,防治组机械性痛阈值较前升高,于72 h、7 d时接近对照组(P>0.05),见表 1、图 1。
 |

|
| 图 1 各组大鼠机械性痛阈的比较 Figure 1 Comparison of mechanical threshold in rats of each group |
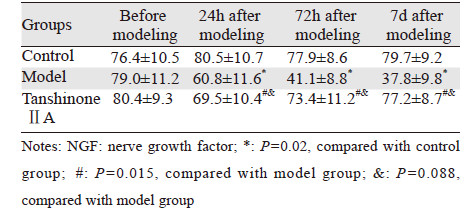
与正常对照组相比,模型组在使用奥沙利铂后,血清中NGF表达水平逐渐降低,在建模后72 h下降幅度最大(p < 0.05),给予丹参酮ⅡA防治后,血清中NGF水平明显升高,与模型组相比具有显著差异(p < 0.05),在7 d时,大鼠NGF水平与对照组之间无明显差异(P>0.05),见表 2、图 2。
 |

|
| 图 2 各组大鼠血清NGF水平的比较 Figure 2 Comparison of NGF levels in rats serum of each group |
造模后7 d时,与对照组相比,模型组大鼠脊髓背角神经元中NGF蛋白表达水平明显下降(P=0.001),丹参酮ⅡA防治组中,NGF表达水平较模型组明显上调(P=0.002),与正常对照组比较,差异均无统计学意义(P=0.069)。

|
| 图 3 各组大鼠脊髓背角神经元中NGF的表达水平 Figure 3 The expression of NGF in dorsal horn and dorsal root ganglion of rats in each group |
化疗药物引起的外周神经病变常常表现为痛觉超敏(触诱发痛),为非伤害性机械刺激引起的疼痛,是周围神经损伤后引起的外周神经病理的共性之一[1]。研究表明,与化疗药相比,奥沙利铂诱发的周围神经毒性(oxaliplatin-induced peripheral neuropathy,OXIPN)最为多见[4],也是其神经相关性不良反应的特征表现,该不良反应限制了部分患者的应用。因高发且日益加重的外周神经感觉异常,痛性痉挛,加重患者的心理和经济负担,甚者导致患者的治疗中断,但目前尚无有效的防治办法。我们在前期研究中发现,丹参酮ⅡA在临床上可以明显改善OXIPN患者的外周神经病变的症状,但其机制尚不清楚。
神经营养因子家族是在中枢以及周围神经元的发育、分化、生长、再生和功能特性的表达过程中均发挥重要的调控作用的一类蛋白,其中NGF是该家族最早被发现的神经细胞生长调节因子,它具有营养神经元和促神经细胞突起生长的双重功能[5]。当糖尿病导致外周神经病变时,NGF的合成量减少,NGF和受体结合的亲和力下降,导致外周神经病变的发生和发展[6]。在脊髓遭受缺血、炎性反应和外伤损伤时,内质网应急加重神经细胞的凋亡,而神经生长因子可以抑制内质网应激下游信号的激活,对受损的脊髓发挥神经保护作用[7]。同时,化疗药物所引起的神经病理性疼痛,内源性NGF的减少也被证实参与了疼痛的形成以及导致疼痛行为学的改变[8]。王莹等[9]发现,在紫杉醇诱导的外周神经病变病理性疼痛模型中,经免疫组织化学检测发现,在脊髓背角神经根中NGF的表达量明显减少,并与病变程度呈负相关。奥沙利铂作用于中枢神经海马神经细胞时,可促进海马神经元凋亡,其机制可能与奥沙利铂诱导NGF生成减少有关[10],添加外源性NGF后,海马神经细胞凋亡被抑制,从而减弱了奥沙利铂的中枢神经毒性[11]。
本实验应用奥沙利铂诱导大鼠外周神经病变建立实验模型,通过Von Frey纤维机械刺激缩爪阈值测定法检测机械性痛阈,发现腹腔灌注奥沙利铂后,大鼠的机械性缩足反应增强,出现机械性痛敏现象,并且这种痛觉超敏逐渐加重并一直持续到第7天。该表现与临床应用奥沙利铂诱导急性外周神经病变的表现相似[3],成功建立了实验动物模型。实验中,在各时间点检测了血清中NGF的水平,结果显示,奥沙利铂可以明显降低大鼠体内NGF水平,其下降幅度与机械性痛阈改变相一致,均呈现为逐渐下降直至1周。使用丹参酮ⅡA后,除了24 h时大鼠体内的NGF水平略微降低,其后NGF水平明显升高,接近对照组水平。进一步应用免疫印迹法检测脊髓背根神经中NGF表达情况,发现模型组中NGF表达量明显低于对照组,而丹参酮ⅡA干预后,NGF表达量明显升高。提示,奥沙利铂诱导NGF合成减少与外周神经功能异常相关,而丹参酮ⅡA可以明显对抗奥沙利铂的外周神经毒性,而这种神经保护功能可能与促进NGF表达,提高NGF的活性水平有关。
| [1] | Brouwers EE, Huitema AD, Boogerd W, et al. Persistent neuropathy after treatment with cisplatin and oxaliplatin[J]. Acta Oncol, 2009, 48(6):832-41. |
| [2] | Aloe L, Rocco ML, Bianchi P, et al. Nerve growth factor: from the early discoveries to the potential clinical use[J]. J Transl Med, 2012, 10: 239. |
| [3] | Jamieson SM, Liu J, Hsu T, et al. Paclitaxel induces nucleolar enlargement in dorsal root ganglion neurons in vivo reducingoxaliplatin toxicity[J]. Br J Cancer, 2003, 88(12): 1942-7. |
| [4] | Ko MH, Hu ME, Hsieh YL, et al. Peptidergic intraepidermal nerve fibers in the skin contribute to the neuropathic pain in paclitaxelinduced peripheral neuropathy[J]. Neuropeptides, 2014, 48(3): 109-17. |
| [5] | Biane J, Conner JM, Tuszynski MH. Nerve growth factor is primarily produced by GABAergic neurons of the adult rat cortex[J]. Front Cell Neurosci, 2014, 8: 220. |
| [6] | Mysona BA, Shanab AY, Elshaer SL, et al. Nerve growth factor in diabetic retinopathy: beyond neurons[J]. Expert Rev Ophthalmol, 2014, 9(2): 99-107. |
| [7] | Zhang H, Wu F, Kong X, et al. Nerve growth factor improves functional recovery by inhibiting endoplasmic reticulum stressinduced neuronal apoptosis in rats with spinal cord injury[J]. J Transl Med, 2014, 12: 130. |
| [8] | Engle DB, Belisle JA, Gubbels JA, et al. Effect of acetyl-lcarnitine on ovarian cancer cells proliferation, nerve growth factor receptor (Trk-A and p75) expression, and the cytotoxic potential of paclitaxel and carboplatin[J]. Gynecol Oncol, 2009, 112(3): 631-6. |
| [9] | Wang Y, Feng Y, Li J. Expression of NGF in dorsal horn and dorsal root ganglion of rats with paclitaxel-evoked neuropathic pain[J]. Zhongguo Teng Tong Yi Xue Za Zhi, 2013, 19 (8): 472-7.[王莹, 冯艺, 李君. 神经生长因子在紫杉醇诱发神经病理性痛模型 大鼠脊髓背角和背根神经节中的表达[J]. 中国疼痛医学杂志, 2013, 19(8): 472-7.] |
| [10] | Li OJ, Cui HJ, Huang MY, et al. Effect of Astragalus Root Injection on hippocampal neuronal apoptosis induced by axaliplatin[J]. Zhonghua Zhong Yi Yao Za Zhi, 2010, 25(1): 55-8.[李欧静, 崔慧娟, 黄美燕, 等.黄芪注射液对奥沙利铂致海 马神经细胞凋亡的抑制作用[J]. 中华中医药杂志, 2010, 25(1): 55-8.] |
| [11] | Descoeur J, Pereira V, Pizzoccaro A, et all. Oxaliplatin-induced cold hypersensitivity is due to remodelling of ion channel expression in nociceptors[J]. EMBO Mol Med, 2011, 3(5): 266-78. |
 2015, Vol. 42
2015, Vol. 42