文章信息
- 王玲,曹娜娜,陈伟,张英泽. 2015.
- WANG Ling, CAO Na'na, CHEN Wei, ZHANG Yingze. 2015.
- 共刺激分子B7-H3在骨肉瘤细胞侵袭转移中的作用及机制
- Effect of Costimulatory Molecule B7-H3 on Invasion and Metastasis of Osteosarcoma Cells and Related Mechanism
- 肿瘤防治研究, 2015, 42(07): 643-647
- Cancer Research on Prevention and Treatment, 2015, 42(07): 643-647
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.07.001
-
文章历史
- 收稿日期:2014-09-24
- 修回日期:2015-03-12
2.050011石家庄,河北医科大学第四医院肿瘤研究所
2.Hebei Cancer Research Institute,The Fourth Hospital of Hebei Medical University,Shijiazhuang 050011,China
骨肉瘤是由间胚叶细胞发展而来的一种恶性程度极高的、严重威胁人类健康和生命的原发性骨肿瘤[1]。目前对于骨肉瘤的转移机制尚不清楚。刺激分子B7-H3是新近发现的B7家族重要成员。随着对B7-H3分子研究的深入,其在肿瘤组织上的表达及其临床意义日益引起学者们的关注[2, 3]。有研究报道B7-H3分子在多种恶性肿瘤包括胰腺癌、肺癌以及前列腺癌中异常表达,并与肿瘤分期、淋巴结转移、术后复发等恶性进展高度相关,在肿瘤的诊断和预后判断中具有重要价值[4]。
本研究前期发现,B7-H3分子在骨肉瘤组织中过度高表达,并与患者发生肺转移密切相关。B7-H3分子不仅能够对T细胞发挥调节作用,同时还可能是一种肿瘤相关抗原,参与调节肿瘤细胞增殖、凋亡、黏附及转移[4, 5]。B7-H3基因过度活化是否是骨肉瘤侵袭转移的主要原因,目前还没有明确报道。本研究设计靶向沉默B7-H3/基因以及包含B7-H3基因全长的真核质粒表达载体,从沉默/过表达B7-H3两方面验证其对骨肉瘤细胞的生物学行为的影响。
1 材料与方法 1.1 实验材料与试剂骨肉瘤细胞U-2OS、MG-63和Saos-2购自上海中国科学院细胞库,在含10%胎牛血清、青霉素(100 u/ml)、链霉素(100 μg/ml)的高糖DMEM培养液中,于37℃、CO2体积分数为5%的饱和湿度条件下培养,细胞生长呈70%~80%融合状态时,以0.25%胰蛋白酶消化传代,隔日换液,每3~4 d传代1次。收集对数生长期细胞进行实验。
以pCMV6-AC-GFP为载体构建包含B7-H3基因全长的真核表达质粒,简称B7-H3 cDNA。以HuSH pGFP-V-RS为载体构建的发夹结构B7-H3沉默质粒,简称B7-H3 siRNA,以上质粒购自ORIGENE公司;选择各自的空载体质粒作为对照。Lipofectamine® 2000转染试剂购自美国Invitrogen公司。anti-B7-H3抗体购自中国Epitomics公司,anti-MMP-2、anti-GAPDH购自美国Santa Cruz公司。ECL化学发光试剂盒购自美国Pierce Biotech公司。Matrigel胶购自美国BD Bioscience公司。Transwell侵袭小室购自美国Costar公司。其他试剂均为国产分析纯。
1.2 细胞基因转染收集对数生长期细胞进行实验。利用Lipofectamine® 2000转染试剂,按照试剂盒说明将B7-H3 siRNA、空载体对照siRNA质粒或B7-H3 cDNA、对照组质粒转染入骨肉瘤细胞,实验设未转染组、空载体转染组(2.5 μg)、单独转染B7-H3 siRNA/B7-H3 cDNA组(2.5 μg)。
1.3 RT-PCR检测骨肉瘤细胞中B7-H3 mRNA的表达收集U-2OS、MG-63和Saos-2细胞,按照TRIzol试剂说明书逐步加入氯仿、异丙醇、乙醇等提取总RNA,并测定RNA浓度、纯度和完整性。取5 g总RNA按Revert Aid First Strand cDNA Synthesis Kit反转录试剂盒说明书合成cDNA,用Go Taq® Green Master Mix进行PCR扩增。引物及反应条件见表 1。PCR产物经1.5%琼脂糖凝胶电泳分离后,紫外透射反射仪下观察结果,并在凝胶成像仪上照相,扫描所得灰度值进行统计学分析。
转染48 h后,收集细胞,按RAPI:PMSF=100:1加入裂解混合液,冰上静置20 min,10 000 g离心10 min,收集上清液并进行蛋白定量于10%和15% SDS-PAGE分离、转膜、室温封闭,GAPDH单抗(1:1 000)、B7-H3单抗(1:1 000)、MMP-2(1:2 000),4℃孵育过夜,TBST液洗膜3次,加入1:10 000 TBST液稀释的辣根过氧化物酶的羊抗兔二抗,37℃孵育1 h,TBST液洗膜3次,采用ECL显色方法进行显色。
1.5 Transwell侵袭小室实验实验采用带有8 μm微孔聚碳酸酯膜的Transwell小室,将Matrigel胶和无血清RPMI1640培养液以1:3比例进行稀释。在小室上室铺25 μl稀释的Matrigel胶,37℃无菌保持过夜,确保Matrigel胶充分聚合。收集对数生长期的细胞,用完全培养液调整细胞浓度为2×105/ml,每孔加入200 μl细胞悬液于上室,用RPMI 1640培养液补充至1 ml。下室加入预先培养骨肉瘤细胞24 h后的上清液,每孔600 μl。实验分组同前。孵育约24 h后,取出上室。用棉签头擦掉Matrigel胶及胶上细胞,PBS液洗3次。将小室置于4%多聚甲醛中固定15 min,风干,然后用Gimesa染液染15~20 min,风干。将聚碳酸酯膜用小剪刀剪下,放在载玻片上用树胶封片,在显微镜下观察结果,计数高倍镜下至少5个视野内的细胞数,取其平均值作为该组穿过Matrigel基质的细胞数。
1.6 统计学方法用SPSS17.0统计学软件对数据进行分析,实验结果用均数±标准差表示,多组间均数比较采用单因素方差分析,p < 0.05为差异有统计学意义。
2 结果 2.1 骨肉瘤细胞MG-63、U-2OS和Saos-2中B7-H3的表达情况RT-PCR结果显示,骨肉瘤细胞MG-6 3、U-2OS和Saos-2均不同程度地组成性表达B7-H3 mRNA。其中,Saos-2细胞中B7-H3 mRNA的表达水平显著低于其他两种细胞,差异具有统计学意义(p < 0.05)。U-2OS细胞B7-H3 mRNA的表达水平高于MG-63,但差异无统计学意义(P>0.05)。Western blot的结果与RT-PCR结果趋势相一致,见图 1。

|
| A:B7-H3 mRNA level in osteosarcoma cells analyzed by RT-PCR.GAPDH was used as an internal control.B:B7-H3 expression in osteosarcoma cells analyzed by Western blot;*:P < 0.05,compared with MG-63 and U-2OS cells 图 1 骨肉瘤细胞中组成性表达B7-H3基因 Figure 1 Constitutive gene expression of B7-H3 inosteosarcoma cell lines |
在MG-63细胞中,转染B7-H3 siRNA质粒及空载体对照siRNA质粒后,RT-PCR检测结果显示,B7-H3 mRNA在B7-H3 siRNA基因转染组、空载体转染组以及未转染组中的阳性表达灰度值分别为(0.131±0.002)、(0.504±0.007)、(0.613± 0.013)。统计结果显示,转染B7-H3 siRNA基因后B7-H3 mRNA表达水平明显低于空载体转染及未转染组(p < 0.01)。
Western blot检测结果显示,转染B7-H3 siRNA基因后B7-H3的蛋白相对表达水平(0.265 ±0.008)明显低于空转染组(0.516±0.009)及未转染组(0.611±0.0048),差异有统计学意义(p < 0.05),见图 2。

|
| *: P< 0.05, compared with vector cells 图 2 转染B7-H3 cDNA或B7-H3 siRNA质粒对骨肉瘤细胞中B7-H3分子表达水平的影响 Figure 2 Effect of B7-H3 cDNA or B7-H3 siRNA transfection on B7-H3 gene expression in osteosarcoma cells |
在Saos-2细胞中,转染B7-H3 cDNA质粒及对照质粒后,RT-PCR检测结果显示,B7-H3 mRNA在B7-H3 cDNA基因转染组、空载体转染组以及未转染组中的阳性表达灰度值分别为(0.701±0.008)、(0.512±0.007)、(0.403±0.013)。统计结果显示,过表达B7-H3基因后B7-H3 mRNA表达水平明显高于空载体转染及未转染组(p < 0.01)。
Western blot检测结果显示,转染B7-H3 cDNA后,B7-H3的蛋白表达水平(0.815±0.012)明显高于空载体转染组(0.506±0.009)及未转染组(0.473±0.008),差异有统计学意义(p < 0.05),见图 2。
2.4 过表达/沉默B7-H3基因对骨肉瘤细胞的体外侵袭能力的影响Transwell侵袭小室实验结果显示,转染B7-H3 siRNA后,通过人工基底膜的MG-63细胞数明显降低。与未转染及空载体转染组相比,差异具有统计学意义(p < 0.05),见图 3。可见基因转染B7-H3 siRNA后,MG-63细胞的体外侵袭能力明显减弱。相反,转染B7-H3 cDNA后,通过人工基底膜的Saos-2细胞数明显增加。与未转染及空载体转染组相比,差异具有统计学意义(p < 0.05),见图 3。可见过表达B7-H3可促进Saos-2细胞的体外侵袭能力。

|
| *: P < 0.05, compared with vector cells 图 3 过表达或沉默B7-H3基因表达后对骨肉瘤细胞侵袭能力的影响 Figure 3 Effect of overexpression or silencing of B7-H3 gene on invasive ability of osteosarcoma cells in vitro |
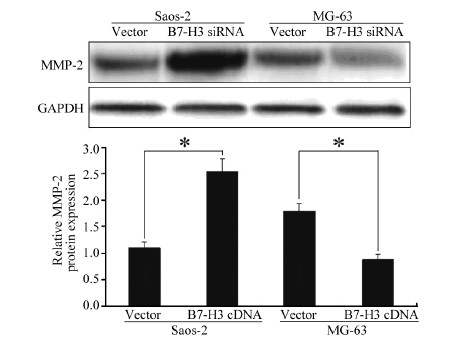
Western blot检测结果显示,沉默B7-H3基因后MG-63细胞中MMP-2蛋白的表达水平显著下降,与对照组相比,差异具有统计学意义(p < 0.05),见图 4。而转染B7-H3 cDNA的Saos-2细胞中MMP-2蛋白的表达水平显著上调,与对照组相比,差异具有统计学意义(p < 0.05),见图 4。
|
| *: P < 0.05, compared with vector cells 图 4 过表达或沉默B7 -H3 基因表达后对骨肉瘤细胞 MMP-2表达的影响 Figure 4 Effect of overexpression or silencing of B7-H3gene on MMP-2 expression in osteosarcoma cells detected by Western blot |
B7-H3是共刺激分子B7家族新成员,资料显示,B7-H3蛋白高表达于许多肿瘤组织,并在肿瘤进展和转移中发挥着非常重要的作用。Wang等[6]研究发现,B7-H3在黑色素瘤晚期患者组织中的表达水平远高于早期患者,并与肿瘤的侵袭和转移有着密切的关系。Roth[7]和Yuan[8]等研究发现B7-H3在前列腺癌组织中的高表达与患者的术后转移、复发以及死亡率呈正相关。Katayama等[9]也发现B7-H3在咽部鳞状细胞癌中异常高表达,B7-H3的表达水平与转移呈正相关。但关于B7-H3在骨肿瘤中的表达及机制研究目前仍未见报道。
本研究围绕过表达/沉默B7-H3基因对骨肉瘤细胞生物学行为影响展开实验,对B7-H3的过表达是否促进骨肉瘤的侵袭转移及其机制作了初步探索。实验选择的三株细胞中MG-63细胞侵袭性最强,Saos-2细胞侵袭性最弱。经过RT-PCR和Western blot实验结果证实,U-2OS细胞中B7-H3分子表达水平最高,而Saos-2细胞中B7-H3分子表达水平最低。但由于U-2OS细胞来源于成纤维细胞,与来源于成骨细胞的Saos-2和MG-63细胞不同。因此,我们认为B7-H3分子的表达水平与骨肉瘤细胞的侵袭能力是呈正相关的。为了进一步验证上述结果,我们选择MG-63细胞转染B7-H3 siRNA,结果发现与空载体转染、未转染组相比,转染B7-H3 siRNA组穿过基底膜的细胞数显著减少(p < 0.05),提示B7-H3 siRNA转染抑制B7-H3基因表达后,MG-63细胞分解Matrigel胶的能力减弱,细胞穿过Transwell小室下表面的数目减少,MG-63细胞的体外侵袭能力显著降低;相反,转染B7-H3 cDNA的Saos-2细胞穿过基底膜的细胞数显著增加(p < 0.05),结果说明B7-H3分子能够促进骨肉瘤细胞的侵袭转移能力。另外,我们检测了转染前、后细胞中MMP-2的表达情况,发现转染B7-H3 cDNA的Saos-2细胞中MMP-2表达水平明显增强(p < 0.05),而转染B7-H3 siRNA的MG-63细胞中MMP-2表达水平显著降低(p < 0.05)。MMPs是一组锌离子依赖性蛋白酶,是降解细胞外基质中最重要的一组酶类,可促进癌细胞突破其组织学屏障,形成邻近组织侵袭和远处组织的转移[10]。其中MMP-2在高度恶性的骨肉瘤中表达明显高于良性肿瘤,具有明显促进肿瘤侵袭转移潜能[11]。转染后MMP-2增加/降低与实验得到的细胞侵袭能力的结果相一致,推测B7-H3与MMP-2之间存在一定的未知通路,在调节骨肉瘤转移过程中发挥重要作用,可能会成为抗骨肉瘤转移治疗的潜在靶点。
综上所述,过表达/沉默B7-H3基因的表达能明显促进或抑制骨肉瘤细胞的迁移、侵袭,提示B7-H3具有促进肿瘤的侵袭和转移的能力,然而,B7-H3在体内外发挥作用的分子机制仍需要进一步研究。
| [1] | van Driel M, van Leeuwen JP. Cancer and bone: a complex complex[J]. Arch Biochem Biophys, 2014, 561: 159-66. |
| [2] | Wang L, Kang FB, Shan BE. B7-H3-mediated tumor immunology: Friend or foe?[J]. Int J Cancer, 2014, 134 (12): 2764-71. |
| [3] | Chapoval AI, Ni J, Lau JS, et al. B7-H3: a costimulatory molecule for T cell activation and IFN-gamma production[J]. Nat Immunol, 2001, 2(3): 269-74. |
| [4] | Xu L, Ding X, Tan H, et al. Correlation between B7-H3 expression and matrix metalloproteinases 2 expression in pancreatic cancer[J]. Cancer Cell Int, 2013, 13 (1): 81. |
| [5] | Wang F, Wang G, Liu T, et al. B7-H3 was highly expressed in human primary hepatocellular carcinoma and promoted tumor progression[J]. Cancer Invest, 2014, 32 (6): 262-71. |
| [6] | Wang J, Chong KK, Nakamura Y, et al. B7-H3 associated with tumor progression and epigenetic regulatory activity in cutaneous melanoma[J]. J Invest Dermatol, 2013, 133(8): 2050-8. |
| [7] | Roth TJ, Sheinin Y, Lohse CM, et al. B7-H3 ligand expression by prostate cancer: a novel marker of prognosis and potential target for therapy[J]. Cancer Res, 2007, 67 (16): 7893-900. |
| [8] | Yuan H, Wei X, Zhang G, et al. B7-H3 over expression in prostate cancer promotes tumor cell progression[J]. J Urol, 2011, 186 (3):1093-9. |
| [9] | Katayama A, Takahara M, Kishibe K, et al. Expression of B7-H3 in hypopharyngeal squamous cell carcinoma as a predictive indicator for tumor metastasis and prognosis[J]. Int J Oncol, 2011, 38(5): 1219-26. |
| [10] | Davies KJ. The Complex interaction of matrix metalloproteinases in the migration of cancer cells through breast tissue stroma[J]. Int J Breast Cancer, 2014, 2014: 839094. |
| [11] | Korpi JT, Hagstrom J, Lehtonen N, et al. Expression of matrix metalloproteinases-2, -8, -13, -26, and tissue inhibitors of metalloproteinase-1 in human osteosarcoma[J]. Surg Oncol, 2011, 20 (1): e18-22. |
 2015, Vol. 42
2015, Vol. 42



