文章信息
- 杨璐,余小舫,王正,李富荣. 2015.
- YANG Lu, YU Xiaofang, WANG Zheng, LI Furong. 2015.
- 血液及痰液miRNAs检测在肺癌早期筛查和诊断中的价值
- Clinical Value of miRNAs in Blood or Sputum as Biomarkers for Early Screening and Diagnosis of Lung Cancer
- 肿瘤防治研究, 2015, 42(06): 627-630
- Cancer Research on Prevention and Treatment, 2015, 42 (06): 627-630
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.09.002
-
文章历史
- 收稿日期:2014-06-04
- 修回日期:2014-08-03
2. 510632 广州,暨南大学医学院
2. School of Medicine, Ji'nan University, Guangzhou 510632, China
随着吸烟和各种其他环境因素的影响,肺癌成为目前世界上发病率和死亡率增长最快的恶性肿瘤之一[1] 。绝大多数肺癌起源于支气管黏膜上皮,属于恶性上皮细胞肿瘤。按组织病理学分类,主要包括非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌(small cell lung cancer,SCLC)。其中NSCLC患者约占肺癌患者的80%,主要包括鳞状细胞癌(squamous carcinoma)和腺癌(adenocarcinoma)。目前肺癌最有效的治疗手段是手术切除,但由于早期肺癌一般很少出现临床症状,所以大部分患者被确诊时已是肺癌晚期[1] 。因此建立可行有效的肺癌早期筛查和诊断方法也越来越重要。
理想的肺癌早期筛查和诊断方法需要具有高效、可重复性好、特异性高、安全、花费少、易被患者接受等优势。微小RNAs(microRNAs,miRNAs)是一类高度保守的小分子非编码RNA,具有转录后调控基因表达的功能。越来越多的研究表明,miRNAs与肿瘤的发生发展密切相关,通过参与各种信号通路,调控肿瘤细胞的生长、分化和死亡[2, 3] 。因此,组织、体液、排泄物等样本中各种miRNAs表达水平的变化能够间接反映肿瘤发生发展的状况。miRNAs作为一种新的肿瘤标志物,可应用于肿瘤的临床诊断、监测,甚至个体化治疗当中[2]。miRNAs在肺癌组织中的变化情况已经有许多报道[4] ,但组织中miRNAs检测在临床早期诊断中意义不大。而血液及痰液miRNA检测,在肺癌早期筛查和诊断中具有一定的临床价值。本文就miRNAs与肺癌发生发展的关系,以及血液及痰液中miRNAs检测在肺癌早期筛查和诊断中的临床价值作一综述。 1 miRNAs与肺癌发生发展的关系
成熟的miRNAs由较长的初级转录产物经过一系列的加工过程产生。它通过识别目标mRNAs的3’非翻译区,并根据不同的互补程度,以降解靶mRNAs或抑制靶mRNAs翻译等机制进行转录后水平调控。研究发现,大部分肿瘤相关的miRNAs都定位于染色体脆性位点(fragile site)[2] ,当沉默癌基因的miRNAs含量下调,或沉默抑癌基因的miRNAs上调,都可能导致肿瘤的发生、转移,或影响肿瘤抗药性[3] 。在肺癌组织和细胞中,许多miRNAs都明显异常表达[4] 。miR-21是现在报道最多,且在肺癌中改变也最为显著的miRNA。高表达的miR-21通过抑制PTEN(phosphatase and tensin homolog deleted on chromosome ten)信号通路来促进肺癌细胞的生长、转移以及抗放、化疗性[5] 。异常表达的miRNAs主要通过靶向周期蛋白依赖性蛋白激酶(cyclin-dependent protein kinases,CDKs)和周期蛋白依赖性蛋白激酶抑制物(CDKs inhibitor,CKI)影响细胞周期,或通过靶向caspases、Apaf-1、Bcl-2等凋亡因子控制肿瘤细胞的凋亡,或通过靶向血管内皮生长因子(vascular endothelial growth factor,VEGF)等血管生成相关蛋白调控肿瘤的转移[6] 。当上皮肿瘤细胞脱落后,这些异常表达的肺癌特异miRNAs就会出现在血液及痰液中。研究发现,miRNAs检测在肺癌的诊断、预后、对化疗药物的疗效预测以及寻找治疗新靶点方面均有很好的指导意义[7] 。 2 血液miRNAs检测在肺癌早期筛查和诊断中的临床价值
2.1 血液miRNAs检测在肿瘤早期筛查和诊断中的优势
血液中肿瘤特异性miRNAs的发现,使miRNAs作为肿瘤标志物成为可能。研究表明miRNAs不仅可以耐受高温、强酸、强碱,更重要的是内源性的miRNAs还能耐受核糖核酸酶的消化[8] 。因此血液miRNAs作为肿瘤标志物检测具有稳定、微创、成本低等优势[9] 。而且多种miRNAs联合检测可大大提高检测结果的特异性。 2.2 血液miRNAs检测在肺癌早期筛查和诊断中的临床价值
在肿瘤的临床现象出现前,甚至是肿瘤发生前,血液中部分miRNAs的变化就已经能够被鉴别出来。血清和血浆中的miRNAs可以作为NSCLC高危人群的判别标志物[10, 11] 。Bianchi等[10] 证明了利用34个miRNAs联合检测就能够在无临床症状的高危人群中,以80%的准确率筛查出NSCLC患者。而Boeri等[11]以重度吸烟者作为对照,证明了由15种miRNAs联合检测,能够在患肺癌低风险的人群中区分出的高危个体,特异性可以达到80%。
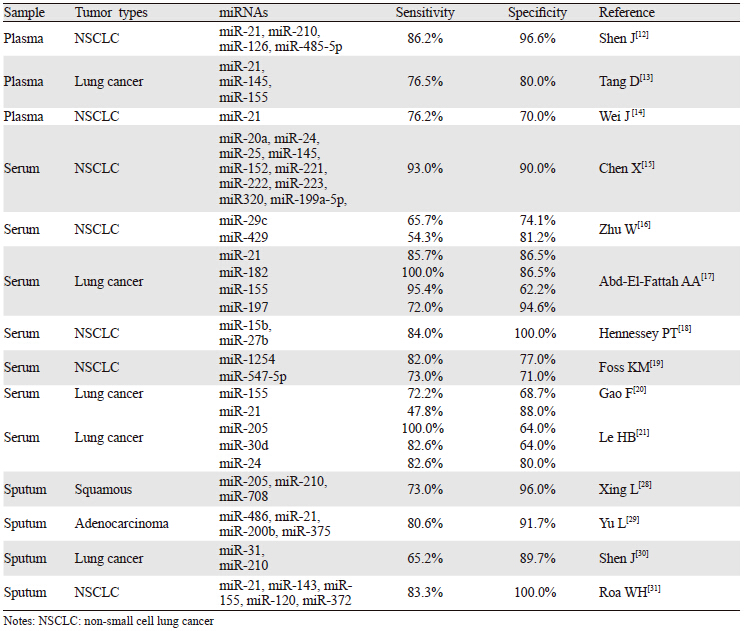
近年来,越来越多的可用于肺癌早期筛查和诊断的miRNAs被筛选出来,见表 1[12, 13, 14, 15, 16, 17, 18, 19, 20, 21] 。Chen等[15] 运用简单而有效的Taqman qPCR方法,从91种miRNA中找出可联合作为肺癌早期诊断的10种血清miRNAs。Shen等[12] 筛选出了一组miRNAs,检测肺腺癌的敏感度比检测肺鳞癌的敏感度高。另外,癌胚抗原(carcino-embryonic antigen,CEA)作为肿瘤标志物已在临床上广泛运用,Zhu等[16]不仅检测了miR-29c和miR-429诊断NSCLC敏感度和特异性,而且还表明这两种miRNAs作为肿瘤标志物对肺癌的诊断价值要比CEA高。如果将这两种miRNAs与CEA共同作为肺癌血液检测指标,将更好地指导肺癌早期筛查和诊断。研究还发现这些异常表达的miRNAs通常在术后或治疗之后会趋于正常水平[22, 23] ,由此更加证实了miRNAs可作为循环肿瘤标志物用于肺癌早期筛查和诊断。
 |
3.1 排泄物miRNAs检测与肿瘤的筛查和诊断
由于上皮肿瘤细胞脱落后会随排泄物排出体外,通过对排泄物(粪便、尿、痰)中肿瘤特异的miRNAs检测,可用于肿瘤早期筛查和诊断。排泄物miRNAs检测由于具有可重复性高、无创、样本来源丰富等优点,越来越受到人们的关注。排泄物miRNAs不仅种类和含量变化能反映肿瘤的情况[24] ,而且它对肿瘤种类的指向性要比血液标本更加明确。 3.2 痰液miRNAs检测在肺癌早期筛查和诊断中的临床价值
痰细胞学检查已广泛用于临床肺癌的诊断,但敏感度较低[25] 。研究表明肺癌患者痰液中许多分子的改变不仅与肺癌的发生发展有直接关联,而且一般都先于细胞形态学改变,对于痰液中各种分子的检测已经逐渐取代了痰细胞学检查[26] 。
由于支气管上皮肿瘤细胞脱落后会随痰液排出体外,痰液miRNAs已经成为一种可用于肺癌早期筛查和诊断的肿瘤标志物[28, 29, 30, 31] ,见表 1。Xie等[27] 发现内源miRNAs具有抵抗RNA酶活性的能力,由此证明miRNAs能够稳定存在于痰液中。并且,与痰细胞学检测相比,痰miRNAs检测的敏感度更高,为痰液miRNAs用于肺癌的早期筛查和诊断奠定了基础。
痰液miRNAs对肺癌分型有一定的指向性,Xing等[28]对肺鳞癌患者痰液中的miRNAs进行了检测,发现与健康者相比有6种miRNAs的表达量都有所改变,将其中3个miRNA(miR-205、miR-210、miR-708)联合检测肺鳞癌,灵敏度和特异性可以分别达到73%和96% 。Yu等[29]对肺腺癌患者痰液中的miRNAs进行检测,发现7种miRNAs的表达量发生了改变。将其中的4个miRNAs(miR-486、miR-21、miR-200b、miR-375)联合检测肺腺癌,敏感度和特异性可以分别达到80.6%和91.7%。而如果将这个联合指标用于肺鳞癌诊断,敏感度和特异性仅64.1%和71.3%,说明由此4个miRNAs组成的联合检测指标,对肺腺癌的诊断更具有指向性。
要进行多个miRNAs的联合诊断,miRNAs个数越少越利于临床的应用。Shen等[30] 研究发现仅由2个miRNAs(miR-31、miR-210)组成的诊断指标,对肺癌检测的特异性已经达到83.8%,若将miRNAs检测与CT联合应用,将大大提高原先仅由CT诊断的特异性。现在,大量生物信息学及统计学知识已广泛运用到miRNAs联合诊断的组合筛选工作中[31] 。 4 展望
血液及痰液中多个相关miRNAs含量的变化,与肺癌发生发展情况密不可分。因此,通过多临床中心大样本的miRNAs组合检测,以及生物信息学分析和统计学处理,筛选出血液及痰液中针对肺癌具有高敏感度和特异性的miRNAs检测组合,将是临床应用的前提。在痰液及血液中miRNAs的检测技术方面,逆转录荧光定量PCR检测miRNAs虽然具有较高的特异性,但是无法实现高通量检测。而液相芯片技术,虽然可以同时检测最多100种miRNAs含量,但是灵敏度较低,许多表达水平较低的miRNAs无法检出。如何建立一种高敏感度、高特异性,不提取扩增,可直检miRNAs的技术也将是临床应用中亟待解决的问题。
综上所述,血液及痰液miRNAs检测应用于肺癌早期筛查和诊断中,将为肿瘤的早期诊断提供新的生物学标记,同时大大改善肺癌患者的治愈率和生存率,并在指导临床个体化治疗和判断患者预后等方面具有重要价值。
| [1] | Fanini F, Vannini I, Amadori D, et al. Clinical implications of microRNAs in lung cancer[J]. Semin Oncol, 2011, 38(6): 776-80. |
| [2] | Iorio MV, Croce CM. MicroRNA dysregulation in cancer: diagnostics, monitoring and therapeutics. a comprehensive review[J]. EMBO Mol Med, 2012, 4 (3): 143-59. |
| [3] | Iorio MV, Croce CM. microRNA involvement in human cancer[J]. Carcinogenesis, 2012, 33 (6): 1126-33. |
| [4] | Watanabe K, Takai D. Disruption of the expression and function of microRNAs in lung cancer as a result of epigenetic changes[J]. Front Genet, 2013, 4: 275. |
| [5] | Liu ZL, Wang H, Liu J, et al. MicroRNA-21 (miR-21) expression promotes growth, metastasis, and chemo- or radioresistance in non-small cell lung cancer cells by targeting PTEN[J]. Mol Cell Biochem, 2013, 372 (1-2): 35-45. |
| [6] | Guz M, Rivero-Müller A, Okoń E, et al. MicroRNAs-role in lung cancer[J]. Dis Markers, 2014, 2014: 218169. |
| [7] | Qi J, Mu D. MicroRNAs and lung cancers: from pathogenesis to clinical implications[J]. Front Med, 2012, 6(2): 134-55. |
| [8] | Ma R, Jiang T, Kang X. Circulating microRNAs in cancer: origin, function and application[J]. J Exp Clin Cancer Res, 2012, 31: 38. |
| [9] | Madhavan D, Cuk K, Burwinkel B, et al. Cancer diagnosis and prognosis decoded by blood-based circulating microRNA signatures[J]. Front Genet, 2013, 4: 116. |
| [10] | Bianchi F, Nicassio F, Marzi M, et al. A serum circulating miRNA diagnostic test to identify asymptomatic high-risk individuals with early stage lung cancer[J]. EMBO Mol Med, 2011, 3 (8): 495-503. |
| [11] | Boeri M, Verri C, Conte D, et al. MicroRNA signatures in tissues and plasma predict development and prognosis of computed tomography detected lung cancer[J]. Proc Natl Acad Sci U S A, 2011, 108(9): 3713-8. |
| [12] | Shen J, Todd NW, Zhang H, et al. Plasma microRNAs as potential biomarkers for non-small-cell lung cancer[J]. Lab Invest, 2011, 91(4): 579-87. |
| [13] | Tang D, Shen Y, Wang M, et al. Identification of plasma microRNAs as novel noninvasive biomarkers for early detection of lung cancer[J]. Eur J Cancer Prev, 2013, 22 (6): 540-8. |
| [14] | Wei J, Gao W, Zhu CJ, et al. Identification of plasma microRNA-21 as a biomarker for early detection and chemosensitivity of non-small cell lung cancer[J]. Chin J Cancer, 2011, 30 (6): 407-14. |
| [15] | Chen X, Hu Z, Wang W, et al. Identification of ten serum microRNAs from a genome-wide serum microRNA expression profile as novel noninvasive biomarkers for nonsmall cell lung cancer diagnosis[J]. Int J Cancer, 2012, 130 (7): 1620-8. |
| [16] | Zhu W, He J, Chen D, et al. Expression of miR-29c, miR-93, and miR-429 as potential biomarkers for detection of early stage non-small lung cancer[J]. PLoS One, 2014, 9(2): e87780. |
| [17] | Abd-El-Fattah AA, Sadik NA, Shaker OG, et al. Differential microRNAs expression in serum of patients with lung cancer, pulmonary tuberculosis, and pneumonia[J]. Cell Biochem Biophys, 2013, 67(3): 875-84. |
| [18] | Hennessey PT, Sanford T, Choudhary A, et al. Serum microRNA biomarkers for detection of non-small cell lung cancer[J]. PLoS One, 2012, 7(2): e32307. |
| [19] | Foss KM, Sima C, Ugolini D, et al. miR-1254 and miR-574-5p: serum-based microRNA biomarkers for early-stage non-small cell lung cancer[J]. J Thorac Oncol, 2011, 6(3): 482-8. |
| [20] | Gao F, Chang J, Wang H, et al. Potential diagnostic value of miR-155 in serum from lung adenocarcinoma patients[J]. Oncol Rep, 2014, 31(1): 351-7. |
| [21] | Le HB, Zhu WY, Chen DD, et al. Evaluation of dynamic change of serum miR-21 and miR-24 in pre- and post-operative lung carcinoma patients[J]. Med Oncol, 2012, 29(5): 3190-7. |
| [22] | Roth C, Stuckrath I, Pantel K, et al. Low levels of cell-free circulating miR-361-3p and miR-625* as blood-based markers for discriminating malignant from benign lung tumors[J]. PLoS One, 2012, 7(6): e38248. |
| [23] | Aushev VN, Zborovskaya IB, Laktionov KK, et al. Comparisons of microRNA patterns in plasma before and after tumor removal reveal new biomarkers of lung squamous cell carcinoma[J]. PLoS One, 2013, 8(10): e78649. |
| [24] | Xiao YF, Yong X, Fan YH, et al. MicroRNA detection in feces, sputum, pleural effusion and urine: novel tools for cancer screening (Review)[J]. Oncol Rep, 2013, 30(2): 535-44. |
| [25] | Dutt N, Singh AK. Sputum cytology for lung cancer: Not just part of the past[J]. Lung India, 2012, 29 (2): 199. |
| [26] | Hubers AJ, Prinsen CF, Sozzi G, et al. Molecular sputum analysis for the diagnosis of lung cancer[J]. Br J Cancer, 2013, 109(3): 530-7. |
| [27] | Xie Y, Todd NW, Liu Z, et al. Altered miRNA expression in sputum for diagnosis of non-small cell lung cancer[J]. Lung Cancer, 2010, 67(2): 170-6. |
| [28] | Xing L, Todd NW, Yu L, et al. Early detection of squamous cell lung cancer in sputum by a panel of microRNA markers[J]. Mod Pathol, 2010, 23(8): 1157-64. |
| [29] | Yu L, Todd NW, Xing L, et al. Early detection of lung adenocarcinoma in sputum by a panel of microRNA markers[J]. Int J Cancer, 2010, 127(12): 2870-8. |
| [30] | Shen J, Liao J, Guarnera MA, et al. Analysis of microRNAs in sputum to improve computed tomography for lung cancer diagnosis[J]. J Thorac Oncol, 2014, 9 (1): 33-40. |
| [31] | Roa WH, Kim JO, Razzak R, et al. Sputum microRNA profiling: a novel approach for the early detection of non-small cell lung cancer[J]. Clin Invest Med, 2012, 35(5): E271. |
 2015, Vol. 42
2015, Vol. 42