文章信息
- 翟明慧,胡尔西旦·尼牙孜,刘攀,张宋安,热合曼·依明,赵化荣. 2015.
- ZHAI Minghui, Huerxidan·Niyazi, LIU Pan, ZHANG Songan, Reheman·Yiming, ZHAO Huarong. 2015.
- 早期前列腺癌不同治疗模式的疗效及生化复发的危险因素分析
- Efficacy of Different Treatment Methods for Early Prostate Cancer Patients and Risk Factors for Biochemical Recurrence
- 肿瘤防治研究, 2015, 42(06): 601-605
- Cancer Research on Prevention and Treatment, 2015, 42 (06): 601-605
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.09.002
-
文章历史
- 收稿日期:2014-10-08
- 修回日期:2015-02-27
前列腺癌是西方发达国家男性最常见的实体性恶性肿瘤,其死亡率仅次于肺癌居第二位[1]。近年来,我国随着人口老龄化的不断发展和饮食结构逐渐西方化,前列腺癌的发病率明显增加,形势较为严峻[2]。前列腺癌根治性治疗(根治性手术或根治性放疗)是治愈局限性(早、中期)前列腺癌最有效的方法之一,但是20%的患者在术后5年内发生了生化复发[3],术后生化复发的患者其中多数为期望生存时间较长的年轻患者。术后10年内仍有27%~53%的患者发生肿瘤局部复发或远处转移[4],根治性放疗后约20%~50%的患者会发生生化复发[5],本研究旨在分析影响生化复发的危险因素,为早期前列腺癌的临床诊治及预后评价提供依据。 1 资料与方法
1.1 一般资料
收集新疆医科大学第一附属医院2004年4月至2012年4月间收治的269例T1~2N0M0期(2002年美国肿瘤联合委员会前列腺癌TNM分期系统中将T1N0M0及T2N0M0期前列腺癌定义为局限性前列腺癌)前列腺癌患者的临床资料,其中根治性手术治疗组63例、根治性放疗组206例。发病年龄50~89岁,中位年龄72岁。所有患者经前列腺穿刺活检或术后病理确诊为前列腺癌。 1.2 前列腺癌生化复发的定义标准
前列腺癌生化复发是指根治性治疗后,血清前列腺特异性抗原(PSA)持续性升高或未下降。(1)根治术后的生化复发:2005年欧洲泌尿外科协会制定的前列腺癌指南中将根治术后生化复发定义为以下情况:术后患者血清PSA水平在4周内未下降至正常水平或虽降至正常水平,但之后连续2次监测血清PSA升高,且高于0.2 ng/ml。(2)根治性放疗后生化复发: ASTRO于2006年修正了放疗后生化复发的诊断标准,提出了新的定义为:根治性放疗后(外放射治疗,无论是否行内分泌治疗)PSA升高超过PSA最低值2 ng/ml或2 ng/ml以上。本研究按照以上标准定义生化复发。 1.3 肥胖的定义
肥胖:WHO建议以体重指数(body mass index,BMI)作为肥胖判定的依据。BMI≥25 kg/m2定义为超重,≥30 kg/m2则为肥胖。 1.4 随访
所有病例复查时均通过门诊、住院等方式进行复查或诊治,并电话、信件等方式进行随访,随访时间12~84月(平均38.4月)。以生化复发为观察终点,观察到的患者没有PSA升高或一直保持在正常值范围内的患者为最后的截尾数据。 1.5 统计学方法
用SPSS17.0软件进行数据处理。分类变量资料的比较采用χ2检验或Fisher确切概率法检验。采用多因素Logistic回归分析,选用基于偏最大似然估计的前进法筛选危险因素,P<0.05为差异有统计学意义。 2 结果
2.1 前列腺癌生化复发风险的单因素分析
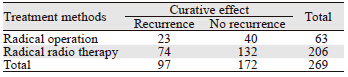
本研究对前列腺癌(PCa)生化复发相关危险因素,包括:年龄、民族、肿瘤分期、Gleason评分、治疗前PSA水平、高血压史、糖尿病史、吸烟史、饮酒史、治疗前血红蛋白、肥胖等行χ2检验或Fisher精确检验,结果显示患者肿瘤分期、Gleason评分、治疗前PSA水平、HGB、肥胖与PCa生化复发具有相关性(P均为0.000),差异有统计学意义,见表 1。
 |
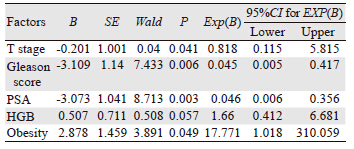
将上述单因素分析显示有统计学意义的变量纳入Logistic回归模型中进行多因素相关回归分析,结果显示:肿瘤分期、Gleason评分、治疗前PSA水平、肥胖是前列腺癌患者生化复发的独立危险因素,见表 2。
 |
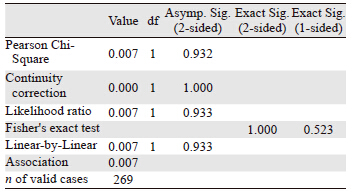
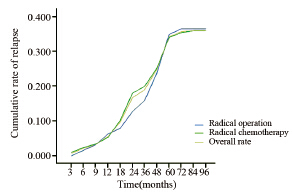
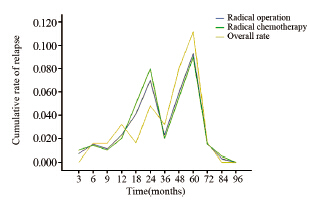
两组患者截至随访日期,总体累积生化复发率为36.0%,其中根治术组累积生化复发率为36.5%(23/63),根治放疗组为36.0%(74/206),四格表卡方双边检验P=0.932,单边检验P=0.523,差异无统计学意义。两组生化复发的趋势较为一致,见表 3。图 1也显示了两种根治治疗的总体累积生化复发率趋于一致。两种根治性治疗方式,治疗后第2年及第5年新增的生化复发机率会增高,见表 4、图 2。
 |
|
| 图 1 两种根治治疗的总体累积生化复发率变化图 Figure 1 Variation of the overall accumulation biochemical recurrence rate of two radical treatment |
|
| 图 2 两种根治治疗的总体生化复发率变化图 Figure 2 Variation of the overall biochemical recurrence rate of two radical treatment |
目前,前列腺癌根治术是治疗早期前列腺癌最有效的方法,但远期生化复发率仍有20%~50%,很大程度上影响患者的肿瘤复发,随着对前列腺癌生化复发研究的不断深入,以下影响生化复发因素得到了广泛的认同[6, 7],如肿瘤分期、Gleason评分、治疗前PSA水平,本研究结果也显示:肿瘤分期、Gleason评分、术前PSA水平可作为前列腺癌患者生化复发的独立高危因素,还显示了肥胖与前列腺癌生化复发密切相关。目前主要依赖于治疗前PSA水平、病理活检的Gleason分级以及肿瘤的分期进行前列腺癌危险分层,指导治疗及预后判断。 3.1 影响前列腺癌生化复发的危险因素
种族、年龄以及肥胖程度作为生化复发的因素也受到很多研究学者的关注,但是种族和年龄不被认为是前列腺癌的危险因素,肥胖却认为可以是前列腺癌术后复发的独立危险因素。本研究显示,种族差异和年龄不同与前列腺癌生化复发无明显相关性,相关研究[8, 9]也表明种族差异和年龄不能作为影响前列腺癌生化复发的独立危险因素,但是体重指数≥30 kg/m2的患者发生生化复发率较高,本研究结果显示肥胖是影响前列腺癌生化复发的独立危险因素,且体重指数≥30 kg/m2的前列腺癌患者生化复发率高达56.1%。Pfitzenmaier等[10]研究也显示肥胖患者(体重指数≥30 kg/m2)具有较高Gleason分值,更容易出现术后的生化复发。Boorjian等[11]报道可能由于肥胖患者血浆容积较大,稀释了血浆PSA浓度,故在相同PSA浓度的患者中,肥胖患者实际上有较高的PSA水平。因此建议在给肥胖患者用PSA筛查前列腺癌时,应注意到这个因素的存在。
TNM分期系统中将T1N0M0及T2N0M0期前列腺癌定义为局限性前列腺癌。本研究结果显示:肿瘤分期无论在单因素分析还是多因素分析中,均可作为前列腺癌生化复发的危险因素,临床分期≥T2a可以作为前列腺癌根治术后生化复发的风险因素,研究表明T1期的各亚分期差异对于生化复发率尚没有统计学意义。有些研究[12, 13, 14]与本研究结果相同,其中Reese等[14]的研究报道肿瘤分期≥T2a的患者行手术治疗后,病理发现肿瘤的邻近组织切缘阳性,而切缘阳性者治疗后发生生化复发的概率较大,故研究间接认为,肿瘤分期≥T2a可作为前列腺癌生化复发的危险因素。美国的某项研究[15]呈相反的结果,在不同临床分期的患者中,随访最后的结果显示,高级别的临床分期与低级别的临床分期在前列腺癌生化复发率上没有差异。Gleason分级是在前列腺癌中应用最为广泛的分级系统。许多研究显示,在多因素分析中前列腺癌根治术标本的Gleason 评分是生化复发的独立预测因素[16]。Houston等[17]通过回顾性分析前列腺癌根治术患者的术前、术后多项临床病理特征,结果表明Gleason评分是前列腺癌生化复发的独立危险因素,本研究单因素结果显示:Gleason评分≥7分与前列腺癌生化复发具有明显相关性。多因素分析显示;Gleason评分是前列腺癌患者生化复发的独立高危因素。本研究将术前血清PSA水平作为前列腺癌生化复发的相关指标分析,显示术前血清PSA水平越高,生化复发率越高,其可以作为前列腺癌复发的预测指标。本文结果和许多报道研究相一致。Barry等[18]报道在多因素分析中术前血清PSA水平为生化复发的预测因素(P<0.05)。Brassell等[19]研究报道PSA及PSAD(PSA密度)均为生化复发的重要预测因素,但是PSA对生化复发的预测价值大于PSAD。在多因素分析中术前血清PSA水平也可以作为生化复发的预测因素。 3.2 不同治疗模式的疗效对比
近年来,我国前列腺癌的发病率不断上升,且人们对健康越来越关注,通过对前列腺癌的筛查,越来越多的早期局限性前列腺癌患者被确诊。对于局限性前列腺癌,选择根治手术还是放射治疗,一直是泌尿外科医生和肿瘤放疗医生争论的热点。
本研究结果发现,根治性放疗和根治性手术对于早期前列腺癌生化复发率基本一致,其5年生化复发率在两组间比较差异无统计学意义。许多研究[20, 21, 22]结果与本研究一致,其中瑞士研究团队发现:5年患者生化复发率在肿瘤放疗和外科手术组基本相似[22]。西班牙马德里的一支研究团队回顾性比较了505例低危和中危的局限性前列腺癌患者接受根治手术和根治性放疗的PSA生化复发率,研究结果发现5年生化复发率在两组之间差异无统计学意义[23]。而意大利罗马团队报道了284例接受外放射和行根治手术的高危前列腺癌患者的PSA生化复发率,研究结果证实PSA 3年生化复发率在放疗组明显优于手术组[24]。对于前列腺癌,尤其是局限性前列腺癌的患者来讲,决定行根治性手术还是根治性放疗,很大程度上取决于首诊医生、患者身体体能状况、患者对性生活质量的追求及对放疗和手术的认识。本研究认为前列腺癌的患者多为老年男性,手术风险及创伤较大,对于那些患有其他慢性疾病或体质衰退等原因无法接受前列腺根治性手术的患者,放射治疗由于具有较好的预后效果及较小的不良反应,更适合成为早期前列腺癌根治手段的优选。
本研究发现,无论哪种根治性治疗方式,治疗后第2年及第5年新增的生化复发机率会增高。故为了预防前列腺癌患者治疗后生化复发,在治疗后第2年及第5年时应该高度警惕,积极随访。
综上所述,为了预防前列腺癌患者治疗后生化复发,对T分期较高、Gleason评分≥7分、治疗前PSA≥10 ng/ml及肥胖患者应高度警惕,以制定完善的治疗计划,并应在治疗后密切随访以早期发现前列腺癌生化复发。对早期前列腺癌行根治性手术或根治性放疗可以达到相似的治疗效果,故可以根据患者的身体状况和意愿进行选择。治疗后第2年及第5年新增的生化复发机率会增高,应该高度警惕,积极随访。
| [1] | Fradet Y, Klotzl, Trachtenberg J, et al. The burden of prostate cancer in Canada[J]. Can Urol Assoc J, 2009, 3(3 Suppl 2): 92-100. |
| [2] | He HQ, Fan SF, Yang AC, et al. ADC values and Gleason scores of prostate cancer clinical stage and the correlation of PSA study [J]. Yi Xue Ying Xiang Xue Za Zhi, 2009, 19(5): 587-591. [何海清, 樊树峰, 杨爱春, 等. 前列腺癌ADC值与Gleason评分、临床分期及PSA的相关性研究[J]. 医学影像学杂志, 2009, 19(5): 587-91.] |
| [3] | Freedland SJ, Moul JW. Prostate specific antigen recurrence after definitive therapy[J]. J Urol, 2007, 177(6): 1985-91. |
| [4] | Lin NZ, Xia M. Biochemical recurrence after the eradicative resection of prostate cancer risk factors and prediction research progress[J]. Zhonghua Yi Xue Za Zhi, 2009, 89(24): 1721-3. [林宁珠, 夏溟. 前列腺癌根治术后生化复发危险因素及预测研究进展[J]. 中华医学杂志, 2009, 89(24): 1721-3.] |
| [5] | Pollack A, Hanlon AL, Horwitz EM, et al. Prostate cancer radiotherapy dose response: an update of the fox chase experience[J]. J Urol, 2004, 171(3): 1132-6. |
| [6] | Zanatta DA, Andrade RJ, Pacagnan EF, et al. Early stage prostate cancer: biochemical recurrence after treatment[J]. Int Braz J Urol, 2014, 40(2): 137-45. |
| [7] | Lee JT, Lee S, Yun CJ, et al. Prediction of perineural invasion and its prognostic value in patients with prostate cancer[J]. Korean J Urol, 2010, 51(11): 745-51. |
| [8] | Siddiqui SA, Sengupta S, Slezak JM, et al. Impact of patient age at treament on outcome following radical retropubic prostatectomy for prostate cancer[J]. J Urol, 2006, 175(3 Pt 1): 952-7. |
| [9] | Magheli A, Rais-Bahrami S, Humphreys EB, et al. Impact of age on biaochemical recurrence rates following radical prostatectomy[J]. J Urol, 2007, 178(5): 1933-7. |
| [10] | Pfitzenmaier J, Pahemik S, Tremmel T, et al. Positive surgical margins after radical prostatectomy:do they have an impact on biochemical or clinical progression?[J]. BJU Int, 2008, 102(10): 1413-8. |
| [11] | Boorjian SA, Thompson RH, Siddiqui S, et al. Long-term outcome after radical prostatectomy for patients with lymph node positive prostate cancer in the prostate specific antigen era[J]. J Urol, 2007, 178(3 Pt 1): 864-70. |
| [12] | Fukuhara H, Kume H, Suzuki M, et al. Maximum tumor diameter: a simple independent predictor for biochemical recurrence after radical prostatectomy[J]. Prostate Cancer Prostatic Dis, 2010, 13(3): 244-7. |
| [13] | Pastori J, Balssa L, Lillaz J. Existence of pattern 5 on radical prostatectomy:Poor prognostic factor associated with a lower biochemical recurrence-free survival[J]. Prog Urol, 2014, 24(7): 433-40. |
| [14] | Reese AC, Cooperberg MR, Carroll PR. Minimal impact of clinical stage on prostate cancer prognosis among contemporary patients with clinically localized disease[J]. J Urol, 2010, 184(1): 114-9. |
| [15] | Molina Escudero R, Herranz-Amo F, Paez-Borda A. Predictive postoperative model for biochemical recurrence in patients with localized prostate cancer treated with radical prostatectomy as monotherapy[J]. Arch Esp Urol, 2014, 67(3): 259-67. |
| [16] | Warner JN, Nunez RN, Mmeje CO, et al. Impact of margin status at 37 months after robot assisted radical prostatectomy[J]. Can J Urol, 2011, 18(6): 6043-9. |
| [17] | Thompson RH, Blute ML, Slezak JM, et al. Is the GPMS scoreing alporith for patients with prostate concer valid in the contemparyera?[J]. J Urol, 2007, 178(2): 459-63. |
| [18] | Barry Delongchamps N, Peyromaure M, Kpatcha F, et al. pT3N0 prostate cancer treated with radical prostatectomy as sole treatment:Oncological results and predictive factors of recurrence[J]. Prog Urol, 2012, 22(2): 100-5. |
| [19] | Brassell SA, Kao TC, Sun L, et al. Prostate specific antigen versus prostate-specific antigen density as predictor of tumor volume, margin status, pathologic stage, and biochemical recurrence of prostate cancer[J]. Urology, 2005, 66(6): 1229-33. |
| [20] | Okubo H, Ohori M, Ohno Y, et al. Prediction of non-biochemical recurrence rate after radical prostatectomy in a Japanese cohort: development of a postoperative nomogram[J]. Int J Urol, 2014, 21(5): 479-83. |
| [21] | Raatikainen S, Aaltomaa S, Palvimo JJ, et al. TWIST overexpression predicts biochemical recurrence-free survival in prostate cancer patients treated with radical prostatectomy[J]. Scand J Urol, 2015, 49(1): 51-7. |
| [22] | Merglen A, Schmidlin F, Fioretta G, et al. Short-and long-term mortality with localized prostate cancer[J]. Arch Intern Med, 2007, 167(18): 1944-50. |
| [23] | González-San Segundo C, Herranz-Amo F, Alvarez-González A, et al. Radical prostatectomy versus external-beam radiotherapy for localized prostate cancer:long-term effect on biochemical control-in search of the optimal treatment[J]. Ann Surg Oncol, 2011, 18(10): 2980-7. |
| [24] | Arcangeli G, Strigari L, Arcangeli S, et al. Retrospective comparison of external beam radiotherapy and radical prostatectomy in high-risk, clinically localized prostate cancer[J].Int J Radiat Oncol Biol Phys, 2009, 75(4): 975-82. |
 2015, Vol. 42
2015, Vol. 42