文章信息
- 王舒,倪青. 2015.
- WANG Shu, NI Qing. 2015.
- 钼靶、彩超及磁共振在乳腺导管原位癌中的诊断价值
- Accuracy of Mammography, Color Doppler Ultrasonography and Magnetic Resonance Imaging in Predicting Ductal Carcinoma in Situ
- 肿瘤防治研究, 2015, 42(06): 597-600
- Cancer Research on Prevention and Treatment, 2015, 42 (06): 597-600
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.09.002
-
文章历史
- 收稿日期:2015-01-16
- 修回日期:2015-03-30
近年来乳腺癌发病率逐年递增,相关影像学检查手段亦日臻完善,乳腺导管原位癌(ductal carcinoma in situ,DCIS)的检出率明显提升,实现了乳腺癌的早诊、早治,有效地降低了乳腺癌患者的死亡率。就DCIS诊断而言,钼靶(mammography,MG)、彩超(color Doppler ultrasonography,CDUS)是最为常用的影像检查手段,具有特异性,但也存在一定的假阴性,目前磁共振(magnetic resonance image,MRI)也较多地应用于DCIS的诊断、鉴别诊断及临床研究中,但同时也存在敏感度较高、特异性不足的问题。本研究回顾性分析贵州省人民医院乳腺外科收治的26例乳腺导管原位癌临床资料,分析三种检查方法的影像表现特征,探讨如何合理选用这些检查手段对DCIS进行诊断。 1 资料与方法
1.1 一般资料
本研究中26例乳腺导管原位癌患者,均来自贵州省人民医院2009年7月—2014年9月收治的患者。术前均行钼靶、彩超、磁共振检查。患者均为初治女性,年龄27~77岁,平均年龄51岁。 1.2 设备与方法
钼靶检查采用德国西门子数字钼靶机,设备型号MAMMOMAT 300 NOVA,行双侧乳腺CC位(头足位)、MLO位(内外侧斜位)摄片。观察病变位置、范围、形状、边缘、内部钙化、腺体致密程度、乳头、皮肤、腋窝淋巴结等情况。彩超检查采用德国西门子彩色多普勒高频探头,型号SIEMENS-S2000,行双乳检查,以乳头为中心行放射状和逆放射状扫查,对病变处进行纵、横、斜切扫查。观察病变位置、范围、边缘、包膜、钙化、血流等情况,判断病变区回声情况。磁共振检查采用德国西门子3.0T大孔径短磁体磁共振,型号MAGNETOM Verio,行双乳定位扫描,于SE序列获取T1WI横断面图像,STIR序列获取横断面脂肪抑制T2WI图像。平扫后采用FLASH快速小角度激发序列行3D动态增强扫描,造影剂选用钆喷替酸葡甲胺(Gd-DTPA)。观察病变位置、范围、形态、边缘及时间-信号强度曲线(TIC),TIC上信号呈持续渐进性强化为持续上升型(Ⅰ型),强化初期迅速上升中后期呈平台状为平台型(Ⅱ型);信号强度在中后期呈下降趋势为廓清型(Ⅲ型)。同时,对乳腺结节的评估参照乳腺影像报告和数据系统(breast imaging reporting and data system,BI-RADS)。 1.3 统计学方法
所有数据均采用SPSS19.0进行统计学分析,与术后病理对照,钼靶、彩超及磁共振增强检查对DCIS的诊断准确率比较采用Kruskal-Wallis方法进行检验,P<0.05为差异有统计学意义。 2 结果
2.1 DCIS在钼靶上的表现
通过钼靶检测发现,本组26例DCIS患者中,单纯钙化点14例(54%)、钙化点伴结节2例(7.7%,其中1例表现为良性钙化)、钙化点伴结构紊乱3例(11.5%)、单纯结节2例(7.7%,其中1例表现为良性结节)、结节伴结构紊乱3例(11.5%)、单纯结构紊乱2例(7.7%)。26例钼靶片中表现为特征性密集的微小钙化灶18例(70%)。26例DCIS BI-RADS分级:0级3例(11.5%)、1~3级3例(11.5%)、4~5级20例(77%),见图 1。
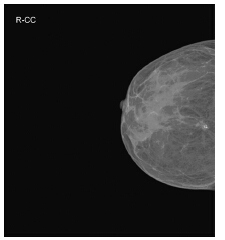
|
| 图 1 钼靶示乳腺导管原位癌右乳外上象限细小密集钙化 Figure 1 Ductal carcinoma in situ(DCIS), clustered dense microcalcification in upper outer quadrant of right breast at MG |
通过彩超检测,本组26例DCIS患者中,单纯结节16例(62%)、结节伴钙化6例(23%)、单纯导管扩张3例(11.5%)、无任何异常表现1例(3.8%)。彩超共检出22例结节,表现为特征性无包膜、低回声13例(59%),结节中伴血流信号10例(45%)。26例DCIS BI-RADS分级:0级8例(31%)、1~3级5例(19%)、4~5级 13例(50%),见图 2。
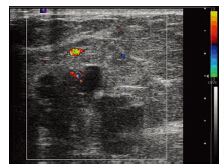
|
| 图 2 彩色超声示右乳不规则低回声结节伴血流信号 Figure 2 DCIS, irregular low-echo nodule with blood flow signal of right breast at CDUS |
通过磁共振检测,本组26例DCIS患者中,非肿块样强化19例(73%)、单纯结节3例(11.5%)、结节伴导管扩张4例(15%);26例DCIS病灶中,7例表现为I型(27%)、15例病灶TIC曲线表现为Ⅱ型(58%)、4例TIC表现为Ⅲ型(15%);26例DCIS BI-RADS分级:0级4例(15%)、4~5级 22例(85%),见图 3。
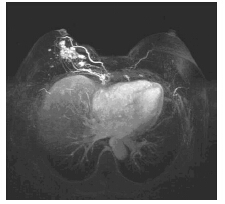
|
| 图 3 磁共振示右乳非肿块样不均匀强化病灶 Figure 3 MRI showed that DCIS, the lesion was non-mass like and heterogeneous enhancement |
钼靶诊断正确率为77%(20/26),彩超为50%(13/26),磁共振增强为85%(22/26),钼靶联合彩超的诊断正确率为85%(22/26),钼靶联合磁共振增强为92%(24/26),彩超联合磁共振增强为85%(22/26),钼靶联合彩超联合磁共振增强为96%(25/26),检查结果采用Kruskal-Wallis检验(χ2=22.281,P=0.001)差异有统计学意义,见表 1。
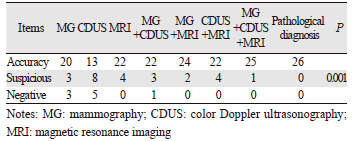 |
相关研究显示,预计在未来的十几年内,我国中青年女性的乳腺癌发病率以及绝对人数都会有明显的增长[1]。提高乳腺癌中DCIS的诊断率对治愈乳腺癌有重要意义。要提高DCIS的诊断率除了要在健康人群中开展乳腺癌的普查外,还要合理应用各种乳腺影像检查手段。钼靶、彩超及磁共振增强等,各具优缺点。
钼靶是乳腺疾病及40岁以上妇女乳房最为常规的检查手段,DCIS在X线上常见的表现依次为:钙化、非钙化肿块、结构紊乱。国外相关报道显示DCIS病灶中约90%伴有微钙化[2],而钼靶X线检查钙化敏感度高达85%[3]。本组钼靶检查DCIS诊断率为77%,其中18例表现为典型密集的微小钙化灶,敏感度较国外水平低[3],钼靶X线显示钙化受乳腺腺体致密程度影响,一般年轻女性较年老女性腺体致密,亚裔女性较欧美女性腺体致密,而我国女性乳腺癌发病年龄平均较国外年轻10~15岁,检查结果考虑与以上因素相关;非钙化恶性结节1例,边缘不规则,有毛刺,对于诊断乳腺导管原位癌有支持作用;单纯结构紊乱2例,表现为走行紊乱、形态不规则的较高密度影,这种异常区域不同于该侧乳腺的其余部位,也与对侧乳腺的相应的部位不同;考虑与钼靶对致密腺体型诊断较困难相关,且钼靶对缺乏典型的钙化或肿块表现的DCIS易漏诊[4]。
较钼靶而言,彩超更易发现致密型乳腺腺体中的低回声肿瘤病灶,但多数DCIS在彩超上常缺乏典型特征性表现。李娜等[5]对92例DCIS彩超分析显示DCIS的表现依次为:肿块型、导管扩张型、局部结构紊乱型、单纯微钙化型;同时,汪登斌[6]的相关研究指出DCIS在彩超上表现多为形态不规则的低回声区伴点状强回声改变,导管扩张、病变后方回声也较为常见,但彩色超声对非肿块型和少血供肿块的诊断并不敏感。与本研究结果基本一致,均认为彩色超声对肿块发现率高于钼靶摄片,多数肿块表现为不规则或边缘模糊,且多为低回声,而血供丰富的肿块更利于诊断。但彩色超声对钙化灶显示较差,本研究中钼靶钙化发现率为77%,彩色超声钙化发现率仅为23%。
同时比较钼靶、彩超、磁共振增强三种检查方法独立诊断DCIS,磁共振增强的诊断率最高,可达85%。磁共振对软组织分辨率高,可行多层面、多角度扫描,组织形态及血流动力特点在动态增强成像时显像清晰,利于病灶的发现、定位及判断病灶与周围组织的关系,同时磁共振还具有无辐射、无创的优点[7]。据报道磁共振增强诊断DCIS的准确率超过90%[8]。国外文献报道78%的DCIS表现为非肿块样强化,以段状及线状不均匀强化最常见[9];相关文献指出,病灶时间-信号强度(TIC)曲线表现为Ⅱ型(平台型)、Ⅲ型(廓清型)要考虑恶性可能[10]。本研究中26例磁共振增强发现非肿块样强化病变19例,占磁共振增强明确诊断DCIS的79%,与国外报道相近;本研究中26例DCIS显示为Ⅱ、Ⅲ型的TIC共19例,占73%,说明Ⅱ、Ⅲ型的TIC表现是DICS的特征表现之一;而单纯结节3例和结节伴导管扩张4例,不伴TIC表现的磁共振增强图像对DCIS诊断无帮助,但结合彩超或钼靶可提高诊断率。与钼靶和彩超相比,磁共振增强对DCIS的诊断率更高,不易漏诊,但仍存在诸多问题,如:磁共振增强对钙化相对不敏感,假阳性率高[11],检查时间长、费用昂贵。
综合比较钼靶、彩超、磁共振增强及两两联合或三项联合使用对DCIS的诊断率分析,两两联合诊断优于钼靶、彩超的独立诊断,三项联合诊断准确率最高,可达96%。在钼靶、彩超联合检查时,出现1例漏诊,3例性质不定。该例漏诊患者在钼靶上未见异常改变,彩超上表现为单纯导管扩张,磁共振增强诊断不能明确病变性质,手术活检确诊DCIS;3例性质不定患者钼靶显示腺体密度75%均为致密型乳腺,钼靶BI-RADS分级0级,彩超表现为规则结节,结节无完整包膜,伴丰富血流信号,磁共振增强诊断为DCIS。说明对腺体致密型乳房,钼靶检查无优势,若伴有结节并血流,则彩超检查有优势,若无结节或结节血流不丰富,则磁共振增强有优势。比较三种影像学检测方法,磁共振增强对DCIS诊断率虽较高,但缺乏特异性,且时间较长、价位高昂,不宜作为首选方案;而钼靶对DCIS诊断率相对较高,且乳腺彩超可有效弥补其对缺乏典型密集钙化及伴血流丰富结节的DCIS诊断困难的缺点,同时两者兼有操作简单、耐受性好、价格便宜的优势,两者联合检测可作为首选方案;当彩超发现无完整包膜、伴丰富血流信号的规则结节,且钼靶提示BI-RADS分级0级,即两者联合不能定性时,行磁共振增强进一步诊断,避免漏诊。钼靶、彩超及磁共振增强的联合使用有助于早期发现乳腺DCIS。只有合理选择相应的检查手段,才能尽可能节约患者的医疗费用,不漏诊,进而实现乳腺癌的早诊断、早治疗。
| [1] | Zheng Y, Wu CX, Zhang ML. The epidemic and characteristics of female breast cancer in China[J]. Zhongguo Ai Zheng Za Zhi, 2013, 23(8): 561-9. [郑莹, 吴春晓, 张敏璐. 乳腺癌在中国的流行状况和疾病特征 [J]. 中国癌症杂志, 2013, 23(8): 561-9.] |
| [2] | Barreau B, de Mascarel I, Feuga C, et al. Mammography of ductal carcinoma in situ of the breast: review of 909 cases with radiographic–pathologic correlations[J]. Eur J Radiol, 2005, 54(1): 55-61. |
| [3] | Mariscotti G, Houssami N, Durando M, et al. Accuracy of mammography, digital breast tomosynthesis, ultrasound and MR imaging in preoperative assessment of breast cancer[J]. Anticancer Res, 2014, 34(3): 1219-25. |
| [4] | Mun HS, Shin HJ, Kim HH, et al. Screening-detected calcified and non-calcified ductal carcinoma in situ: Differences in the imaging and histopathological features[J]. Clin Radiol, 2013, 68(1): e27-35. |
| [5] | Li N, Zhu QL, Jiang YX, et al. Correlation of ultrasonography and pathology for ductal carcinoma in situ[J].Zhongguo Yi Xue Ying Xiang Ji Shu, 2011, 27(6): 1150-4. [李娜, 朱庆莉, 姜玉新, 等. 乳腺导管内原位癌的超声表现与病理相关性[J]. 中国医学影像技术, 2011, 27(6): 1150-4.] |
| [6] | Wang DB. Imaging study on the ductal carcinoma in situ of the breast[J]. Ci Gong Zhen Cheng Xiang, 2012, 3(2): 109-13.[汪登斌. 乳腺导管原位癌的影像学研究[J]. 磁共振成像, 2012, 3(2): 109-13.] |
| [7] | Greenwood HI, Heller SL, Kim S, et al. Ductal carcinoma in situ of the breasts: review of MR imaging features[J]. Radiographics, 2013, 33(6): 1569-88. |
| [8] | Kim JS, Lee SM, Cha ES. The diagnostic sensitivity of dynamic contrast-enhanced magnetic resonance imaging and breast-specific gamma imaging in women with calcified and non-calcified DCIS [J]. Acta Radiol, 2013, 55(6): 668-75. |
| [9] | Morakkabati-Spitz N, Leutner C, Schild H, et al. Diagnostic usefulness of segmental and linear enhancement in dynamic breast MRI [J]. Eur Radiol, 2005, 15(9): 2010-7. |
| [10] | Nishiura M, Tamaki Y, Murase K. Differentiation between ductal carcinoma in situ and mastopathy using dynamic contrast-enhanced magnetic resonance imaging and a model of contrast enhancement[J]. Eur J Radiol, 2011, 80(3): 740-3. |
| [11] | Berg WA, Madsen KS, Schilling K, et al. Comparative effectiveness of positron emission mammography and MRI in the contralateral breast of women with newly diagnosed breast cancer [J]. AJR Am J Roentgenol, 2012, 198(1): 219-32. |
 2015, Vol. 42
2015, Vol. 42


