文章信息
- 王维娜,陈海霞,张银华,赵峰,张焕,陈定宝. 2015.
- WANG Weina, CHEN Haixia, ZHANG Yinhua, ZHAO Feng, ZHANG Huan, CHEN Dingba. 2015.
- 乳腺包被性乳头状癌的临床病理分析
- Clinicopathologic Analysis of Encapsulated Papillary Carcinoma of Breast
- 肿瘤防治研究, 2015, 42(06): 591-596
- Cancer Research on Prevention and Treatment, 2015, 42 (06): 591-596
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.09.002
-
文章历史
- 收稿日期:2014-04-17
- 修回日期:2015-01-04
2. 100044 北京,北京大学人民医院病理科
2. Department of Pathology, Peking University People’s Hospital, Beijing 100044, China
乳腺包被性乳头状癌(encapsulated papillary carcinoma,EPC)是一种特殊类型的乳头状癌,在2012年之前被称为囊内乳头状癌(intracystic papillary carcinoma)或被囊性乳头状癌,其发生率不足2%[1, 2]。
囊内乳头状癌在WHO(2003版)乳腺肿瘤分类标准中被归为导管内乳头状癌的一种特殊亚型,发生于囊状扩张的导管内。随着对乳头状癌的进一步认识,发现囊内乳头状癌囊壁周围缺乏肌上皮细胞层(MEC),更多的学者质疑囊内乳头状癌是否为导管内病变。WHO(2012版)乳腺肿瘤分类标准中,对囊内乳头状癌有了新的认识和分类,认为囊内乳头状癌与公认的原位性病变不同,提示可能是一种最低限度的浸润癌或是一种低级别、惰性浸润癌,将其作为乳头状病变中的一个独立病种进行阐述,更名为包被性乳头状癌更准确,更能反映病变的性质[3]。
本研究结合文献资料,对本院诊治的35例新疆地区EPC病例从临床病理特点、生物学行为、预后随访信息等进行阐述,旨在加深对这一少见病变的认识,探讨其诊断标准和治疗方案。 1 资料和方法
1.1 临床资料
收集新疆医科大学附属肿瘤医院病理科2010年1月—2013年12月间诊断为“囊内乳头状癌”、“包被性/包裹性乳头状癌”、“导管内乳头状癌”和“实性乳头状癌”等病例共125例,经过两名有经验的病理医师复习所有病例HE及免疫组织化学染色结果,依据WHO(2012版)乳腺肿瘤分类对EPC的诊断标准,最终筛选出35例EPC病例,根据EPC病变周围是否伴随导管病变,共分为四组,分别为单纯性EPC 22例、EPC伴导管原位癌(ductal carcinoma in situ,DCIS)7例、EPC伴微浸润癌(microinvasion,MI)4例、EPC伴非特殊类型浸润癌(invasion carcinoma,IC)2例,同时随机挑选48例导管内乳头状癌作为对照组。查阅电子病历,收集患者的各项临床资料及随访信息。 1.2 方法
标本经10%的中性福尔马林液固定,石蜡包埋,常规切片厚4 μm,HE染色,免疫组织化学采用EnVision二步法,选用抗体包括p63、CK5/6、雌激素受体(ER)、孕激素受体(PR)、人类表皮生长因子受体(HER2)及试剂盒均购自北京中杉金桥生物公司。 1.3 免疫组织化学结果判断
ER、PR免疫组织化学结果判断标准[1]:≥5%的细胞核染色即为ER、PR(+);HER2免疫组织化学结果判断标准[4]:无阳性细胞或任何比例的细胞呈现微弱、不完整的细胞膜着色均视为阴性(+/-);>10%的细胞呈现不完整和(或)弱至中等强度的细胞膜染色,或≤10%细胞呈现强且完整的膜着色为++;>10%细胞呈现强、完整、均匀的胞膜着色为+++,+++视为HER2阳性,++视为HER2染色不确定,需进一步应用荧光原位杂交法进行HER2基因扩增状态的检测。CK5/6为胞质着色,p63为胞核着色,免疫结果半定量评分如下:病变周围肌上皮完全阴性为0;局灶或散在阳性染色为+,部分不连续中等阳性染色为++,部分连续至完全强阳性染色为+++。 2 结果
2.1 临床特征
35例EPC患者均为女性,27例汉族、8例少数民族(维吾尔族6例、回族2例),年龄范围29~83岁,平均61岁,中位年龄64岁。均因发现乳腺肿块或乳头溢液就诊,病程1周~5年,中位时间2月,32例表现为乳腺肿块,8例伴疼痛,4例有乳头溢液 ,2例无临床症状,经超声或钼靶检查发现。35例中,发生于左乳20例、右乳15例,其中发生于左乳的1例EPC为同时性双侧原发性乳腺癌,其右乳伴有大汗腺导管原位癌。周围型病变32例(91.43%)、中央乳晕区病变3例(8.57%)。 2.2 病理特征
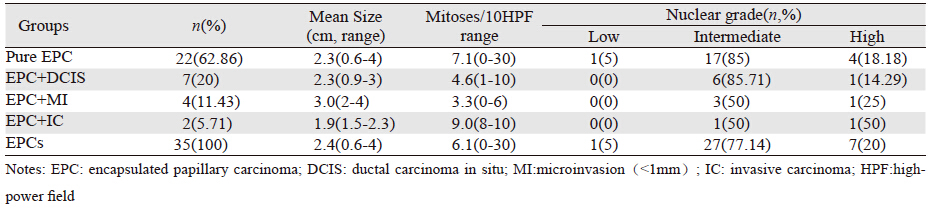
大体观察:肿物均为囊实性结节,界限清楚,结节内为细颗粒状或小乳头结构,质脆易碎,部分囊腔扩张伴明显出血,最大径0.6~4 cm,平均2.4 cm。镜下观察:病变为单发或多病灶聚集、界清、呈膨胀性生长,病变与周围乳腺组织有纤维囊壁分隔,囊内可见具有纤维血管轴心的乳头状肿物,也可见融合成实性乳头、腺管或筛孔状的结节性病变,乳头轴心及囊壁周缘未见明显肌上皮。部分EPC扩张的大囊腔被增厚的纤维囊壁分隔成多房状或多结节状与周围乳腺组织分界尚清。典型乳头状结构10例,乳头钝圆或纤细,血管轴心可伴玻璃样变性,被覆单一性复层柱状或梭形上皮,细胞排列拥挤成高柱状,细胞轻度异型,核质比增加,核分裂相少,见图 1A;实性结构20例,囊壁内覆肿瘤细胞呈实性乳头、腺管或筛状结构,并于局部形成瘤块,其内可见纤维血管间隔,部分细胞增生活跃,乳头的轴心逐渐消失,细胞互相融合成实性腺管或筛孔状,类似低级别导管原位癌结构,还可见成团成簇的肿瘤细胞散落在囊腔内,类似微乳头型导管内癌,5例可见细胞外黏液,类似实性乳头状癌,见图 1B,细胞异型明显,核分裂相0~30个/10 HPF;腺样结构1例,复杂的乳头分枝互相吻合形成腺管状,腔内可见分泌物;两种结构成分以上为混合型4例。1例EPC伴大汗腺分化,胞质丰富,均质红染,核仁明显,中等核级,可见核分裂相,见图 1C;1例EPC胞质富含脂质,透亮,见图 1D。
|
| A: Low-power view of EPC demonstrated classic papillary architecture lined by tall columnar epithelial cells(HE×100); B: EPC with low grade DCIS, there was more mucus in cystic cavity, histomorphology was similar to solid papillary carcinoma(HE×40); C: Pure EPC with apocrine features, with abundant eosinophilic cytoplasm, acidophilus, containing evident nucleoli (HE×200); D: Pure EPC with papillary structure, the cytoplasm was rich in lipid and bright (HE×200); E: EPC with pseudo microinvasion carcinoma, the invasion was present inside the fibrous capsule, local hemorrhage and inflammatory cells were observed beside the lesion (HE×100) 图 1 乳腺包被性乳头状癌形态学特点 Figure 1 Morphological features of EPC of breast |
35例EPC中,7例肿瘤细胞核的异型性为高级别、27例为中级别、1例为低级别;核分裂相0~30个/10 HPF,平均为6.1个/10 HPF,见表 1。EPC伴中级别DCIS 4例、低级别DCIS 3例。4例EPC伴微浸润癌,为纤维囊壁外浸润,浸润灶均<1 mm,其中1例囊壁外可见黏液癌细胞巢,其余均为非特殊型浸润癌。本研究2例EPC病例,微小浸润灶在囊壁内,间质有出血,炎细胞浸润,可能因穿刺移位而引起的假浸润,此2例归为单纯性EPC,见图 1E。2例EPC伴非特殊类型浸润癌病例,浸润灶分别为5 mm及8 mm,为非特殊类型浸润癌。本组3例(8.57%)发生淋巴结转移,1例EPC伴微浸润癌前哨淋巴结有癌转移(1/4),转移灶为乳头型,最大径0.5 cm;1例单纯性EPC腋窝淋巴结有癌转移(1/14),形态为实性乳头状,最大径1.5 cm,1例EPC伴IC腋窝淋巴结阳性(2/17),转移灶均为孤立性肿瘤细胞巢团,细胞数量少于200个。
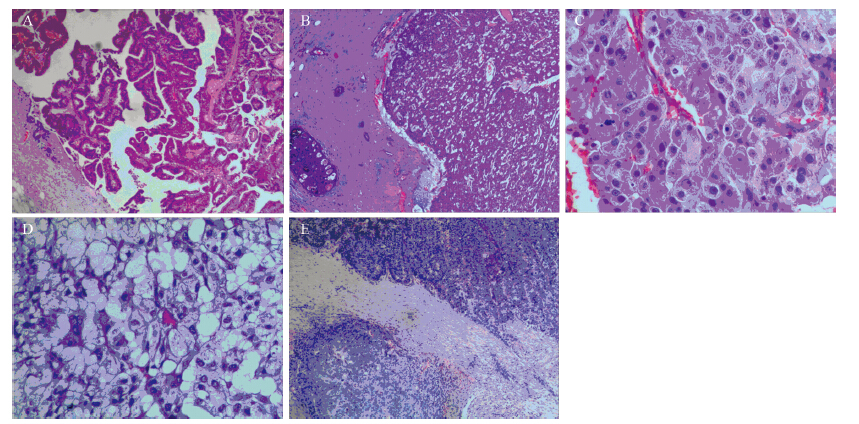
35例EPC与48例导管内乳头状癌病变内部CK5/6及p63全部阴性,病变周围肌上皮表达情况,见图 2。EPC病变周围肌上皮CK5/6表达量低于导管内乳头状癌导管周围肌上皮表达量,差异有统计学意义(χ2=56.958,P=0.000),见表 2。EPC病变周围肌上皮p63表达量低于导管内乳头状癌导管周围肌上皮表达量,差异有统计学意义(χ2 =62.224,P=0.000),见表 3。

|
| A:CK5/6 staining was completely negative within and at the periphery of the tumor, +++ staining around adjacent duct provided a positive internal control(EnVision System ×100); B: p63 staining showed negative expression within EPC lesion, and ++ staining was showed on cyst wall (EnVision System ×100) 图 2 乳腺包被性乳头状癌肌上皮CK5/6和p63免疫组织化学染色结果 Figure 2 Immunohistochemical staining of CK5/6 and p63 in myoepithelial cells in EPC of breast |
 |
 |
35例EPC行激素受体(HR)及HER2免疫组织化学染色结果显示:28例(80%)HR阳性 [包括ER和(或)PR阳性];2例(5.71%)HER2表达阳性(+++);12例(42.86%)HER2染色不确定(++),仅有1例行FISH检测,未观察到HER2基因扩增;21例(75%)HER2染色(+/-),见表 4。
 |
35例EPC患者均首选手术切除。8例行肿块切除、4例行乳腺单纯切除、10例乳腺单纯切除加前哨淋巴结活检、13例行乳腺改良根治术;术后未行治疗9例、内分泌治疗11例、化疗9例、综合治疗联合放疗4例,有2例失访患者,术后治疗情况不详。 2.5 随访信息
35例EPC患者失访2例,随访时间2~48月(平均19.6月),18例患者未定期复查,2例EPC患者分别在术后周期化疗后17月及22月,行骨扫描显示肋骨和椎骨血运丰富,代谢旺盛,考虑骨转移瘤,后者已给予唑来膦酸抗骨转移治疗,进一步放疗,未行病理活检。所有患者均存活。 3 讨论
乳腺乳头状恶性肿瘤少见,仅占乳腺癌0.5%~2%,且形态学变异较大,1983年Carter[2]的研究中将乳头状癌分为三个亚型:(1)囊内乳头状癌,不伴随导管原位癌及浸润癌;(2)导管内乳头状癌;(3)浸润性乳头状癌。已将囊内乳头状癌与原位癌及浸润性乳头状癌进行鉴别和区分。后来的研究进一步证实,EPC并非位于扩张的导管内,囊壁周缘肌上皮大部或完全缺失。Hill等[5]于2005年首次提出了“EPC”命名,认为EPC比囊内乳头状癌更能解释囊壁周缘肌上皮的明显减少或者缺失。 3.1 临床特点
EPC多见于绝经期女性,偶见于男性,亦有少数年轻患者,平均发病年龄比普通乳腺癌大,文献报道34~92岁均可发生,平均71岁[6]。Akagi等[6]报道从发现肿块到明确诊断,一般经历5月的时间,这提示与普通类型乳腺癌相比,该肿瘤的生长速度更慢,组织学分级较低且不易形成溃疡。本组病例临床特点与既往报道基本一致,我院从2010—2013年间共诊治5 550例乳腺癌患者,EPC病例占0.63%,35例EPC患者均为女性,发病年龄为29~83岁,平均年龄61岁,中位年龄64岁,≤50岁的患者有12例(34.29%),提示发生于中青年组的EPC比例也较高。本组病例肿块最大径0.6~4 cm,平均2.4 cm,并未观察到肿块大小与EPC伴随病变有直接关系。
研究认为EPC病变多位于乳晕下方,伴或不伴有乳头溢液[7]。魏兵等[8]研究提到囊内乳头状癌多为中央型或孤立性,中央型病变不仅位于乳晕区域,也可位于乳腺实质内,乳头溢液是最常见的症状,见于64%~88%的患者中,仅有少数可触及乳房肿块。本组病例均可触及肿块,仅有4例伴乳头溢液。 3.2 组织学特征
乳腺肿瘤WHO分类(2012版)对EPC的定义是:低-中级别的肿瘤上皮细胞被覆的纤维血管细乳头完全包裹在纤维被膜内,多数病变的乳头内或病变周围缺少肌上皮细胞层。
本组EPC的组织学特征主要有乳头状结构和实性结构(实性乳头、腺管、筛孔状)构成。单纯性EPC也可出现核级别高,核分裂相>30个/10HPF的病例,说明核分级、核分裂数与EPC伴随的病变并无直接关系。
EPC伴微浸润癌,浸润灶在囊壁外浸润小于1 mm,视为真性浸润,本研究有2例EPC病例,浸润灶在囊壁内,且浸润灶间质有出血,炎性细胞浸润,可能因穿刺移位而引起的假浸润,此2例归为单纯性EPC,见图 1E。有学者认为单纯性EPC与EPC伴微浸润癌两者的预后相似,对两者区别并无临床意义[9]。 3.3 病理诊断
EPC病变周围的纤维性包膜是区分EPC与导管内乳头状癌及浸润癌的重要特征之一,EPC最重要特征是纤维囊壁内肌上皮的明显缺失。
Collins等[10]研究将肿瘤性导管周缘完全缺乏肌上皮层的病例定义为EPC,Hill等[5]认为用“完全缺乏肌上皮”定义EPC过于严格,囊壁周缘明显减少或完全缺乏肌上皮,可定义为EPC。但 Hill等并未明确诊断EPC 最低可以接受的残留肌上皮数量[5]。
肌上皮存在与否是诊断良恶性乳头状肿瘤重要标志之一。本组采用CK5/6和p63进行双标,是标记肌上皮比较好的组合。本组EPC病例囊壁周围CK5/6与p63的肌上皮染色结果与导管内乳头状癌相比,肌上皮明显减少,差异有统计学意义。Eposito[11]研究指出导管原位癌周围的肌上皮可随着细胞核级的增高,逐渐减少,甚至完全缺失。作为本组对照组的导管内乳头状癌导管周围的肌上皮未见明显缺失。
Eposito等[11]研究中EPC囊壁周围有Ⅳ型胶原呈++~+++强度染色,而周围浸润癌呈弱及不连续阳性,认为EPC是原位癌。Wyveen等[1]研究中大部分EPC呈不连续+~++,1例为阴性,而腋窝淋巴结转移灶中也出现Ⅳ型胶原阳性,故认为基底膜染色不是判断EPC间质浸润的可靠指标,甚至认为EPC周边连续阳性基底膜染色也不能认为是导管原位癌。Rakha等[12]研究基质金属蛋白酶类(MMPs)等在EPC、DCIS及浸润癌中的表达情况,得出结论:EPC表达与浸润相关的标志物,更进一步证实了EPC介于DCIS与浸润癌之间,生物学行为类似DCIS。Rakha还发现EPC中转录生长因子受体-β表达上调,可解释EPC纤维包裹是反应性病变而非导管壁的膨胀性生长。Collins等[10]认为至少一部分(甚至可能更多的)囊内乳头状癌单从组织学上表现出浸润性乳头状癌的包裹性病变,类似于包裹性甲状腺乳头状癌。 3.4 生物学行为和临床治疗
有学者报道EPC10年生存率为100%,10年无病生存率为91%[13]。Carter等[2]研究认为,单纯性EPC的预后远好于EPC伴原位癌或浸润癌,甚至认为单纯性EPC不能提示患者有进一步发展为浸润癌的风险。也有研究发现单纯性EPC可局灶复发,并累及淋巴结,并不认同EPC的预后与其是否伴随病变有关,建议术后给予辅助放疗和内分泌治疗[6]。Wyveen等[1]认为,EPC患者不同的手术方式及放射治疗与否,其复发率与死亡率没有差别,放射性治疗对单纯性EPC患者的效果目前还不确定。目前大部分学者建议单纯性EPC的治疗参照DCIS的处理方式,避免等同于传统型浸润癌,充分的局部切除是合理的选择,肿块大于1 cm者建议行前哨淋巴结活检[1]。
本组病例中,25%的单纯性EPC患者行肿块扩切,40%患者行乳腺改良根治术,EPC伴随原位癌的患者除了2例因年龄较大,给予肿块扩切,其余均行乳房单纯切除术。50%的病例术后均行化疗和(或)放射治疗,由于EPC比较罕见,目前临床中关于该病的诊疗规范不够完善。
文献报道,乳腺囊内乳头状癌(囊内乳头状癌)100%ER阳性,92.8%PR阳性,21.4%HER2阳性[6]。本组EPC中80%激素受体阳性,5.71%HER2表达阳性,由此可认为EPC是分化较好的乳腺癌。
总之,EPC被认为是一种惰性的浸润癌,生物学行为介于原位癌与浸润癌之间,若单独发生或伴随原位癌及微小浸润癌时,应参照原位癌治疗,EPC伴随浸润癌时,应参照浸润癌的治疗标准进行。
| [1] | Wynveen CA, Nehhozina T, Akram M, et al. Intracystic papillary carcinoma of the breast: an in situ or invasive tumor? Results of immunohistochemical analysis and clinical follow-up[J]. Am J Surg Pathol, 2011, 35(1): 1-14. |
| [2] | Carter D, Orr SL, Merino MJ. Intracystic papillary carcinoma of the breast after mastectomy, radiotherapy or excisional biopsy alone[J]. Cancer, 1983, 52(1): 14-9. |
| [3] | Lakhani SR, Ellis IO, Schnitt SJ, et al. WHO classification of tumours of the breast[M]. Lyon, France: IARC Press, 2012, 106-7. |
| [4] | Editorial committee of “China Consensus for HER2 Testing Guidelines in Breast Cancer(2014)”. China Consensus for HER2 Testing Guidelines in Breast Cancer(2014)[J]. Zhonghua Bing Li Xue Za Zhi, 2014, 43(4): 262-7. [《乳腺癌HER2检测指南(2014版)》编写组.乳腺癌HER2检测指南(2014版)[J]. 中华病理学杂志, 2014, 43(4): 262-7.] |
| [5] | Hill CB,Yeh IT. Myoepithelial cell staining patterns of papillary breast lesions: from intraductal papillomas to invasive papillary carcinomas[J]. Am J Clin Pathol, 2005, 123(1): 36-44. |
| [6] | Akagi T, Kinoshita T, Shien T, et a1.Clinincal and pathological features of intracystic papillary carcinoma of the breast[J]. Surg Today, 2009, 39(1): 5-8. |
| [7] | Seal M, Wilson C, Naus GJ, et a1. Encapsulated apocrine papillary carcinoma of the breast-a tumour of uncertain malignant potential:report of five cases[J]. Virchows Arch, 2009, 455(6): 477-83. |
| [8] | Liu YS, Wei B, Bu H, et al. A clinicopatholgic study of breast encapsulated papillary carcinoma[J]. Lin Chuang Yu Shi Yan Bing Li Xue Za Zhi, 2012, 28(7): 726-31. [刘裔莎, 魏兵, 步宏, 等. 乳腺包裹性乳头状癌17例临床病理观察[J]. 临床与实验病理学杂志, 2012, 28(7): 726-31.] |
| [9] | Rakha EA, Gandhi N, Climent F, et al. Encapsulated papillary catcinoma of the bteast:an invasive tumor with excellent prognosis[J]. Am J Surg Pathol, 2011, 35(8): 1093-103. |
| [10] | Collins LC, Carlo VP, Hwang H, et al. Intracystic papillary carcinomas of the breast:a reevaluation using a panel of myoepithelial cell markers[J]. Am J Surg Pathol, 2006, 30(8): 1002-7. |
| [11] | Esposito NN, Dabbs DJ, Bhargava R. Are encapsulated papillary carcinomas of the breast in situ or invasive? A basement membrane study of 27 cases[J]. Am J Clin Pathol, 2009, 131(2): 228-42. |
| [12] | Rakha EA, Tun M, Junainah E, et al. Encapsulated papillary carcinoma of the breast:a study of invasion associated markers[J]. J Clin Pathol 2012, 65(8): 710-4. |
| [13] | Ding JH, Wu WZ, Gan YL. Analysis of clinical-pathological features and prognosis of patients with encapsulated papillary carcinoma of the breast[J]. Zhongguo Ai Zheng Za Zhi, 2013, 23 (5): 357-61. [丁锦华,吴伟主,甘咏莉. 乳腺包被性乳头状癌的临床病理特征及预后分析[J] .中国癌症杂志, 2013, 23(5): 357-61.] |
 2015, Vol. 42
2015, Vol. 42