文章信息
- 毛华杰,朱燕,卢淑华,李诚城,江昊宇,黄玉梅,章迪,王晓春. 2015.
- MAO Huajie, ZHU Yan, LU Shuhua, LI Chengcheng, JIANG Haoyu, HUANG Yumei, ZHANG Di, WANG Xiaochun. 2015.
- 硒蛋白S基因G-105A、G-254A位点多态性与湖南汉族人群胃癌遗传易感性的相关研究
- Association of Selenoprotein S G-105A, G-254A Polymorphisms with Genetic Susceptibility to Gastric Cancer in Hu’nan Han Population
- 肿瘤防治研究, 2015, 42(06): 582-586
- Cancer Research on Prevention and Treatment, 2015, 42 (06): 582-586
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.09.002
-
文章历史
- 收稿日期:2014-09-26
- 修回日期:2014-12-16
2. 410013 长沙,湖南省肿瘤医院检验科;
3. 410013长沙,中南大学湘雅三医院检验科
2. Department of Clinical Laboratory Medicine, Hu’nan Provincial of Tumor, Changsha 410013, China;
3. Department of Clinical Laboratory Medicine, The Third Xiangya Hospital, Central South University, Changsha 410013, China
胃癌的病因和发病机制尚未明确,但却是多个基因改变的积累。近年来,基因遗传易感性在胃癌发生发展过程中的作用逐渐受到重视,寻找与胃癌相关的遗传位点对胃癌的防治有重要意义[1]。国外研究发现,硒蛋白基因多态性与多种恶性肿瘤发病密切相关。目前研究较多的硒蛋白有五类,分别是谷胱甘肽过氧化物酶(GPx)、硫氧还蛋白还原酶2(TrxR2)、硒蛋白(相对分子质量15000)(SEP15)、硒蛋白P(SelP)和硒蛋白S(SelS)。SelS作为一种跨膜蛋白,与内质网相关蛋白1共同组成内质网相关蛋白降解逆向转运通道,将错误折叠蛋白从内质网腔中逆向转运到细胞质中进行降解,进而抑制和调节内质网内错误折叠蛋白引发的炎性反应和免疫反应。Shibata等[2]研究结果显示SelS基因启动子上G-105A多态性位点与胃癌的遗传易感性相关携带A等位基因的个体与GG基因型的个体相比,患胃癌的风险显著增加。但在中国人群中是否也有这种改变,目前还没有针对SelS基因启动子上G-105A及G-254A多态性位点与胃癌易感性的相关报道。本实验研究中国湖南地区汉族胃癌患者和健康人群SelS基因位点的多态性分布情况,探讨该位点多态性与胃癌的相关性。 1 资料与方法
1.1 研究对象
胃癌组:收集湖南省肿瘤医院2013年10月至2014年4月胃癌住院患者全血标本113例,其中男79例,女34例;年龄31~75岁,平均年龄(54.2±11)岁。健康对照组:收集同期中南大学湘雅三医院健康体检者111例,其中男64例,女47例;年龄34~85岁,平均年龄(51.0±12)岁。经询问病史、体检和实验室检查排除冠心病、高血压、糖尿病、肝肾功能不全等其他疾病。研究对象为无血缘关系的湖南籍汉族人群,在年龄、性别、饮酒和吸烟方面比较两组一般情况差异无统计学意义,具有可比性,见表 1,标本采集均经本人同意,并经医院伦理委员会审查和认可。
基因组DNA提取试剂盒(美国OMEGA公司),蛋白酶K(20 mg/ml)(北京天为时代有限公司),DNA MarkerⅠ(北京康为公司),2×Taq PCR Master Mix(北京康为公司),FastDigest®MscⅠ (美国Thermo公司),Thermo Hybaid PX2型PCR仪(美国Thermo公司) ,UV-1800分光光度计(日本岛津制作所),微型离心机(德国Eppendorf公司)。 1.3 基因组DNA的提取
取静脉血3 ml,EDTA抗凝,采用美国OMEGA公司提供的DNA提取试剂盒提取外周血基因组DNA,操作严格按照说明书进行,紫外分光光度计测定DNA纯度及浓度,波长设为260 nm和280 nm,-20℃保存备用。 1.4 引物设计和合成
在Pubmed-SNP数据库中分别查询SelS基因rs28665122(G-105A)、rs34713741(G-254A)两侧基因序列,应用软件Premier5.0设计引物,rs28665122上游引物:5′-TCTTGGCGTTCCATGACC-3′,下游引物:5′-AGCGTAGCCGGGATTTCTC-3′,产物长度为211 bp;rs34713741上游引物5′-CTTCCGGTGCGCTCCTAC-3′,下游引物:5′-GGCGACCACTGACTTCCTT-3′,产物长度为302 bp,通过Primer-BLAST验证引物的特异性并由南京诺唯赞生物科技有限公司合成引物。 1.5 PCR扩增
PCR反应体系为25 μl,包括2×Taq PCR Master Mix 12.5 μl,DNA模板 2 μl(约100 ng),上下游引物(10 μmol/l)各1 μl,灭菌双蒸水8.5 μl;rs28665122 PCR反应条件:94℃ 5 min,94℃ 30 s,59℃ 30 s,72℃ 30 s,72℃ 2 min,共30个循环。rs34713741 PCR反应条件:94℃ 5 min,94℃ 30 s,65℃ 30 s,72℃ 30 s,72℃ 10 min,共35个循环。PCR产物用2%琼脂糖凝胶电泳,在分子凝胶成像仪上检测PCR扩增产物特异性和扩增效率。 1.6 基因分型鉴定
rs28665122用FastDigest®MscⅠ(酶切位点为5′-TGG↓CCA -3′或3′-ACC↑GGT-5′)进行酶切反应,反应总体系为30 μl,包括PCR产物10 μl,FastDigest®MscⅠ 1 μl和10×限制性内切酶Buffer 2 μl,灭菌双蒸水17 μl;离心机瞬时离心5 s,以集中样品;于37℃水浴30 min后,酶切产物在2.5%琼脂糖凝胶中电泳,分子凝胶成像仪下判读并拍照记录。rs34713741用FastDigest®HinfⅠ(酶切位点为5′-G↓ANTC-3′或3′-CTNA↑G-5′)进行酶切反应,反应总体系同rs28665122;于37℃水浴5 min后,酶切产物在2.5%琼脂糖凝胶中电泳,分子凝胶成像仪下判读并拍照记录。分别随机选取50个PCR产物进行纯化后送上海铂尚生物技术有限公司测序。 1.7 统计学方法
用SPSS19.0进行统计学分析。样本群体SNP位点多样性进行Hardy-Weinberg平衡检验,以检验样本的代表性。胃癌组和对照组等位基因频率、基因型频率分布采用卡方检验及Fisher确切概率法分析,检验水准为α=0.05。 2 结果
2.1 SelS基因rs28665122和rs34713741位点PCR结果
见图 1A为SelS基因rs28665122 PCR产物,产物长度211 bp。见图 1B为SelS基因rs34713741 PCR产物,产物长度302 bp。

|
| M: DNA marker I; A: 1~8: rs28665122 loci objective stripe; B: 1~9: rs34713741 loci objective stripe 图 1 SelS基因PCR产物电泳结果 Figure 1 Electrophoresis results of PCR products of SelS gene |
rs28665122位点基因多态性分型:经限制性内切酶MscⅠ消化后只有1种酶切结果,见图 2A,即野生型纯合子GG型,电泳图仅可见1条211 bp条带。rs34713741位点基因多态性分型:经限制性内切酶HinfⅠ消化后可见3种酶切结果,分别为CC、TT、CT型,见图 2B。野生型纯合子CC含有HinfⅠ酶切位点,产生198 bp和104 bp两个片段,电泳图可见2条条带,突变型纯合子TT不含有HinfⅠ酶切位点,经HinfⅠ内切酶消化后仅有1条302 bp条带。杂合子CT型可被HinfⅠ酶切割为302 bp、198 bp、104 bp三个片段,电泳图可见3条条带。PCR产物经DNA测序验证,结果与酶切结果一致。

|
| M: DNA marker; A: 1-7: GG genotype; B: 1, 2, 4, 5, 6, 7, 9: CC genotype, 3: CT genotype, 8: TT genotype 图 2 SelS rs28665122、rs34713741位点基因多态性酶切产物的电泳结果 Figure 2 Electrophoresis results of enzyme digestion products of SelS rs28665122 and rs34713741 gene polymorphisms |
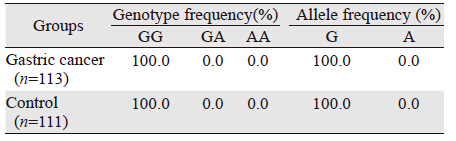
SelS rs28665122位点基因型及等位基因频率分布见表 2。结果表明,胃癌组、健康对照组基因型和等位基因频率分布无差异。SelS rs34713741位点基因型及等位基因频率分布见表 3,该研究人群基因型分布均符合Hardy—Weinberg平衡(PH-W>0.05),具有群体代表性。经χ2检验及非条件Logistic回归分析,胃癌组和健康对照组CC、CT、TT基因型比较差异有统计学意义(χ2=5.399,P<0.05,OR=1.89,95%CI: 1.10~3.23);两组等位基因频率差异也有统计学意义(χ2=7.399,P<0.05)。
 |
 |
经过统计分析发现rs34713741位点CT和TT基因型在低分化癌组和淋巴结转移组明显增高,其与胃癌组的病理分化程度、淋巴结转移具有相关性(P<0.05),而与年龄、性别、浸润深度、Borrmann分型、肿瘤位置无相关性(P>0.05),见表 4。
 |
SelS基因[3, 4, 5, 6, 7, 8, 9]位于15q26.3,包含有6个外显子和5个内含子,有两个分别由1 250和1 292个碱基组成的转录变体,均编码由189个氨基酸残基组成的蛋白,其中第188位为硒代半胱氨酸残基。SelS在生物体内分布广泛,在肝脏、心脏、肾脏、骨骼肌、脂肪组织、下丘脑和睾丸中都有其特征表达。SelS是一种内质网和细胞膜硒驻留蛋白,其生物学功能主要包括保护细胞免受氧化损伤、参与炎性反应和细胞凋亡、降解内质网相关蛋白。SelS基因发生突变,可能影响其蛋白功能的正常发挥,进而降低机体抵御肿瘤发生的能力。
胃癌是一种基因改变而引起的疾病,它的发生是一个多步骤、多因素进行性发展的过程。目前研究[10]报道了SelS基因的15个多态位点(-539delT、G-105A、T12710C、G-254A、G1393A、G3217A、G3705A、G4283A、A4502G、C5227T、A5265G、A6218G、T9707C、C-1500A和C9000G),但研究最多的还是SelS基因的G-105A(rs28665122)和G-254A(rs34713741)两个多态性位点。Curran等[11]在2005年对92个美国家系SelS基因除了C-1500A和C9000G的13个多态性位点进行了检测,结果显示,有3个多态性位点与炎症因子相关联,分别为G-105A、G3705A和C5227T;G-105A位点是功能性位点,能够影响炎性因子的表达。Santos等[12]对481例桥本氏甲状腺炎患者和516例健康体检者的SelS rs28665122位点进行检测,发现携带A等位基因的个体与GG基因型的个体相比,其患桥本氏甲状腺炎的风险显著增加。Shibata等[2]采用了聚合酶链式反应-限制性片段长度多态性(polymerase chain reaction-restriction-fragment length polymorphism,PCR-RFLP)的方法,以日本268例胃癌患者和306非胃癌健康对照组为研究对象,检测位于SelS基因启动子上G-105A多态性位点与胃癌的遗传易感性,结果显示,携带A等位基因的个体与GG基因型的个体相比,其患胃癌的风险显著增加。Wang等[13]研究了GPx3的单核苷酸多态性与胃癌的关联性,发现GPx3基因内含子rs3805435、rs3828599两个位点的多态性可以影响基因的表达从而降低胃癌的发生危险。王佳等[10]对硒蛋白GPx1和TXNRD2两个基因多态性与胃癌遗传易感性的关系进行研究,发现单独GPX1和TXNRD2多态性与胃癌易感性无关,但是GPX1和TXNRD2基因多态性的相互作用可以降低胃癌的风险。
目前,国内还没有针对SelS基因多态性与胃癌的遗传易感性的相关报道。本研究采用PCR-RFLP技术对湖南汉族人群进行基因检测并经DNA测序验证酶切结果的准确性,证实该人群中可能不存在SelS rs28665122基因多态性位点,GG、GA、AA 3种基因型频率分别为1.0、0.0、0.0,G、A等位基因频率分别为1.0、0.0,与Shibata等[2]研究结果不同,表明不同地区及不同人种之间SelS rs28665122基因型分布不同,存在明显的差异;人群中存在SelS rs34713741基因多态性位点,CC、CT、TT 3种基因型频率分别为0.580、0.330、0.089,C、T等位基因频率分别为0.746、0.254,临床资料分析发现rs34713741位点CT和TT基因型在低分化癌组和淋巴结转移组明显增高,其与胃癌组的病理分化程度、淋巴结转移具有相关性,而与年龄、性别、浸润深度、Borrmann分型、肿瘤位置无相关性,说明SelS rs34713741位点多态性可能影响肿瘤的分化程度及淋巴结转移。
同种基因、同一个位点,不同的地理环境,却得出不同的结果,说明基因多态性与环境危险因素之间存在交互作用,极大地增加了胃癌的患病风险,同时胃癌的发生发展涉及多个基因的改变,表现为多基因、多步骤的协同累积作用,因此需要深入研究基因间以及基因与环境间的交互作用。本研究尽管在实验中排除了可能的干扰因素,但样本量有限,其结果需要在不同人群和不同亚群中进行验证,才能得到更加可靠的结果。
| [1] | Chen J, Huang Y, Zhang L. Progress on the study of polymorphism of genes related to gastric cancer[J]. Chengde Yi Xue Yuan Xue Bao, 2012, 29(2): 193-5. [陈健, 黄莹, 张雷. 胃癌相关基因多态性研究进展[J]. 承德医学院学报, 2012, 29(2): 193-5.] |
| [2] | Shibata T, Arisawa T, Tahara T, et al. Selenoprotein S(SEPS1) gene-105G>A promoter polym-orphism influences the susceptibility to gastric cancer in the Japanese population[J]. BMC Gastro-enterol, 2009, 9: 2. |
| [3] | Kossinova O, Malygin A, Krol A, et al. A novel insight into the mechanism of mammalian se-lenoprotein synthesis[J]. RNA, 2013, 19(8): 1147-58. |
| [4] | Olsson M, Olsson B, Jacobson P, et al. Expression of the selenoprotein S (SELS) gene in subc-utaneous adipose tissue and SELS genotype are associated with metabolic risk factors[J]. Metabo-lism, 2011, 60(1): 114-20. |
| [5] | Hishida A, Okada R, Naito M, et al. Polymorphisms in genes encoding antioxidant enzymes (SOD2, CAT, GPx, TXNRD, SEPP1, SEP15 and SELS) and risk of chronic kidney disease in Jap-anese-cross-sectional data from the J-MICC study[J]. J Clin Biochem Nutr, 2013, 53(1): 15-20. |
| [6] | Du S, Liu H, Huang K. Influence of SelS gene silence on beta-Mercaptoethanol-mediated endoplasmic reticulum stress and cell apoptosis in HepG2 cells[J]. Biochim Biophys Acta, 2010, 1800(5): 511-7. |
| [7] | Men LL, Zhou HC, Du JL. The selenoprotein S relationship with diabetes and cardiovascular disease[J]. Guo Ji Nei Fen Mi Dai Xie Za Zhi, 2013, 33(1): 50-2. [门莉莉, 周海成, 杜建玲. 硒蛋白S与糖尿病及心脑血管疾病的关系[J]. 国际内分泌代谢杂志, 2013, 33(1): 50-2.] |
| [8] | Du XA, Xiong YM. The relationship between Selenoprotein S gene mutation and disease[J]. Guo Wai Yi Xue(Yi Xue Di Li Fen Ce), 2013, 34(1): 16-9. [杜新爱, 熊永民. 硒蛋白S基因变异与疾病的研究进展[J]. 国外医学(医学地理分册), 2013, 34(1): 16-9.] |
| [9] | Windmill K, Tenne-Brown J, Bayles R, et al. Localization and expression of selenoprotein S in the testis of Psammomys obesus[J]. J Mol Histol, 2007, 38(1): 97-101. |
| [10] | Wang J, Sun T, Yang M, et al. Association of genetic polymorphisms in selenoprotein GPX1 and TXNRD2 with genetic susceptibility of gastric cancer[J]. Zhonghua Yu Fang Yi Xue Za Zhi, 2008, 42(7): 511-4. [王佳, 孙瞳, 杨明, 等. 谷胱甘肽过氧化物酶1和硫氧还蛋白还原酶2遗传变异与胃癌易癌性的相关性[J]. 中华预防医学杂志, 2008, 42(7): 511-4.] |
| [11] | Curran JE, Jowett JB, Elliott KS, et al. Genetic variation in selenoprotein S influences infla-mmatory response[J]. Nat Genet, 2005, 37(11):1234-41. |
| [12] | Santos LR, Dur?es C, Mendes A, et al. A polymorphism in the promoter region of the seleno-protein S gene (SEPS1) contributes to Hashimoto’s thyroiditis susceptibility[J]. J Clin Endocrinol Metab, 2014, 99(4): E719-23. |
| [13] | Wang JY, Yang IP, Wu DC, et al. Functional glutathione peroxidase 3 polymorphisms associated with increased risk of Taiwanese patients with gastric cancer[J]. Clin Chim Acta, 2010, 411(19-20): 1432-6. |
 2015, Vol. 42
2015, Vol. 42



