文章信息
- 张瑾,李红霞. 2015.
- ZHANG Jin, LI Hongxia. 2015.
- 卵巢上皮癌组织中hMSH2的表达及其与化疗耐药的关系
- hMSH2 Expression in Ovarian Epithelial Cancer Tissues and Its Relationship with Chemoresistance
- 肿瘤防治研究, 2015, 42(06): 571-575
- Cancer Research on Prevention and Treatment, 2015, 42 (06): 571-575
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.09.002
-
文章历史
- 收稿日期:2014-09-10
- 修回日期:2014-12-19
卵巢癌居女性生殖系统肿瘤死亡率首位,虽有标准治疗方案使多数患者达到缓解,但日益严重的化疗耐药现象是导致化疗失败的主要原因。因此,逆转卵巢癌耐药性、提高化疗疗效是提高患者生存率、改善预后的关键。本课题组在前期研究中通过比较大剂量紫杉醇冲击所建立的卵巢癌紫杉醇耐药细胞株与其亲本细胞的基因组差异,发现错配修复(mismatch repair,MMR)家族中的hMSH2基因在紫杉醇耐药卵巢癌细胞株中过度表达[1],沉默hMSH2基因后可以使紫杉醇耐药性得到逆转[2],提示hMSH2基因与卵巢癌紫杉醇耐药有关。 本研究检测hMSH2基因在80例卵巢上皮癌组织中的表达,并采用三磷酸腺苷肿瘤药物敏感度检测(adenosine triphosphate-tumor chemosensitivity assay,ATP-TCA)方法[3, 4, 5]检测卵巢上皮癌对紫杉醇(PTX)、卡铂(CBP)、吉西他滨(GEM)、拓泊替康(TPT)、依托泊苷(VP-16)、多西他赛(TXT)、环磷酰胺体内代谢产物(4-HC)、博莱霉素 (BLM)八种化疗药物的敏感度,分析不同化疗敏感程度卵巢上皮癌组织中hMSH2基因表达的差异及与化疗的相关性,进一步研究卵巢癌化疗耐药的机制,为指导临床治疗、逆转化疗耐药研究方面提供理论基础及依据。 1 资料与方法
1.1 资料
收集2013年3月—2013年11月北京世纪坛医院妇产科住院患者上皮性卵巢癌组织共80例,均由病理证实。其中Ⅰ期8例(10%),Ⅱ期9例(11.2%),Ⅲ期63例(78.8%);高分化6例(7.5%),中分化10例(12.5%),低分化64例(80%);原发65例(81.2%),复发15例(18.8%),复发病例前次化疗方案均为PTX及CBP联合化疗。80例患者均行卵巢癌分期手术,所有组织均为手术中即时采取,新鲜组织放入液氮中快速冷冻,贮存于-80℃冰箱内。组织的采集均经该院伦理委员会批准和患者本人或家属的知情同意。 1.2 主要试剂
hMSH2兔抗人单克隆抗体购自美国Cell Signaling Technology公司;TRIzol试剂购自Invitrogen公司;蛋白质Marker购自美国Fermentas公司;RIPA、PMSF、TEMED、PBS及细胞培养板(瓶)等购自北京鼎国昌盛生物技术有限责任公司。 1.3 实验步骤
1.3.1 按照文献报道对所有80例组织进行八种药物的ATP-TCA药敏试验[4]
取三个参数用于判定药敏试验结果:IC50及IC90,为分别达到50%及90%抑制率的药物浓度;敏感度系数(SI),计算方法为500~5个检测药物浓度(TDC)对应的肿瘤细胞生长抑制率(tumor growth inhibition,TGI)之和,SI值越小,敏感度越高。根据众多学者对SI的取值范围及化疗敏感度预测之间的关系研究[4, 6],本实验中SI截点值设为250。判定结果如下:敏感(sensitivity,S):IC50≤25% PPC;轻度敏感(weak sensitivity,WS):IC90≤100% PPC并且IC50≥25% PPC或SI≤250;耐药(resistance,R):SI>250。将敏感及轻度敏感的组织分为敏感组,耐药的组织分为耐药组。 1.3.2 RT-PCR检测
取50~100 mg冷冻保存的卵巢上皮癌组织置于1.5 ml离心管中,加入1 ml TRIzol充分匀浆,用TRIzol法提取总RNA。根据Genbank设计引物,以β-actin(ACTB)作为检测的内参照,PCR反应引物由北京华大蛋白有限公司合成,hMSH2引物序列:正义:5'-AAG AAG CCC AGG ATG CCA TT-3’,反义:5'-AGC ATC TAG CTG AGC TAA CAC ATC A-3’,扩增产物为100 bp。β-actin引物序列:正义:5'-AGG TCA TCA CCA TTG GCA ATG-3',反义:5'-GGT AGT TTC GTG GAT GCC ACA-3',扩增产物为156 bp。PCR反应条件:50℃ 2 min→95℃ 10 min→(95℃ 15 s→60℃ 1 min)×40个循环(生成扩增曲线)→95℃ 15 s→60℃ 15 s→95℃ 15 s(生成溶解曲线),利用SDS2.2软件对数据进行分析处理,并导出文件及图像。利用β-actin基因对目的基因的表达进行校正,得到相对定量结果,用2-ΔΔCt法计算hMSH2/β-actin比值,得到hMSH2基因mRNA的相对表达值。Ct值(该样品中的基因PCR时达到阈值时经历的循环数)与基因的表达成反比关系,ΔCt=Ct目的基因-Ct参照基因。 1.3.3 Western blot检测
取50~100 mg冷冻的卵巢癌组织,置液氮中研磨成粉末。将研磨好的组织粉末加入浓度为1 mmol/L的裂解液(RIPA: PMSF=100:1)中,每个组织样本加入200 μl裂解液。冰上裂解30 min,4℃,12 000 r/min离心,10 min,100℃变性5 min。取30~40 μl蛋白行10%SDSPAGE电泳,电转移印迹到PVDF膜上,封闭液中孵育1~3 h。加入1:1 000稀释的hMSH2一抗4℃过夜。TBST洗膜10 min,共3次。加入1:5 000 HRP标记的二抗及β-actin,室温孵育1~2 h,TBST洗膜10 min,共3次。使用Odyssey红外激光成像系统扫描,读取结果,并利用图像处理软件Image J对Western blot条带进行图像分析。 1.4 统计学方法
数据输入计算机采用SPSS17.0软件包进行处理,试验结果的相关性采用Pearson’s rank回归分析;计量资料采用t检验;计数资料采用χ2检验。P≤0.05为差异有统计学意义。 2 结果
2.1 ATP-TCA药敏实验结果
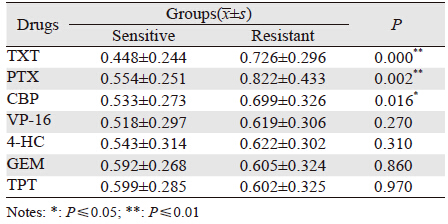
结果显示,所有药物的敏感度差异较大,其中PTX的敏感度最高,为82.5%(P=0.002),所有药物的敏感度顺序为:PTX > CBP > TPT > TXT > GEM > 4-HC > VP-16 > BLM,见表 1。
 |
RT-PCR法检测卵巢上皮癌组织hMSH2基因mRNA的相对表达值差异发现,hMSH2基因mRNA的表达与对化疗药物的敏感度密切相关。对PTX、TXT、CBP及TPT耐药的组织中hMSH2基因mRNA的相对表达值均明显高于敏感的组织(P值分别为0.008、0.010、0.023及0.026),差异有统计学意义,见表 2。
 |
Pearson’s rank相关性分析发现,hMSH2 mRNA的相对表达值与多种药物的SI之间存在明显相关性。最显著的是PTX(r=0.354,P=0.001),其次为TXT(r=0.34,P=0.002)及CBP(r=0.224,P=0.046)。说明hMSH2的mRNA表达水平与卵巢上皮癌对这几种药物的敏感度有关。
在分析不同期别、分化程度及是否为复发卵巢上皮癌的hMSH2 mRNA相对表达值的差异情况时,由于上述分析已证实hMSH2蛋白的表达与PTX、TXT及CBP的SI有显著相关性,因此在试验中分析PTX、TXT及CBP的敏感度时,采用协方差分析除外化疗药物SI对hMSH2 mRNA表达的影响。结果发现早期(Ⅰ、Ⅱ期)卵巢癌组织的hMSH2 mRNA的表达水平明显低于晚期卵巢癌组织(0.0208 vs. 0.0254,P=0.03)。不同分化程度的hMSH2 mRNA的平均相对表达值差异无统计学意义(0.0225 vs. 0.0249,P=0.18)。原发的卵巢癌组织hMSH2 mRNA表达水平明显低于复发的卵巢癌组织(0.0218 vs. 0.0357,P=0.003)。 2.3 不同敏感程度的组织中hMSH2蛋白表达的差异
结果显示,hMSH2蛋白的表达与对化疗药物的敏感度密切相关。对PTX、TXT及CBP耐药的组织hMSH2蛋白的表达灰度值均明显高于敏感的组织(P值分别为0.002、0.000及0.016),差异有统计学意义,见表 3。不同敏感程度的卵巢上皮癌组织中hMSH2蛋白的相对灰度值差异,见图 1。
 |

|
| 图 1 不同敏感程度卵巢上皮癌组织中hMSH2蛋白的Western blot凝胶图 Figure 1 Protein expression of hMSH2 in different ovarian epithelial cancer tissues detected by Western blot |
Pearson’s rank相关性分析发现,hMSH2蛋白的相对表达值与多种药物的SI之间存在明显相关性。最显著的是PTX(r=0.546,P=0.000);其次为TXT(r=0.482,P= 0.000);VP-16(r=0.261,P=0.02);CBP(r=0.217,P=0.05)。说明hMSH2在蛋白表达水平与卵巢上皮癌对这几种药物的敏感度有关。
使用协方差分析发现早期(Ⅰ、Ⅱ期)卵巢癌组织hMSH2蛋白的表达水平明显低于晚期卵巢癌组织(0.550 vs. 0.615,P=0.004)。高、中分化hMSH2蛋白表达水平明显低于低分化卵巢癌组织(0.543 vs. 0.615,P=0.000)。原发卵巢癌组织的hMSH2 蛋白表达水平明显低于复发卵巢癌组织(0.552 vs. 0.811,P=0.005)。
以上结果提示hMSH2基因过度表达与卵巢癌化疗耐药、预后不良相关,PTX及CBP的化疗可能诱导hMSH2基因的高表达。 3 讨论
hMSH2基因是错配修复(MMR)家族的重要成员,MMR为DNA修复系统中的一种修复方式,主要针对DNA复制过程中产生的碱基错配进行切除和修复,维持DNA复制保真性。与人类肿瘤发生有关的MMR基因主要有hMSH2、hMSH6、hMSH3、hMLH1、hPMS1和hPMS2等[7]。关于hMSH2基因的研究最早是关于Lynch综合征(Lynch syndrome),其重要的基因学高危因素即是hMSH2功能缺失,并与常见的消化道、女性生殖系统肿瘤密切相关[8, 9, 10]。本研究结果发现:临床分期晚、低分化的卵巢上皮癌组织及化疗耐药的组织中,hMSH2基因表达明显升高,这可能是由于高度恶性的肿瘤细胞增殖旺盛使错配增多,激发hMSH2代偿性表达增高,造成肿瘤细胞对于化疗药物所致的DNA损伤的修复能力增强,继而导致肿瘤化疗耐药及治疗失败。已有很多学者发现在恶性肿瘤中hMSH2高表达,并且与不良预后相关。李红霞等[1]发现hMSH2基因在卵巢癌耐药细胞株中高度表达,而在亲代卵巢癌细胞株中却未见表达,并且在卵巢低分化癌中hMSH2阳性表达率为93.3%,显著高于中、高分化癌(54.2%)。Materna等[11]分析了73例卵巢癌组织,发现未检测到hMSH2表达的组织中有更高的总生存率和无进展生存期;未检测到hMSH2表达的卵巢癌中患者的存活率明显高于检测到hMSH2表达的卵巢癌(分别为81%和42%,P=0.013)。Vageli等[12]报道肺腺癌患者中,hMSH2高表达与hMSH2低表达的患者相比有更差的预后。在子宫内膜癌中也检测到hMSH2蛋白表达水平显著性增高,且与预后相关[13]。
本研究结果显示,经初次PTX及CBP治疗后又复发的卵巢上皮癌组织中hMSH2基因表达也明显升高,提示化疗可能诱导卵巢癌组织中hMSH2基因的高表达,这很可能是机体的一种代偿反应,其机制是:化疗药物导致肿瘤细胞的DNA损伤,此时激活DNA修复系统,例如包括hMSH2基因在内的MMR,使其修复作用增强,不断地修复由药物造成的碱基错配、片段插入/缺失,以保证DNA复制的忠实性来对抗药物对细胞的损伤杀灭作用,从而造成化疗耐药,影响药物疗效。李红霞等[1]研究发现紫杉醇化疗后的卵巢癌组织中hMSH2基因表达率显著高于未经化疗组,提示该基因的过度表达与紫杉醇耐药有关;在沉默了卵巢癌耐药细胞株中的hMSH2基因后,发现耐药细胞株对紫杉醇的敏感度明显提高。Nadin等[14]发现,化疗后24 h,有83%的顺铂治疗过的肿瘤患者出现hMSH1及hMSH2的表达升高,说明MMR途径是纠正顺铂造成的DNA损伤的重要方式。因此,抑制hMSH2的表达,降低肿瘤细胞对化疗药物所致损伤的修复功能,或许是逆转卵巢癌化疗耐药的新途径。
DNA修复系统与肿瘤化疗耐药、预后的关系已有很多研究,有发现DNA修复系统能对抗修复化疗药物对DNA的损伤,影响肿瘤的预后;抑制DNA修复系统功能可增加化疗药物的敏感度,一些DNA修复抑制剂如MGMT、PARP、DNA依赖性蛋白激酶(DNA dependent protein kinase,DNA-PK)抑制剂已在临床Ⅰ、Ⅱ期试验中显示了良好的效果[15, 16, 17, 18]。hMSH2作为MMR中的主要成分,在DNA损伤修复中起重要作用。因此hMSH2基因可能会成为逆转化疗耐药及肿瘤治疗的新靶点。随着研究的不断深入,进一步讨论hMSH2基因与肿瘤及化疗的关系,可为预防和逆转耐药性提供依据,对提高化疗效果、改善患者预后有重大作用。
| [1] | Li HX, Guan XY, Zhang SM, et al. Study on the relationship of taxol-resistance of ovarian carcinoma with the amplification of 2p22 on chromosome and the expression of hmsh2 gene[J]. Zhong Liu Fang Zhi Yan Jiu, 2006, 33(8): 565-7. [李红霞, 关兴元, 张素梅, 等. 染色体2p22的过度扩增及hmsh2基因的高表达与卵巢癌紫杉醇耐药相关性的研究[J]. 肿瘤防治研究, 2006, 33(8): 565-7.] |
| [2] | Wang AX, Li J, Li H. Study on RNA interference silencing hMSH2 induces the reversal chemo-resistance of ovarian carcinoma cell line OC3/TAX300[J]. Zhonghua Fu Chan Ke Za Zhi, 2014, 49(3): 213-7. [王爱新, 李健, 李红霞. 沉默hMSH2基因表达对紫杉醇耐药的卵巢上皮性癌OC3/TAX300细胞耐药性的影响[J]. 中华妇产科杂志, 2014, 49(3): 213-7.] |
| [3] | Zhang W. Clinical application of in vitro drug sensitivity assay for tumor using ATP-TCA[J]. Ai Zheng Jin Zhan, 2005, 3(5): 427-35. [张伟. 生物荧光肿瘤体外药敏检测技术的临床应用及其探讨[J]. 癌症进展, 2005, 3(5): 427-35.] |
| [4] | Zhao D, Zhang W, Li XG, et al. Predicting clinical chemo-sensitivity of primary ovarian cancer using adenosine triphosphate-tumor chemosensitivity assay combined with detection of drug resistance genes[J]. Zhonghua Fu Chan Ke Za Zhi, 2011, 46(3): 193-8. [赵丹, 张伟, 李晓光, 等. 三磷酸腺苷-肿瘤体外药敏试验联合耐药基因检测预测原发性卵巢癌的化疗敏感性[J]. 中华妇产科杂志, 2011, 46(3): 193-8 .] |
| [5] | Chang QY, Wu LY, Li XG, et al. Cost-effectiveness of adenosine triphosphate-tumor chemosensitivity assay in advanced epithelial ovarian cancer chemotherapy[J]. Ai Zheng Jin Zhan, 2011, 9(2): 191-5,216. [常青云, 吴令英, 李晓光, 等. 三磷酸腺苷-肿瘤体外药敏检测在晚期卵巢上皮癌化疗中的成本-效果评价[J]. 癌症进展, 2011, 9(2): 191-5,216.] |
| [6] | Neubauer H, Stefanova M, Solomayer E, et al. Predicting resistance to platinum-containing chemotherapy with the ATP tumor chemosensitivity assay in primary ovarian cancer[J]. Anticancer Res, 2008, 28(2A): 949-55. |
| [7] | Marcelis CL, van der Putten HW, Tops C, et al. Chemotherapy resistant ovarian cancer in carriers of an hMSH2 mutation?[J]. Fam Cancer, 2001, 1(2): 107-9. |
| [8] | Gu GL, Zhu XQ, Wei XM, et al. Epithelial-mesenchymal transition in colorectal cancer tissue of patients with Lynch syndrome[J]. World J Gastroenterol, 2014, 20(1): 250-7. |
| [9] | Masuda K, Banno K, Hirasawa A, et al. Relationship of lower uterine segment cancer with Lynch syndrome: a novel case with an hMLH1 germline mutation[J]. Oncol Rep, 2012, 28(5): 1537-43. |
| [10] | Yasin SL, Rainbow AJ. A combination of MSH2 DNA mismatch repair deficiency and expression of the SV40 large T antigen results in cisplatin resistance of mouse embryonic fibroblasts[J]. Int J Oncol, 2011, 39(3): 719-26. |
| [11] | Materna V, Surowiak P, Markwitz E, et al. Expression of factors involved in regulation of DNA mismatch repair- and apoptosis pathways in ovarian cancer patients[J]. Oncol Rep, 2007, 17(3): 505-16. |
| [12] | Vageli DP, Zaravinos A, Daniil Z, et al. hMSH2 and hMLH1 gene expression patterns differ between lung adenocarcinoma and squamous cell carcinoma: correlation with patient survival and response to adjuvant chemotherapy treatment[J]. Int J Biol Markers, 2013, 27(4): e400-4. |
| [13] | Li SN, Li L, Wang CZ. Expressions of hMSH2 and MGMT proteins in endometrial caicinoma[J]. Dalian Yi Ke Da Xue Xue Bao, 2011, 33(5): 430-3. [李斯宁, 李玲, 王长智. hMSH2、MGMT在子宫内膜癌中的表达及其病理意义[J]. 大连医科大学学报, 2011, 33(5): 430-3.] |
| [14] | Nadin SB, Vargas-Roig LM, Drago G, et al. DNA damage and repair in peripheral blood lymphocytes from healthy individuals and cancer patients: a pilot study on the implications in the clinical response to chemotherapy[J]. Cancer Lett, 2006, 239(1): 84-97. |
| [15] | Steffensen KD, Smoter M, Waldstrøm M, et al. Resistance to first line platinum paclitaxel chemotherapy in serous epithelial ovarian cancer: The prediction value of ERCC1 and Tau expression[J]. Int J Oncol, 2014, 44(5): 1736-44. |
| [16] | Li QQ, Lee RX, Liang H, et al. β-Elemene enhances susceptibility to cisplatin in resistant ovarian carcinoma cells via downregulation of ERCC-1 and XIAP and inactivation of JNK[J]. Int J Oncol, 2013, 43(3): 721-8. |
| [17] | Mohammed MZ, Vyjayanti VN, Laughton CA, et al. Development and evaluation of human AP endonuclease inhibitors in melanoma and glioma cell lines[J]. Br J Cancer, 2011, 104(4): 653-63. |
| [18] | Syrios J, Banerjee S, Kaye SB. Advanced epithelial ovarian cancer: from standard chemotherapy to promising molecular pathway targets-where are we now?[J]. Anticancer Res, 2014, 34(5): 2069-77. |
 2015, Vol. 42
2015, Vol. 42


